miRNA在哺乳動物配子發生中的作用研究進展
黃曉剛,韓貝貝,李 菊,張守全
(華南農業大學,動物科學繁殖實驗室,廣州 510642)
哺乳動物的二倍體原始生殖細胞需要通過減數分裂和分化才能轉化成單倍體的卵母細胞或精子,這個過程稱為配子發生。雌雄配子的發生是一個多步驟的動態過程,包括3個時期,即增殖期、生長期和減數分裂期,此過程涉及錯綜復雜的基因表達調控,其中包括編碼基因的階段特異性表達調控以及非編碼基因的轉錄和轉錄后水平調控。
微小RNA(microRNA,miRNA)是其中一類小的非編碼RNA,長度為19~22 nt,在真核生物中廣泛表達[1],由具有發夾結構的長度為70~90 nt的單鏈RNA前體經核糖核酸內切酶(Dicer)加工后生成,通過識別靶基因非翻譯區的結合位點,導致mRNA降解或者蛋白質翻譯抑制,從而在轉錄后水平發揮調節作用[2-3]。近年來研究顯示,miRNA參與生命過程中的一系列重要進程,包括早期胚胎發育、細胞增殖、細胞凋亡和細胞死亡等,它們在哺乳動物生殖活動中的作用也逐漸被揭示,部分研究表明,miRNA在哺乳動物精子發生、精子成熟、顆粒細胞增殖、卵母細胞成熟、卵泡發育及早期胚胎發育等過程中都發揮著重要作用[4-5]。因此,了解miRNA在這些過程中的作用機理對探究哺乳動物生殖活動的分子機制具有深遠影響。作者主要就miRNA在哺乳動物生殖細胞配子發生中的表達和潛在作用進行綜述,以期為深入研究哺乳動物配子發生調控機制提供參考。
1 miRNA在精子發生中的作用
精子發生是一個復雜的過程,包括精原細胞的有絲分裂增殖、早期精母細胞的形成、單倍體圓形精子的產生、染色質凝聚和核成形、多余細胞質的去除以及頂體和精子尾部的形成[6]。這一過程不僅受階段特異性表達的編碼基因的調控,還伴隨著非編碼基因的調節,其中,miRNA以細胞特異性的形式表達,通過對其靶mRNA轉錄后調節的方式在精子發生過程中發揮作用[7]。
在對哺乳動物精子發生的早期研究中,有學者通過調節對睪丸形成和精子發生具有關鍵作用的支持細胞的功能,揭示了不同miRNA在精子發生中的潛在作用[8]。后續研究表明,Dicer是miRNA加工必不可少的RNA核酸內切酶,若缺失會導致成熟的miRNA完全丟失[9],將支持細胞中的Dicer1選擇性失活后,會導致生精小管內精子喪失及生精障礙[10],這表明miRNA在精子發生中具有重要作用。此外,Sara等[11]研究表明,miRNA表達的改變會導致精子異常,進一步證明miRNA對精子發生具有不可或缺的作用。近年來,許多體內和體外功能研究顯示某些miRNA可通過調節支持細胞、精原干細胞和精細胞的功能和狀態在精子發生的過程中發揮重要作用(表1)。
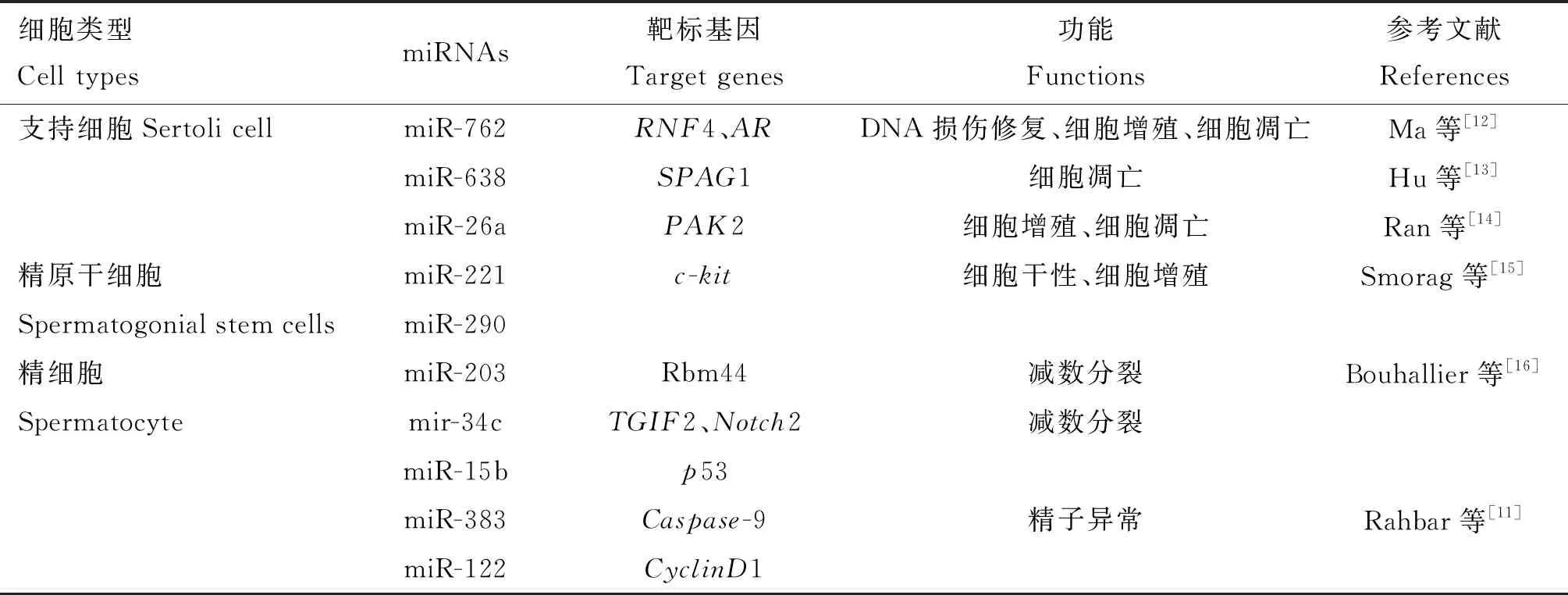
表1 miRNA在哺乳動物精子發生中的作用
1.1 miRNA對支持細胞的作用
支持細胞的功能對精子發生的順利進行必不可少。在豬睪丸中,miR-762可以通過下調環指蛋白4(RNF4)和雄激素受體(AR)基因的表達及促進DNA損傷修復,從而促進未成熟支持細胞的增殖并抑制其凋亡,進而在精子發生中發揮作用[12]。miR-638則與miR-762相反,它通過抑制精子相關抗原1(SPAG1)基因的表達,間接滅活PI3K/Akt信號通路,從而促使豬睪丸中未成熟的支持細胞發生凋亡[13];同樣地,miR-26a在豬睪丸組織不同發育階段差異表達,可以通過靶向與精子形成有關的P21蛋白激活激酶2(PAK2)基因來抑制睪丸支持細胞的增殖并促使其凋亡,從而阻礙精子的產生[14]。以上研究結果表明,miRNA參與支持細胞增殖和凋亡的調控。因此,研究不同發育階段的支持細胞中miRNA的差異表達將有助于揭示精子發生早期過程的調控機制。
1.2 miRNA對精原干細胞和精細胞的作用
miRNA除了調節支持細胞的增殖和凋亡外,還參與精子發生的后續過程。其中,miR-221可能通過抑制干細胞生長因子受體(c-kit)基因的表達與miR-290家族共同維持精原干細胞的干性,從而調節精原細胞和原代精母細胞的增殖[15];miR-203可以介導RNA結合蛋白44(Rbm44)基因表達的抑制,從而調節精細胞的減數分裂[15];miR-34c在生殖細胞中特異性表達,并且主要在減數分裂后期表達,可通過下調轉化生長因子誘導因子同源框2(TGIF2)和Notch受體2(Notch2)基因的表達,在精子發生過程中發揮作用[16];miR-34家族可能與細胞周期阻滯和減數分裂進程有關,從而在精子發生后期發揮關鍵作用[15]。此外,miR-15b、miR-383和miR-122也可通過改變p53、半胱天冬酶9(Caspase-9)和細胞周期蛋白D1(CyclinD1)等靶基因的表達水平,參與調節精子異常[11]。以上研究結果表明,miRNA除了通過調節支持細胞的增殖和凋亡,間接參與調控精子發生外,還可以通過調節精原細胞、精母細胞及精細胞的細胞周期進程,直接調控精子發生。因此,研究雄性生殖細胞中miRNA的特異性表達將有助于揭示精子發生后續過程的調控機制。
1.3 miRNA在精子附睪成熟過程中的表達
精子在睪丸中形成后,需要通過附睪以獲得運動能力和受精能力。選擇性敲除小鼠附睪細胞中的Dicer1基因后,會導致其分化失調[17],推測miRNA在附睪發育和精子成熟中也具有調節作用。在精子通過附睪的過程中,附睪不但會以附睪小體的方式將蛋白質轉運至精子上[18],也會分泌不同的miRNA并且轉運至精子上[19],其中包括牛附睪頭含量較高的miR-145、miR-143、miR-214和miR-199,以及附睪尾含量較高的miR-654、miR-1224和miR-395[20]。在小鼠附睪中,精子具有復雜的miRNA組成,并且在精子沿附睪移動的過程中,miRNA的組成會發生改變[21],表明精子miRNA的組成在精子發生后是動態的。miR-21a、miR-29c、miR-199a、miR-200b/c和miR-10a/b等miRNA在睪丸精子中含量相對較少,但在附睪的精子中會隨著精子成熟而逐漸積累[19];miR-467e主要聚集在附睪頭部,miR-204b-5p和miR-375-3p在附睪頭和附睪體中含量較高,而miR-208b-3p、miR-196b-5p和miR-34c則在附睪尾含量較高[22]。雖然近年來已有研究表明miRNA在附睪中具有重要作用,但仍需要通過更進一步的研究來探明miRNA在精子通過附睪的過程中是如何調節精子成熟的。
2 miRNA在卵子發生中的作用
在卵子發生的過程中,卵母細胞與顆粒細胞、卵泡膜細胞等卵泡內的體細胞相互作用,促使成熟的卵母細胞通過排卵而釋放。其中,顆粒細胞通過產生雌二醇(E2)[23]并以縫隙連接的方式使得卵母細胞與卵泡膜細胞之間的雙向通訊橋交叉連接,從而參與調節卵母細胞的發育和成熟[24-26]。
在卵母細胞發育和成熟的過程中,已通過功能性敲除Dicer1基因[27]、Argonaute蛋白2(AGO2)基因(miRNA加工機制中RNA誘導的基因沉默復合體的關鍵組成部分)[28]和核糖核酸酶(drosha)基因(負責Pri-miRNA加工的基因)[29]證明miRNA的作用。miRNA在卵母細胞的發育中也表現出階段特異性,如當豬卵母細胞從生發泡(GV)期進入第二次減數分裂中期(MⅡ)時,miR-486、miR-10b、miR-10a-5p、miR-183和miR-21升高,miR-210和miR-27b-3p降低[30];牛GV和MⅡ期卵母細胞之間存在包括miR-130b在內的幾種miRNAs的差異表達[31],并且有30種miRNAs僅在其GV期卵母細胞中表達,包括miR-208a、miR-2317、miR-2320、miR-365-5p、miR-584、miR-628和miR-876等,有35種miRNAs僅在其MⅡ期卵母細胞中表達,包括miR-144、miR-1603、miR-190b、miR-29b、miR-29c、miR-29e、miR-412和miR-449b等[32]。近年來,許多體內和體外功能研究顯示,某些miRNA通過調節卵母細胞、卵丘細胞和顆粒細胞的功能和狀態在卵子發生過程中發揮作用(表2)。
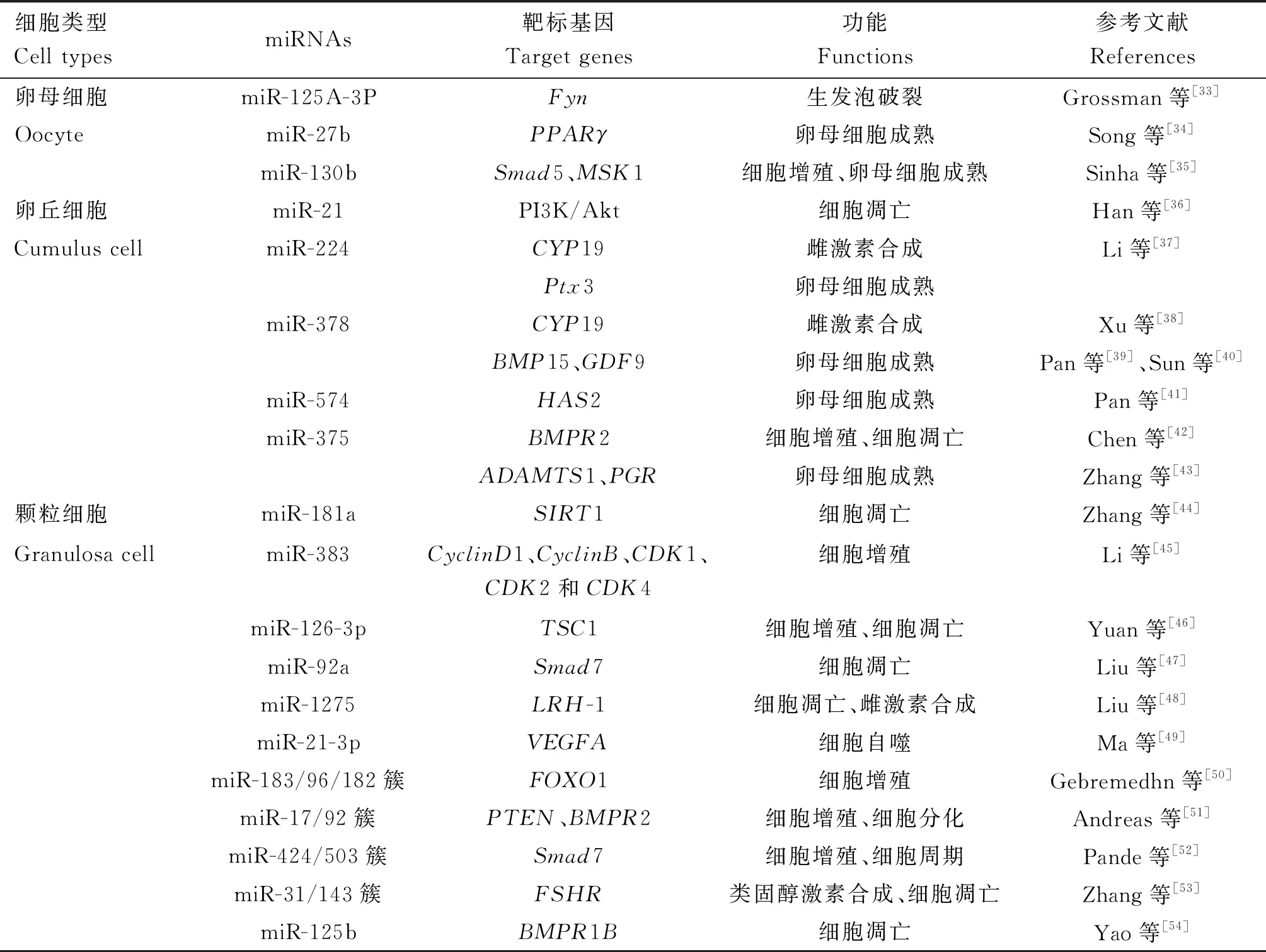
表2 miRNA在哺乳動物卵子發生中的作用
2.1 miRNA對卵母細胞的作用
在小鼠卵母細胞成熟的過程中,miR-125a-3p自身會下調,使得蛋白酪氨酸激酶(Fyn)基因表達上調,從而促進生發泡破裂[33];miR-27b則會通過靶向過氧化物酶體增殖物激活型受體γ(PPARγ)基因調節脂肪酸代謝,從而影響豬卵母細胞的成熟[34];而在牛卵母細胞發育的過程中,miR-130b通過靶向Smad家族成員5(Smad5)和絲裂原和應激激活蛋白激酶1(MSK1)基因促進卵母細胞成熟以及卵丘細胞和顆粒細胞的增殖[35]。這些研究證明miRNA對卵母細胞成熟過程具有調節作用,但關于不同發育階段卵母細胞中miRNA表達的研究相對較少。因此,miRNA對卵母細胞成熟過程的調節機制仍需要進一步的研究來完善和豐富。
2.2 miRNA對卵丘細胞的作用
miR-21通過激活PI3K/Akt信號傳導抑制豬和小鼠卵丘細胞凋亡[36];miR-224下調豬卵丘細胞中芳香化酶(CYP19)基因的表達,導致E2水平降低,并且可以通過下調卵丘細胞中的正五聚蛋白3(Ptx3)基因的表達,對卵母細胞成熟產生抑制作用[37];miR-378同樣可以靶向芳香化酶調節卵巢E2的產生[38],也可能會通過抑制卵丘細胞與卵母細胞的相互作用及下調卵丘細胞中與卵泡發育相關的骨形態發生蛋白15(BMP15)和生長分化因子9(GDF9)基因的表達,間接影響豬和小鼠卵母細胞的成熟能力[39-40];miR-574直接靶向卵丘細胞中的透明質酸合成酶2(HAS2)基因(卵丘細胞產生細胞外基質的關鍵酶)抑制其表達,同樣對豬卵母細胞成熟產生抑制作用[41];miR-375靶向骨形成蛋白Ⅱ型受體(BMPR2)基因影響BMP15/GDF9受體的表達水平,從而影響牛卵丘細胞的增殖和凋亡[42],也可以通過抑制卵丘細胞中的Ⅰ型血小板結合蛋白基序的解聚蛋白樣金屬蛋白酶(ADAMTS1)和孕酮受體(PGR)基因的表達,抑制牛卵母細胞的體外成熟[43]。這些發現顯示miRNA不但可以調節卵丘細胞的增殖和凋亡,還可以調節其細胞間作用。因此,研究卵丘細胞中miRNA的表達將有助于揭示卵丘細胞調節卵母細胞發育的分子機制。
2.3 miRNA對顆粒細胞的作用
miR-181a通過下調沉默信息調節因子2相關酶1(SIRT1)基因的表達增加轉錄因子叉頭框轉錄因子O亞族1(FOXO1)的乙酰化并促進小鼠顆粒細胞凋亡[44];miR-383通過下調與細胞周期相關蛋白(CyclinD1、CyclinB、CDK1、CDK2和CDK4)基因的表達,抑制小鼠顆粒細胞的增殖,從而影響卵母細胞的發育[45];miR-126-3p通過靶向并抑制結節性硬化復合物1(TSC1)基因的表達,從而促進豬顆粒細胞增殖并抑制細胞凋亡[46];miR-92a通過靶向Smad家族成員7(Smad7)基因同樣起到抑制豬顆粒細胞凋亡的作用[47];miR-1275通過靶向并下調肝受體同源物1(LRH-1)基因的表達,阻斷肝受體同源物1/腦內細胞色素P450芳香酶(LRH-1/CYP19A1)軸,促使豬顆粒細胞凋亡并抑制E2合成[48];miR-21-3p通過PI3K/Akt信號通路下調靶標血管內皮生長因子A(VEGFA)基因的表達,從而抑制牛顆粒細胞自噬[49];miR-183/96/182簇通過協同靶向FOXO1基因,促進牛顆粒細胞的增殖,從而影響卵母細胞的發育[50];miR-17/92簇通過共調節第10號染色體缺失性磷酸酶和張力蛋白同源物基因(PTEN)和BMPR2基因的表達來調節牛顆粒細胞的增殖和分化[51];miR-424/503簇通過激活素信號通路靶向Smad7基因來調節牛顆粒細胞增殖和細胞周期進程,從而影響卵母細胞發育[52];miR-31/143通過靶向促卵泡素受體(FSHR)基因調節類固醇激素的合成,并影響牛顆粒細胞的凋亡[53];miR-125b通過靶向骨形成蛋白Ⅰ型受體B(BMPR1B)基因調節牦牛顆粒細胞的凋亡[54]。這些發現顯示miRNA參與調節顆粒細胞的增殖和凋亡,而顆粒細胞通過產生E2和縫隙連接的方式參與調節卵母細胞的發育和成熟,研究顆粒細胞中miRNA的表達及其對激素合成和縫隙連接的作用有助于更進一步揭示顆粒細胞調節卵母細胞發育和成熟的分子機制。
4 小 結
miRNA在哺乳動物配子發生到配子成熟的過程中具有重要的調控作用。在精子發生的過程中,miRNA會以細胞特異性的形式在支持細胞、精原干細胞和精細胞中表達并發揮調控作用;在卵母細胞成熟的過程中,miRNA除了對卵母細胞直接發揮調控作用外,還會影響卵丘細胞和顆粒細胞的增殖及激素合成,從而間接參與調控卵母細胞的發育和成熟。此外,前人的研究結果也已證明,miRNA由于序列較短,在哺乳動物中結構相對穩定,未來很有可能成為判斷哺乳動物繁殖能力的分子標記。但是,大部分miRNA的功能尚未明確,其中包括miRNA與miRNA之間的互作調控關系以及miRNA在時空差異表達上的自身調控機制等。近年來有研究表明,環狀RNA(circRNA)可以作為miRNA的海綿,調控miRNA的活性[55]。 因此,在研究miRNA對靶基因作用機制的基礎上,探究circRNA對miRNA的調控作用,將有助于更深入地揭示miRNA的具體作用機制及其自身的調控方式。

