基于快速康復外科的全程營養管理模式在食管癌病人圍術期的應用
劉 玲,陳 英,喻 紅
華中科技大學同濟醫學院附屬同濟醫院,湖北 430000
食管癌是常見的消化道腫瘤之一,手術是食管癌的主要治療方式[1],其特點是手術創傷大,術中消化道重建,術后并發癥多,住院周期長[2‐3]。食管癌是已知與癌癥相關營養不良相關性最高的疾病之一。研究表明,食管癌病人術前營養不良發生率為50%~80%[4],術后營養不良發生率為70%[5]。營養不良是影響食管癌病人預后及生活質量的重要因素。基于加速康復外科(ERAS)的全程營養管理模式是指在ERAS 理念指導下,建立圍術期全程規范化的營養管理模式[6],其可通過顯著改善病人圍術期營養狀況,促進病人快速康復。本研究將基于ERAS 的全程營養管理模式應用于食管癌病人圍術期護理,取得了良好效果,現將結果報道如下。
1 對象與方法
1.1 研究對象 選取2019 年7 月—2020 年1 月在我科行食管癌根治術的病人作為研究對象,采用隨機數字表法將病人隨機分為觀察組和對照組。納入標準:①病理學(石蠟切片)診斷為食管癌;②擬進行三切口食管癌根治術;③意識清楚,具有溝通能力與文字書寫能力;④自愿參加本研究。排除標準:①合并心、肝、腎等重要臟器疾病;②嚴重惡病質或體質指數(BMI)≥25 kg/m2;③因各種原因導致研究無法進行;④術中傷及喉返神經。剔除標準:術后洼田飲水試驗為Ⅲ~Ⅴ級。最終對照組和觀察組各納入病人45 例。兩組病人入院時年齡、性別、體重、BMI、血清清蛋白、轉鐵蛋白、前清蛋白等資料比較,差異無統計學意義(P>0.05),見表1。
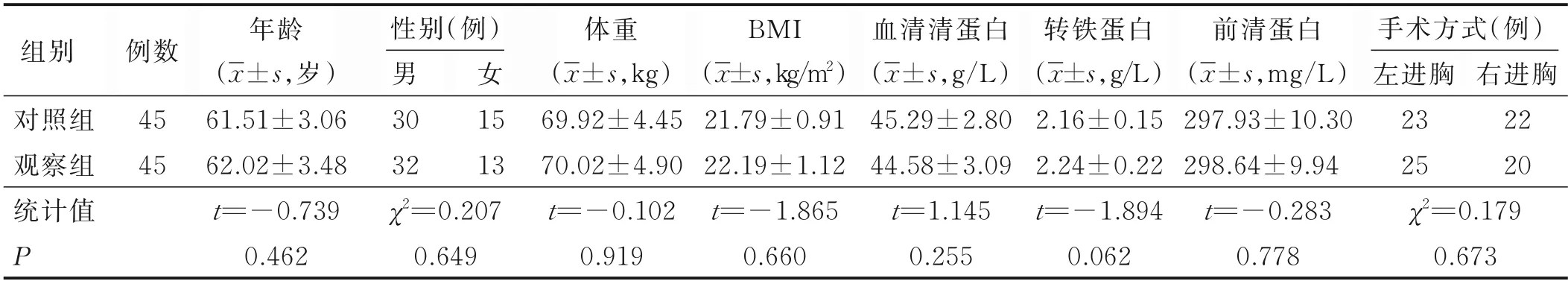
表1 兩組病人一般資料比較
1.2 對照組干預方法 實施常規圍術期營養干預。入院后由責任護士對病人進行飲食指導,術前1 d 告知病人術前6 h 禁食、2 h 禁飲;術后遵醫囑給予腸內營養聯合靜脈營養干預。
1.3 觀察組干預方法 實施基于ERAS 的全程營養管理模式。
1.3.1 成立多學科營養管理小組 營養管理小組成員包括管床醫生1 名、營養師1 名、護士長1 名以及具備營養咨詢師資質且專科工作經驗>5 年的主管護師2 名。護士長擔任組長,負責協調小組工作,并對小組工作進行監督和反饋;營養師負責對病人進行營養會診,根據病人情況與管床醫生共同制訂、調整營養方案;主管護師負責對病人進行營養風險評估,遵醫囑實施營養治療并及時反饋營養治療中存在的問題等。
1.3.2 營養風險篩查和評估 入院時采用營養風險篩查評分簡表(NRS2002)對病人進行營養風險篩查。NRS2002 包括疾病嚴重程度、營養受損情況、年齡評分3 個維度,總分<3 分表示無營養風險,總分≥3 分時表示存在營養風險。對NRS2002<3 分者每周進行1次營養評估;對NRS2002≥3 分者3 d 進行1 次營養評估,并采用病人整體評估量表(PG‐SGA)進行評估,以期及早發現病人存在的營養不良狀況,如PG‐SGA≥3分,則請營養師會診,由營養師與管床醫生共同制訂針對性的營養管理方案。
1.3.3 全程營養管理1.3.3.1 術前 ①入院時重點向病人講解食管癌圍術期營養治療的重要性,以及我科實施營養治療的具體措施,發放《病人飲食記錄表》要求病人記錄每日進食量,推薦的能量供給為25~30 kcal/(kg·d)(1 kcal=4.186 kJ),蛋白質為1.0~1.5 g/(kg·d)[7]。②營養小組護士采用能量計算軟件(FatSecret 卡路里計算器)計算病人每日能量達標情況,若病人當日營養未達標,口服能全素(德國Milupa GmbH 生產,整蛋白型腸內營養劑)補充營養,其服用方法為9 平勺+200 mL 溫開水稀釋后口服,每日3 次,必要時給予靜脈營養補充。③對入院評估為營養不良和存在嚴重營養風險的病人進行7~14 d 營養治療,待病人營養狀況調節至最佳狀態時再考慮進行手術治療。④手術病人術前晚口服我院自制的能量制劑(主要成分為麥芽糊精),其服用方法為術前22:00 給予能量制劑1 袋(100 g,能量407 kcal),溫開水稀釋至400 mL 后口服,術日05:00 給予能量制劑1/2 袋(50 g,能量203.5 kcal),溫開水稀釋至200 mL 后口服。術前6 h 禁食、2 h 禁飲。
1.3.3.2 術后 ①手術當天給予病人全腸外營養(TPN),目標能量供給為25 kcal/(kg?d)。②術后第1天以腸外營養為主,腸內營養為輔。術后12 h 采用腸內營養泵(紐迪希亞有限公司生產,型號為Flocare Ⅱ)將500 mL 的5%葡萄糖氯化鈉注射液以50 mL/h 速度經鼻腸管輸入,其余營養需要量通過靜脈補充,靜脈營養總能量為25~30 kcal/(kg?d)。③術后第2 天采用腸內營養泵將500 mL 百普力[紐迪希亞制藥(無錫)有限公司生產,每瓶500 mL,能量為每瓶500 kcal]以30~50 mL/h 勻速輸入,其余營養需要量通過靜脈補充,靜脈營養總能量為1 000~1 200 kcal。④術后第3天至吻合口愈合期間逐漸增加腸內營養量,目標量為每日輸入百普力1 500 mL,遞增速度為每日20~30 mL,增至125 mL/h 后維持速度不變。靜脈營養逐漸減少直至停止。⑤吻合口愈合后行洼田飲水試驗,方法為病人取端坐位,囑其將30 mL 溫開水盡量一次性咽下,觀察全部飲完時有無嗆咳、飲水次數和時間[8]。對洼田飲水試驗為Ⅰ級或Ⅱ級的病人在管飼飲食基礎上給予經口飲食相關指導,包括進食量、進食次數、進食種類等,具體內容為:經口進食第1 天以流質飲食為主,如米湯、牛奶、豆漿等,每日7 次或8 次,每次50 mL,攝入能量為150~200 kcal;同時,給予百普力1 500 mL 經鼻腸管輸入。經口進食第2 天以半流質飲食為主,如餛飩、湯面、瘦肉粥等,每日6~8 次,每次約100 g,攝入能量為500~650 kcal;同時,給予百普力1 000 mL 經鼻腸管輸入。經口進食第3 天以軟食為主,如軟米飯、爛面條等,每日6~8 次,攝入能量為1 000~1 100 kcal;同時,給予百普力500 mL 經鼻腸管輸入。經口進食第4 天逐步過渡到普食,每日6~8 次,推薦攝入能量為1 500~1 700 kcal。經口進食量滿足機體需要量時拔除鼻腸管。⑥病人行腸內營養時遵循六度原則,即角度為臥床病人床頭抬高30°~45°;速度以20~50 mL/h 開始,6~8 h 根據病人耐受性調整1 次;溫度為營養液常溫;濃度為從低濃度開始,逐漸增加濃度;清潔度要求現配現用;適應度通過密切觀察病人耐受性確定。病人行腸內營養期間,營養小組主管護師需4 h 采用腸內營養耐受性評分表評估1 次病人腸內營養耐受情況,并指導病人實施腸內營養。量表包括腹痛腹脹、惡心嘔吐、腹瀉3 個條目,總分0~2分提示需繼續進行腸內營養支持,增加或維持原速度;總分3 分或4 分提示需繼續進行腸內營養支持,減慢速度,2 h 后重新評估;總分≥5 分提示需暫停腸內營養支持,并進行相應處理[9]。
1.3.3.3 出院指導和延續護理 出院當天為病人發放我科醫護人員編制的《食管病人術后飲食指導手冊》并根據病人出院時的進食情況給予詳細的飲食指導。通過微信群及出院隨訪等方式為病人提供居家飲食指導等。
1.4 評價指標 ①比較兩組病人首次排氣時間、首次排便時間、首次下床活動時間、吻合口愈合時間。吻合口愈合標準:食管碘海醇造影檢查結果提示吻合口愈合[10]。②比較兩組病人術后并發癥發生率,包括肺部感染發生率、胃腸道癥狀(腹痛腹脹、惡心嘔吐、腹瀉)發生率及吻合口瘺發生率。其中,肺部感染由管床醫生于術后7 d 觀察評估,具體標準為術后咳黃痰、膿痰;術后發熱,體溫≥38.5 ℃;出現肺實變體征和(或)聞及濕啰音;白細胞計數>12×109/L;細菌培養可見致病菌;胸部X 線或者胸部CT 提示片狀、斑片狀浸潤性陰影或肺間質性改變。符合以上1~5 項標準中的任何一項加上第6 項即可診斷為肺部感染。胃腸道癥狀由主管護師于病人術后1 d 至鼻腸管拔管期間采用腸內營養耐受性評分表[11]進行評估。吻合口瘺由管床醫生于病人住院期間評估。③比較兩組病人術后7 d 和出院后7 d 的營養監測指標水平,包括體重、BMI、血清清蛋白、轉鐵蛋白、前清蛋白水平。
1.5 統計學方法 采用SPSS 20.0 進行數據處理,定性資料采用頻數及百分比(%)進行統計描述,組間比較采用χ2檢驗;定量資料采用均數±標準差(±s)進行統計描述,組間比較采用兩獨立樣本t檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 兩組病人首次排氣時間、首次排便時間、首次下床活動時間、吻合口愈合時間比較(見表2)
表2 兩組病人首次排氣時間、首次排便時間、首次下床活動時間、吻合口愈合時間比較(±s)

表2 兩組病人首次排氣時間、首次排便時間、首次下床活動時間、吻合口愈合時間比較(±s)
組別觀察組對照組t 值P例數45 45首次排氣時間(h)13.04±1.46 18.09±3.26-9.472<0.001首次排便時間(h)33.93±2.15 45.22±3.72-17.644<0.001首次下床活動時間(h)28.31±3.57 49.56±6.34-19.589<0.001吻合口愈合時間(d)6.41±0.86 11.07±1.92-14.834<0.001
2.2 兩組病人術后并發癥發生率比較(見表3)

表3 兩組病人術后并發癥發生率比較單位:例(%)
2.3 兩組病人營養監測指標比較(見表4、表5)
表4 兩組病人術后7 d 營養監測指標比較(±s)

表4 兩組病人術后7 d 營養監測指標比較(±s)
組別觀察組對照組t 值P例數45 45體重(kg)68.51±4.92 66.48±4.74 1.996 0.049 BMI(kg/m2)20.91±0.93 19.52±0.71 7.936<0.001血清清蛋白(g/L)41.53±2.30 38.31±1.77 7.445<0.001轉鐵蛋白(g/L)2.16±0.19 1.95±0.20 5.046<0.001前清蛋白(mg/L)297.76±10.29 280.07±7.23 9.434<0.001
表5 兩組病人出院后7 d 營養監測指標比較(±s)

表5 兩組病人出院后7 d 營養監測指標比較(±s)
組別觀察組對照組t 值P例數45 45體重(kg)69.56±4.32 67.26±4.50 2.479 0.015 BMI(kg/m2)21.29±0.77 19.80±0.86 8.595<0.001血清清蛋白(g/L)43.62±2.33 39.20±1.73 10.233<0.001轉鐵蛋白(g/L)2.66±0.27 2.24±0.18 8.500<0.001前清蛋白(mg/L)307.11±8.26 288.60±6.31 11.942<0.001
3 討論
3.1 基于ERAS 的全程營養管理模式可以促進病人術后快速康復 本研究對對照組45 例病人實施常規圍術期營養干預,對觀察組45 例病人采用基于ERAS的全程營養管理模式,結果顯示,觀察組病人術后首次排氣時間、首次排便時間、首次下床活動時間,吻合口愈合時間均短于對照組(P<0.05)。病人排氣排便時間是衡量術后胃腸道功能恢復的重要標志,術后早期下床活動是快速康復的重要內容。食管癌根治術需從頸部、胸部、腹部3 個部位操作,手術創傷較大,術中對食管、胃腸道改建及術后腸道炎性因子釋放增加等均易導致病人術后出現胃腸道功能紊亂。此外,由于手術創傷導致病人體力消耗較大,營養損失嚴重,病人術后常會出現體力不支,導致臥床時間較長。潘梅霞等[12]指出,早期下床活動時間是食管癌根治術后病人胃腸功能恢復的保護性因素。本研究觀察組通過術前對病人進行營養干預,增加術前營養儲備,術后給予早期腸內營養,有利于保護胃腸道黏膜屏障,促進術后胃腸道功能恢復,為后續腸內營養供給提供前提條件,進而為病人體力恢復盡早下床活動提供營養支持;同時,病人下床活動也可進一步促進胃腸道功能恢復。由此可見,胃腸道功能恢復、早期下床活動、營養干預三者相輔相成。吻合口愈合是食管癌病人術后恢復狀況的最重要觀測指標之一。多項研究表明,對食管癌手術病人進行營養干預,能夠促進吻合口愈合,降低吻合口瘺發生率[13‐14]。吻合口愈合依賴充足的營養供給,需給予足夠的營養底物。本研究觀察組加強圍術期營養管理,術后主要通過百普力進行腸內營養,其主要碳源為葡萄糖漿和麥芽糊精,氮源為植物油、中鏈乳清蛋白水解物,含有合理比例的礦物質、維生素等微量元素。此外,本研究觀察組在術后早期腸內營養無法滿足病人機體需要時還會及時給予腸外營養進行補充,保證了病人術后營養供給,為吻合口愈合提供了營養條件。
3.2 基于ERAS 的全程營養管理模式可以降低病人術后并發癥發生率 ERAS 理念已廣泛運用于臨床。李寧等[15‐16]研究結果顯示,對食管癌病人實施ERAS護理可促進病人術后胃腸功能恢復,減少肺部炎癥等并發癥發生。欒穎等[17]指出,對老年食管癌病人進行圍術期ERAS 護理能夠促進病人術后康復。本研究將ERAS 理念與全程營養管理模式相結合,觀察組病人在圍術期營養先行,有利于促進病人快速康復效果,研究結果顯示,觀察組術后并發癥發生率低于對照組(P<0.05)。觀察組病人胃腸道并發癥發生率低,原因可能為:①觀察組病人術前晚口服營養制劑,術后12 h 內接受早期腸內營養,病人腸道禁食禁飲時間縮短,有利于保護病人胃腸道黏膜屏障。②觀察組術后均使用百普力短肽營養制劑。百普力作為短肽預消化型營養制劑,不要求病人具備完整的消化道功能,可直接吸收,有利于降低病人腹瀉和腹脹發生風險[18]。③觀察組病人腸內營養時鼻腸管置入深度均過幽門達十二指腸,趙杰等[19]指出,幽門后喂養可降低胃腸道相關并發癥發生率。④病人腸內營養過程中遵循六度原則,營養小組護士采用腸內營養耐受性評分表及時、準確地評估病人腸道耐受情況,并及時給予相應處理措施,有利于減輕病人胃腸道癥狀。
3.3 基于ERAS 的全程營養管理模式可以改善病人術后營養狀況 本研究結果顯示,觀察組病人術后7 d和出院后7 d 的營養指標(體重、BMI、血清清蛋白、轉鐵蛋白、前清蛋白)水平均高于對照組,差異有統計學意義(P<0.05)。食管癌病人營養不良發生率高,朱琳等[20]指出,中國食管癌病人總營養風險發生率為52%。病人術前存在進行性吞咽困難,存在不同程度的營養不良。術后消化道結構重建,病人不能正常進食,通過鼻腸管給予腸內營養,會出現不同程度腸內營養不耐受,導致病人易出現消化道和胃腸道癥狀,進一步加劇營養不良,因此對病人實施全程營養管理尤為重要。本研究中,觀察組病人術后7 d 的營養指標較術前有所降低,但高于對照組(P<0.05),可能與觀察組注重對病人進行術前營養干預以及術后百普力短肽營養制劑補充有關。郝帥[21]指出,術前營養補充可明顯促進食管癌病人術后恢復,改善其營養狀態。張鷹等[22‐23]也指出,術前早期營養干預可以改善病人圍術期營養狀況,減少圍術期體重丟失,減少并發癥。此外,本研究觀察組術后行早期腸內營養,并給予百普力營養制劑,不僅可以盡早啟動病人術后腸道功能,而且能提高病人術后腸道耐受性,減少胃腸道反應,為病人術后營養供給提供保障。
本研究兩組病人出院后7 d 的營養指標水平比較,差異有統計學意義(P<0.05),可能是由于本研究對觀察組病人實施了規范化的全程營養管理模式,且在病人出院后通過微信群、電話隨訪等多種方式給予病人居家營養指導,提高了病人營養狀況。已有研究表明,營養狀況是食管癌術后病人遠期生存率的獨立影響因素[24]。提示,不僅需要對住院期間的病人進行營養干預,病人出院后的居家營養干預也十分重要。
4 小結
食管癌病人手術創傷較大,病人營養狀況較差,術后并發癥較多,住院周期較長,治療負擔較重,亟須尋找一種有效的護理模式促進食管癌病人術后康復。第二屆全民營養周提出“健康中國,營養先行”的口號[25],可見營養對人體,尤其是對病人十分重要。本研究對食管癌病人實施基于ERAS 的全程營養管理模式,結果表明,其有利于病人快速康復,減少術后并發癥發生,改善病人營養狀況。

