LSS基因功能缺失對雄性小鼠生殖的影響
孫曉梅,李名聰,2,李 濤,魏 翔,葛若木,張 軍,李昱昊,周 青,汪 淵,張勝權,張素梅
不育癥影響了全球8%~12%的夫妻,其中男性因素約占50%。男性不育與損害精子發生有關[1]。精子發生是一個高產且高度組織化的過程[2],精子發生是從二倍體精原干細胞(spermatogonial stem cell,SSC)提供單倍體精子的細胞分化過程。睪酮、促卵泡生成激素(follicle-stimulating hormone,FSH)和促黃體生成激素(luteinizing hormone,LH)等激素的缺失會引起生殖細胞凋亡[3]。膽固醇是哺乳動物細胞生長和生存所必需的,并且是性激素合成的前體[4]。羊毛固醇合成酶(lansterol synthase,LSS)是膽固醇合成途徑中的一個關鍵酶,催化(S)-2,3-環氧角鯊烯轉化成羊毛固醇。LSS雙等位基因突變的患者不僅會表現少毛癥、白內障、脫發伴智力低下(alopecia with mental retardation,APMR)綜合征、隱形神經外胚層綜合征等疾病,還會出現小陰莖的現象[5-7]。有研究[8]顯示,LSS抑制劑會降低前列腺癌細胞的活力,并在體外誘導細胞凋亡。該研究通過LSS敲除小鼠模型,探討LSS基因缺陷對雄性小鼠生殖功能的影響。
1 材料與方法
1.1 實驗動物及試劑
1.1.1實驗動物 實驗采用的動物均為C57BL/6品系,LSS基因敲除的F1代小鼠購自南京大學南京生物醫藥研究所,于安徽醫科大學動物中心SPF級環境中飼養及配繁,動物飼養環境嚴格保證在溫度為(20±2)℃, 相對濕度為40%~70%且明暗交替時間12/12 h的環境下,自由進食水。所有實驗動物的操作與飼養均符合國標及安徽省實驗動物中心管理飼養條例。
1.1.2主要試劑 Premix Taq (TaKaRa Taq Version 2.0 Plus dye)和DL2000 bp DNA marker購自大連寶生物工程有限公司;鼠尾基因型鑒定試劑盒購自上海碧云天生物公司;LSS基因引物由南京大學南京生物醫藥研究所設計,引物及瓊脂糖粉末購自生工生物工程(上海)股份有限公司,LSS引物序列為:Primer F:5′-ACCTCTGCGGAGTCTAAGGAAG-3′、Primer R:5′-AAGGCTCTTCACTGTTTCAGAGCT-3′;Tubulin購自上海Abmart公司;LSS/Bax/Bcl-2購自美國Santa Cruz公司、GPX4購自美國Thermo Scientific公司;所有使用的二抗購自北京中杉金橋生物技術有限公司。
1.1.3儀器 DYY-6C電泳儀購自于北京市六一儀器廠;普通PCR儀購自美國賽默飛公司;酶標儀(1510)購自美國Thermo Scientific公司;制冰機(SCOTSMAN)購自德國Leica公司;全自動數碼凝膠圖像分析儀購自上海勤翔科學儀器有限公司。
1.2 實驗方法
1.2.1小鼠基因型鑒定 ① 鼠尾基因組DNA提取:將DNA Extraction Solution 和 Enzyme Mix 按照48 ∶2的比例充分混勻,配制成消化液。剪取0.2~1 cm的小鼠尾尖放置于250 μl的PCR管內,向其中加入配置好的消化液50 μl。將樣品置于PCR儀中,55℃、15 min,95℃、5 min,結束后加入50 μl Stop Solution,在渦旋器上混勻,以提取小鼠基因組DNA。② PCR擴增:PCR擴增反應體系(25 μl):12.5 μl Premix Taq 、1 μl F引物(10 μmol/L)、1 μl R引物(10 μmol/L)、1 μl DNA模板、加入滅菌ddH2O 9.5 μl。采用PCR擴增儀進行循環擴增,反應條件:預變性94 ℃、3 min ,變性94 ℃、30 s,退火55℃、30 s,延伸72℃、40 s,循環35次,72℃、10 min終止反應。③ 瓊脂糖凝膠電泳:取PCR產物5 μl,在1.6%瓊脂糖凝膠中及電壓90 V下,電泳90 min,于化學發光凝膠成像系統中進行拍照分析。④ 基因型結果判定:根據PCR擴增產物長度來進行判斷,擴增產物在328 bp左右的為野生型(WT),擴增產物在328 bp和282 bp左右兩條帶均存在的為雜合子(LSS+/-)。
1.2.2生育力檢查 將8周齡的鼠按基因型和雌雄不同,分組配繁,第一批WT型和KO型雌雄各取2只,共8只鼠;第二批WT型雌雄各取5只,KO型鼠雌雄各取6只,共22只,兩批總計30只鼠,分別按♂WT×♀WT、♂WT×♀KO、♂KO×♀WT、♂KO×♀KO進行1:1合籠,時長4個月,統計每胎平均生仔個數、產仔周期。
1.2.3性激素檢測 取雄性WT型和KO型小鼠各10只,留取血清檢測性激素。
1.2.4TUNEL染色觀察睪丸中生殖細胞凋亡情況 常規制備石蠟切片,脫蠟、水合,加入細胞通透液8 min,PBS漂洗2次,滴加TUNEL反應混合物,37℃孵育1 h,沖洗樣品,在熒光顯微鏡下觀察分析,滴加轉化劑-POD,37℃孵育30 min,洗樣品,滴加DAB底物溶液,室溫孵育10 min,光學顯微鏡鏡下觀察凋亡細胞并拍照。
1.2.5Western blot檢測凋亡相關蛋白表達 根據小鼠睪丸組織的大小,加入適量的裂解液以提取總蛋白,在BCA法檢測蛋白濃度后,采用SDS-PAGE凝膠電泳,配置相應濃度的膠,分離蛋白并轉至PVDF膜,用5%脫脂牛奶在室溫下封閉2 h,加入相應的一抗,4℃過夜,加入對應的由辣根過氧化物酶標記的二抗室溫孵育2 h,每步結束后,均要用TBST洗膜3次,每次10 min。用ECL化學發光劑進行顯色,用Image J軟件進行灰度值分析,計算蛋白表達情況。

2 結果
2.1 小鼠基因型鑒定結果和LSS蛋白表達提取鼠尾DNA進行PCR擴增,電泳后的結果如圖1所示:其中1、3、6、7、8號只出現一條328 bp左右的條帶,為野生型(WT);2、4、5、9、10號出現328 bp和282 bp左右的兩條帶,為雜合子(LSS+/-);與WT型相比,基因敲除小鼠的LSS蛋白表達量降低(t=18.00,P<0.05)。見圖1。
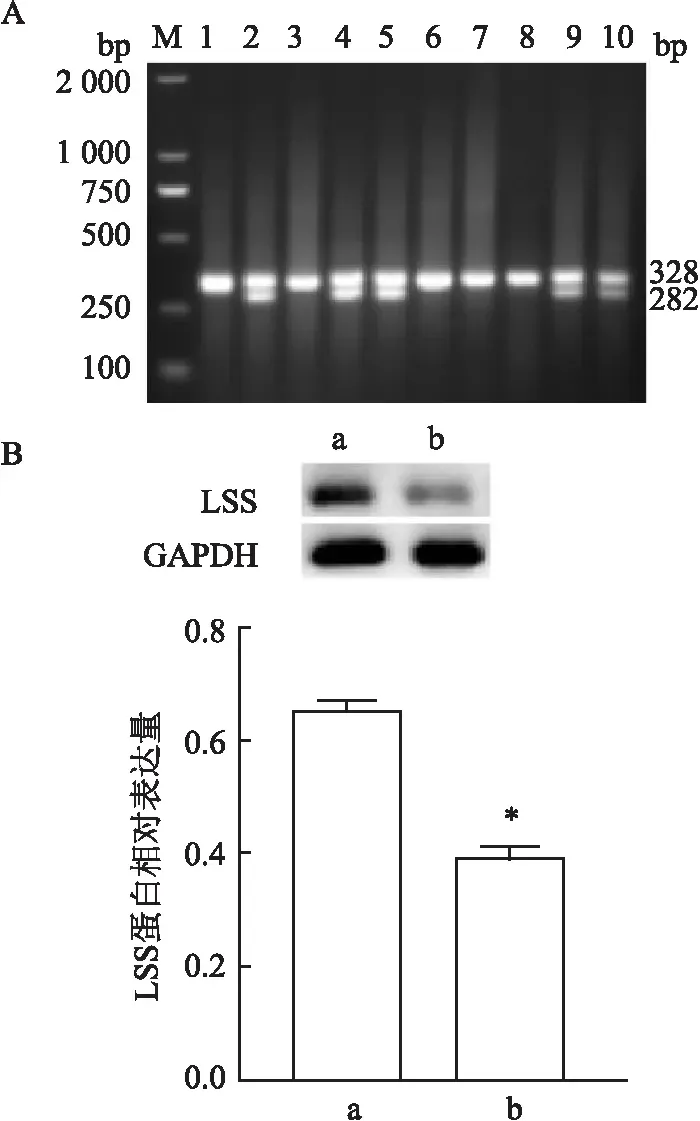
圖1 小鼠PCR基因型鑒定和Western blot 法檢測LSS蛋白在野生型和雜合子小鼠睪丸組織中表達水平的結果
2.2 LSS基因缺陷對雄性小鼠生育力可能有影響4組兩兩比較,平均產仔周期(F=1.837,P=0.155)差異均無統計學意義;每胎平均生仔個數(F=4.602,P=0.007),差異有統計學意義,根據SNK-q檢驗分析顯示♂WT×♀WT與♂KO×♀KO組比較有差異,其余組別差異均無統計學意義(表1)。
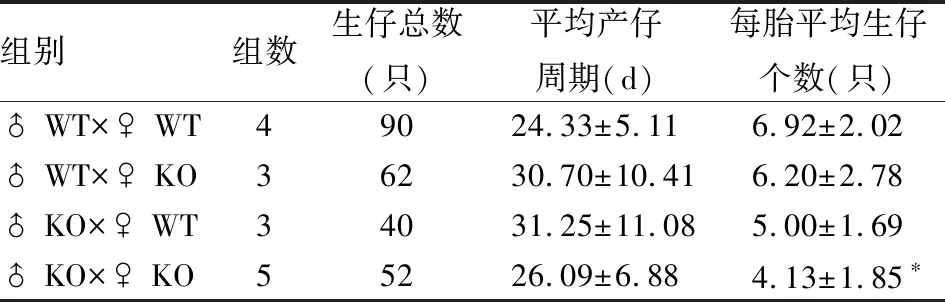
表1 LSS基因缺陷對雄性生育力無影響(n=30)
2.3 LSS基因缺陷對雄性小鼠性激素無影響采用獨立樣本Mann-Whitney U檢驗對KO型與WT型小鼠兩組分析,性激素五項水平差異均無統計學意義,表明LSS基因敲除對C57小鼠性激素水平無影響(表2)。
2.4 TUNEL染色觀察睪丸中生殖細胞凋亡情況TUNEL陽性細胞為紅色顆粒的細胞,TUNEL染色結果顯示,凋亡細胞多存在于精原細胞和精母細胞,凋亡細胞染色較深,可見細胞核固縮、裂解等形態學改變。WT組的睪丸組織中很少見到凋亡細胞,KO 型小鼠睪丸組織凋亡細胞增多(圖2)。
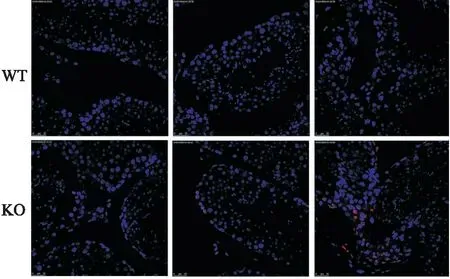
圖2 6只野生型和雜合子小鼠睪丸TUNEL染色的結果WT:野生型小鼠對照組;KO:基因雜合敲除型小鼠
2.5 Western blot檢測凋亡相關蛋白表達基因缺陷小鼠的睪丸組織中,凋亡相關蛋白Bax(t=0.340,P=0.751)、Bcl-2(t=0.962,P=0.390)、GPX4(t=0.641,P=0.557)與野生型小鼠相比,差異均無統計學意義(圖3)。
3 討論
LSS在膽固醇合成途徑的關鍵環化反應中合成羊毛固醇。LSS在膽固醇合成過程中起決定性作用,它可能成為新型抗膽固醇藥的目標,也可以確定為抗心絞痛藥物嗎多明的靶標[9-11]。而LSS功能缺失對小鼠生殖功能的影響至今未有文獻報道。
本研究結果表明,當LSS基因敲除后,與野生型小鼠相比,小鼠睪丸組織TUNEL染色結果顯示,KO型小鼠生精細胞凋亡水平高于WT型小鼠。兩組配繁結果顯示生仔周期無差異,每胎平均生仔個數當雌雄均為LSS型小鼠時有差異,性激素水平相比也無差異。用 Western blot 法檢測凋亡相關蛋白在野生型和雜合子小鼠睪丸組織中表達水平時,顯示促凋亡相關蛋白Bax和抗凋亡相關Bcl-2的蛋白表達無差異,表明睪丸組織生精細胞發生凋亡可能不是通過控制線粒體膜的通透性來調節凋亡刺激物。由于GPX4是一種可以修復脂質過氧物,抑制其觸發由脂質膜的氧化損傷驅動的一種細胞死亡(鐵死亡)[12],本研究結果顯示GPX4蛋白表達無差異,表明引起睪丸組織生精細胞發生凋亡的不是因為鐵死亡這條凋亡通路。參與細胞凋亡的途徑眾多,介導LSS敲除小鼠生精細胞凋亡的蛋白和分子機制尚有待進一步研究。此外,研究[13]表明:他汀類藥物(羥甲基戊二酸單酰CoA抑制劑)可通過降低類固醇激素睪酮的生成和精子膜膽固醇的量來對男性生殖有負面影響。也有研究[14]發現對倉鼠和狗中使用LSS抑制劑治療后,在身體多個部位觀察到組織病理學變化,而睪丸病變的特征是睪丸萎縮,生殖細胞耗竭和變性、生精小管塌陷及前列腺和精囊萎縮變小等。本研究在LSS基因雜合敲除小鼠中觀察到睪丸生精細胞凋亡水平高于WT型小鼠,提示、LSS基因敲除通過抑制睪丸生殖細胞生產而抑制小鼠生殖能力。

表2 LSS基因缺陷對雄鼠性激素水平無影響 (n=10)

