黃原膠對大豆分離蛋白凝膠流變特性和微觀結構的影響
劉 冉,曾慶華, ,梁 明,王 雷,程 霜
(1.聊城大學農學院,山東聊城 252000;2.聊城市食品藥品檢驗檢測中心,山東聊城 252000)
大豆分離蛋白(Soy protein isolate, SPI)是從脫脂豆渣中分離出來的主要副產物,具有良好的加工性能、優異的營養價值和較低的生產成本,在食品行業內得到廣泛應用[1-2]。SPI的凝膠性是其最重要的功能特性之一,蛋白質分子通過疏水相互作用、靜電作用、氫鍵以及二硫鍵等作用力聚集并形成網絡結構,可以作為多種食物成分的載體如水、脂肪、糖以及風味成分等,對于提高食品品質和改善食品質構具有重要的作用,因此無論是作為天然食品原料還是輔料,SPI都可用于食品加工中[3]。
SPI的凝膠特性不僅和蛋白質組成和結構有關,還受其他因素的影響,如蛋白質濃度、變性程度、離子強度、加熱條件和pH等[4]。雖然有很多方法可以改善SPI凝膠的性能,但提高SPI凝膠的自修復性能和獲得優異的力學性能仍然是目前研究難點問題[3]。為了進一步改善SPI的凝膠特性,將其制備成多糖-蛋白質復合體系是一種有效的措施。與單一蛋白質凝膠體系相比,蛋白質-多糖的相互作用對多組分體系的界面性質有重要作用,并能影響食品的結構、質地、功能和穩定性,這種復合方式通常能更有效地調節凝膠質地[5-7]。目前,SPI已經成為植物蛋白和多糖構建復合凝膠的典范。Zhao等[8]研究表明,在大豆蛋白中加入棉子糖和大豆多糖,可顯著提高凝膠硬度和保水能力。Zhao等[9]發現魔芋膠、結冷膠和可得蘭膠可以提高SPI凝膠的硬度和保水性,增強了凝膠強度,有利于凝膠形成,并改善微觀結構。Perrechil等[10]研究表明,刺槐豆膠的加入導致SPI凝膠的強度和持水能力的增加,而不依賴于蛋白質的狀態(天然或變性)。Monteiro等[11]研究了半乳甘露聚糖對大豆蛋白熱誘導凝膠特性的影響,結果表明,隨著多糖鏈的長度增加,凝膠速率增加,凝膠起始溫度降低,凝膠硬度和彈性增加。
黃原膠(Xanthan gum,XG)是由黃單胞菌產生的一種胞外分支多糖。它的主鏈由β-1,4糖苷鍵連接的D-葡萄糖構成,每兩個葡萄糖單位連接一個三糖分支(甘露糖-葡萄糖-甘露糖),屬于陰離子多糖[12]。黃原膠由于其剛性結構,在酸性和堿性條件下都能保持穩定,并具有獨特的功能特性,常用于乳化劑、穩定劑和發泡劑應用于食品、藥品等領域,但其本身不具有膠凝特性,屬于非凝膠型多糖,不能單獨做凝膠劑使用[13]。對于SPI和非凝膠性多糖的混合物,添加非膠凝性多糖通常用于促進SPI凝膠化或調節SPI凝膠結構,主要形成半互穿網絡凝膠[1]。然而,關于XG對SPI凝膠特性的影響的報道相對較少。因此本實驗以XG和SPI復合體系為基礎,研究添加XG對SPI復合凝膠體系流變性能和微觀結構的影響,旨在獲得具有更加優質性能的SPI復合凝膠,以拓寬SPI的應用領域。
1 材料與方法
1.1 材料與儀器
SPI 高唐藍山基團有限公司;葡萄糖酸內酯國產分析純。
DHR-1型旋轉流變儀 美國TA;JY92-Ⅱ超聲波細胞粉碎機 寧波新藝超聲設備有限公司;ZNCLBS 140 mm智能磁力攪拌器 上海弘懿儀器設備有限公司;SB-2000水浴鍋 日本EYELA;EVO-LS10掃描電鏡 德國ZEISSE Oberkochen。
1.2 實驗方法
1.2.1 超聲波處理XG-SPI分散液 超聲波處理參考劉冉等[3]的方法。準確稱取5 g SPI置于燒杯中,加入超純水配制成10%(m/V)SPI分散液50 mL,在室溫下磁力攪拌2 h至充分溶解,并放置于4 ℃冰箱中備用。用直徑為0.636 cm的超聲波探頭深入大豆蛋白溶液表面1~2 cm來處理SPI分散液,超聲功率為400 W,超聲時間10 min。在SPI分散液中加入XG,超聲處理5 min,使其混合均勻,獲得復合分散液。SPI的最終濃度為10%,XG的最終濃度為0.1%、0.3%和0.5%,未加XG作為對照組。
1.2.2 XG-SPI凝膠制備 參考曹連鵬等[14]方法并略有改動。將復合分散液在80 ℃水浴鍋中加熱20 min,加入葡萄糖酸內酯充分攪拌,葡萄糖酸內酯最終濃度為0.1%,樣品冷卻至室溫后,放入4 ℃冰箱中,靜置過夜,即獲得復合凝膠。
1.2.3 流變特性試驗
1.2.3.1 樣品準備 參考Brito-Oliveira等[15]方法并略有改動,進行流變特性試驗,選擇直徑40 mm平板夾具,將樣品放置在流變儀的平板上,平板間距設置為1.0 mm。用刮刀去除外板上多余的樣品,表面涂硅油,防止水分蒸發。樣品在測試前平衡5 min,以卸載試樣添加過程中的殘余應力,并保持恒溫。流變測試項目包括應變掃描,頻率掃描,溫度掃描和時間掃描所有樣品測試3次。
1.2.3.2 應變掃描試驗 應變掃描是振蕩試驗中的第一個測試,可以確定樣品線性黏彈區,程序參數:應變范圍為1%~1000%,頻率1 Hz,溫度25 ℃[15]。
1.2.3.3 頻率掃描試驗 頻率掃描參數:應變2%(處于線性黏彈區域內),溫度25 ℃,頻率0.1~10 Hz[15]。測定G′、G′′和tanδ隨頻率的變化。G′和G′′角頻率變化的趨勢可以采用Power-law流變模型來進行擬合[9]。

式中:K′和K′′—冪律常數;n′ 和n′′—頻率指數,可以表示模量對頻率的依賴程度;ω—角頻率。
1.2.3.4 時間掃描試驗 先將凝膠樣品按照1.2.3.1進行應變掃描,隨后馬上進行時間掃描,從流變指標G′和G′′的變化情況分析凝膠樣品的自修復能力。時間掃描參數:應變2%,頻率1 Hz,溫度25 ℃,時間600 s。
1.2.3.5 應變階躍試驗 參考劉瑞雪等[16]方法并略有改動。應變階躍掃描參數:頻率1 Hz,溫度25 ℃。測定程序為:a.對凝膠施加2%應變,時間為45 s;b.對凝膠施加500%應變,時間為30 s;c.重復前兩步試驗,測定G′、G′的變化。

式中:G′為第二次(或第三次)小應變的G′;G′0為第一次小應變初始G′。恢復率可以反映凝膠自修復程度。
1.2.3.6 溫度掃描試驗 溫度掃描參數:應變2%,頻率1 Hz,溫度以3 ℃/min的升溫速率從25 ℃升高到100 ℃。測定G′和G′′隨溫度的變化。
1.2.4 宏觀凝膠自修復能力測試 參考黃河等[17]方法并略有改動。將凝膠平均分為兩部分,一部分使用羅丹明B染液浸沒染色,之后使兩部分斷面充分相互接觸。并使用聚乙烯薄膜將試樣密封在培養皿中,以確保試樣在試驗過程中不丟失水分。一段時間后檢測自修復效果。
1.2.5 復合凝膠微觀結構的觀察 參考江連洲等[18]方法并略有改動。將凍干后的凝膠(SPI凝膠和0.5% XG-SPI凝膠)切成大小均勻的正方塊貼于導電膠上,噴金后,將帶有樣品的載物臺放入掃描電鏡的進樣室,在真空條件下進行觀察,電壓為5 kV,放大倍數為100和200。
1.3 數據處理
所有試驗均重復3次,結果表示為平均值±標準差(mean±SD)。利用minitab 17.0軟件進行單因素(ANOVA)方差分析。
2 結果與分析
2.1 黃原膠對大豆分離蛋白復合凝膠黏彈性的影響
商用SPI因蛋白質變性程度較大,降低了蛋白之間相互聚集的能力,從而導致凝膠性能變差[19]。對SPI進行超聲波預處理,可以改變變性SPI的聚集程度,將包埋在蛋白分子內部的疏水基團和巰基暴露出來,隨后再進行預加熱和酸化,凝膠化就能順利進行[20]。預加熱可以使蛋白之間形成聚集體,但此時體系為中性環境,蛋白之間具有較大的靜電斥力。隨后通過葡萄糖酸內酯緩慢分解,逐漸降低了體系的pH,蛋白之間靜電斥力逐漸減小,蛋白之間更大程度地進行聚集和交聯,形成凝膠網絡結構[21]。據報道,在凝膠pH4.8時,帶負電荷的XG與蛋白質聚集物相互作用更強[22]。
通過小應變振蕩實驗研究了不同濃度XG對凝膠流變特性的影響。頻率掃描可以反映凝膠的黏彈性,圖1為不同濃度XG-SPI復合凝膠頻率掃描圖。結果顯示,無論是SPI凝膠還是XG-SPI凝膠樣品在頻率掃描過程中彈性模量(Storage modulus, G′)均高于黏性模量(Loss modulus, G?),表明樣品的彈性性能強于粘性性能,損耗因子(tanδ=G′/G?)在0.3左右,表明具有良好的凝膠網絡結構。XG-SPI復合凝膠的G′和G?值隨XG濃度(0.1%~0.5%)的增大而增大,tanδ隨XG濃度(0.1%~0.5%)的增大而減小。與SPI單一凝膠相比,XG-SPI復合凝膠具有更高的G′和G?,更低的tanδ,其粘彈性能得到明顯提高。
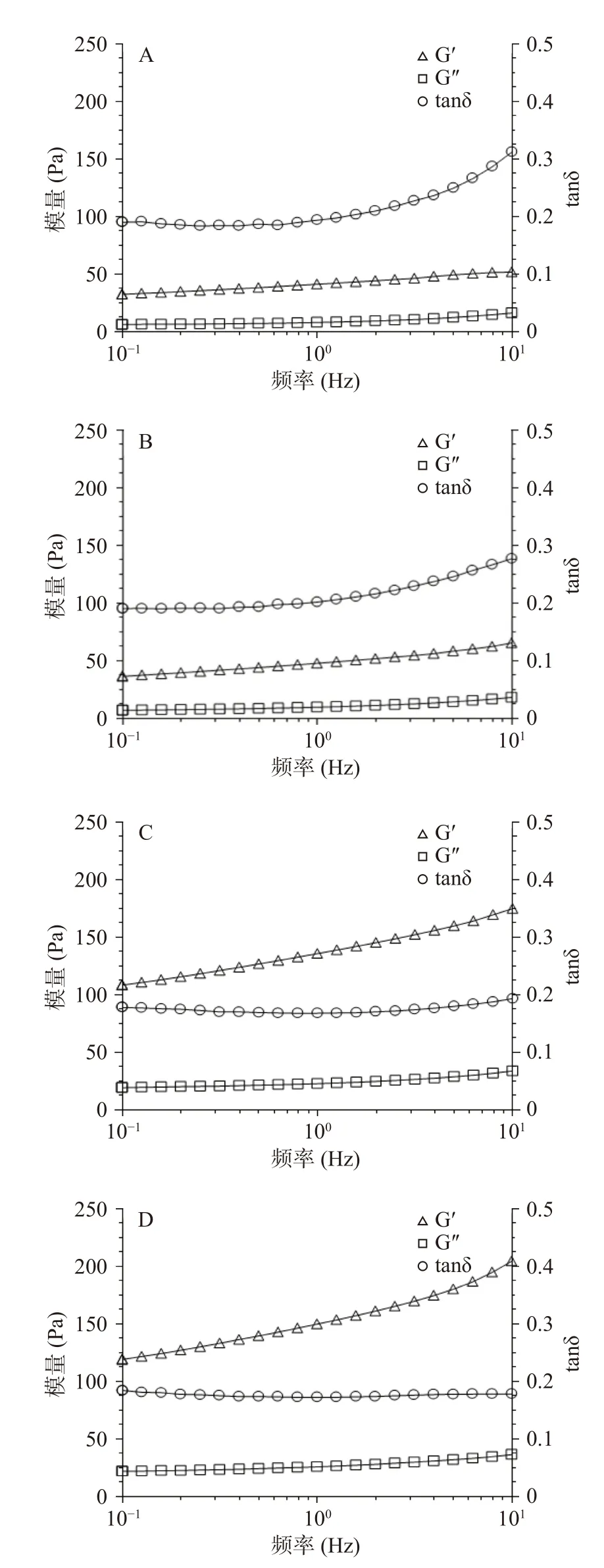
圖1 凝膠頻率掃描圖Fig.1 Frequency sweep of gels
從圖1看出,SPI和XG-SPI凝膠的G′和G?會隨頻率增大而增大,均表現出一定的頻率依賴性,此類型的凝膠介于弱凝膠和強凝膠之間,屬于物理型凝膠。頻率掃描結果擬合冪率模型結果如表1所示,XG的加入顯著改變了SPI凝膠的動態流變性能(P<0.05)。n'和n''表示G′和G?隨頻率變化的程度,可以反應材料的黏彈信息[23]。隨著XG濃度的增大,凝膠的K′和K′′值增大以及n'和n''值減小,表明XG降低了凝膠對頻率的依賴程度,XG-SPI復合凝膠逐漸從弱凝膠向強凝膠轉變。Chang等[24]研究也發現在SPI中添加XG顯著改變了XG-SPI的流變特性,XG-SPI混合凝膠的K′和K′′值遠高于SPI單一凝膠。由此可以看出XG的添加有利于SPI凝膠形成更加強壯的網絡結構。

表1 XG-SPI凝膠的冪率模型參數Table 1 Parameters of power law model of XG-SPI gels
2.2 自修復能力
目前評價自修復凝膠主要采用宏觀評測和流變學評價兩種方法[25-26]。宏觀評測是人為地給凝膠制造損傷后觀察其愈合狀況,該方法可以直觀評價凝膠自修復過程,但是難以定量表征自修復程度。流變學評價可以彌補宏觀評測的缺點,是采用流變儀給凝膠施加一定的形變,造成其損傷后分析G′和G?的變化,定量表征凝膠內部結構的自修復程度[25]。首先,先通過宏觀觀測評價SPI凝膠修復性能,一部分SPI凝膠樣品用羅丹明B進行染色,并將兩部分不同顏色的凝膠切斷(圖2A),再將兩塊不同顏色凝膠斷面貼合在一起顏色界限清晰(圖2B),室溫放置4 h后斷面完全消失,顏色界限變模糊,兩部分凝膠融合在一起(圖2C),說明SPI凝膠具有自修復性能。

圖2 凝膠宏觀自修復過程Fig.2 Self-healing process of gel
為了進一步驗證SPI凝膠自修復能力,利用流變儀進行應變掃描和時間掃描測試(圖3)。所有的凝膠樣品在應變達到500%時,G′小于G?,凝膠結構完全被破壞,由凝膠(gel)轉變為溶膠(sol)。在達到1000%應變后,立即在線性黏彈區(γ=2%)進行時間掃描,凝膠樣品的模量迅速增大,恢復到凝膠狀態,SPI凝膠G′僅能恢復56%,隨XG濃度的增大恢復率有所增加,0.5% XG-SPI凝膠G′恢復率能達到77%。多糖-蛋白混合凝膠主要通過動態的非共價鍵(靜電相互作用和氫鍵)實現自修復性能,凝膠自修復的時間跟凝膠樣品的濃度、破損程度和內部結構有關[27-28]。由圖4B也可以看出自修復時間的差別,SPI凝膠和0.1% XG-SPI凝膠由于凝膠黏彈結構相對較弱,流動性較強,因此在小應變時間掃描中模量在6 s內就恢復穩定。而0.3% XG-SPI和0.5% XG-SPI凝膠由于結構相對較強,流動性相對較差,自修復時間相對較長。0.3% XG-SPI需要大約50 s恢復穩定狀態,0.5% XG-SPI則需要更長的時間大約100 s。

圖3 凝膠自修復能力的流變測試Fig.3 Rheological testing of self-healing ability of gels

圖4 凝膠應變階躍掃描曲線Fig.4 Alternating step strain sweep of gels
為進一步表征凝膠自修復性能的可重復性,對凝膠進行階躍式應變掃描。由圖4可知,在第一次小應變掃描下,由于凝膠為初始狀態,G′和G?為初始值。在第一次大應變掃描下,SPI凝膠和0.1% XGSPI凝膠G′下降,G?增加;0.3%和0.5% XG-SPI凝膠G′和G?均下降。同一凝膠G′小于G?,即大應變下樣品處于溶膠狀態。凝膠經歷第二次小應變掃描時,G′大于G?,樣品從溶膠重新轉變成凝膠狀態,與初始值相比,G?幾乎完全恢復,而G′恢復率相對較小,依次為56%、63%、66%和76%。第二次大應變掃描情況跟第一次相同。第三次小應變掃描跟第二次具有相同的趨勢,G′恢復率依次為45%、56%、60%和73%。階躍式應變掃描結果表明,SPI和XG-SPI凝膠可重復在大應變下結構破壞變成溶膠,在小應變下依靠可逆的非共價鍵作用,結構能重新建立,從溶膠轉變成凝膠,其自修復行為可重復。同時可以看出,SPI凝膠遭受大應力損傷后,凝膠結構不能完全恢復,且隨著大應變次數增加,即損傷次數的增加,恢復率會持續降低,而XG的加入有利于提高SPI凝膠的恢復率,且隨著濃度的增加,恢復率也隨之增加。XG的添加提高了SPI凝膠的粘彈性,使其網絡結構更加穩固,因此力學性能增強,流動性能減弱,導致凝膠結構損傷后,自修復時間延長,這是XG給SPI自修復性能帶來的不利因素,但與此同時XG可以幫助SPI凝膠結構重新建立,有利于提高恢復率。
2.3 熱穩定性
為了研究XG對SPI凝膠熱穩定性的影響,利用流變儀對凝膠樣品進行了升溫掃描。蛋白凝膠結構與溫度有關,當溫度升高會造成分子運動速率的增加,蛋白肽鏈間的相互作用(如氫鍵和靜電作用)會減弱,交聯結構遭到破壞,表現為G′和G?下降,當溫度持續升高或高溫作用時間增長時可能會引起凝膠結構全面崩解,出現凝膠到溶膠(G′=G?)狀態的轉變,此時即達到凝膠轉變溫度(Tgel-sol)[19,29]。如圖5所示,所有的凝膠樣品隨溫度的升高G′和G?均表現出下降的趨勢,在相對低的溫度范圍內(25~75 ℃)模量下降速率相對較慢;在相對高的溫度范圍內(75~100 ℃)模量下降速率相對較快。對于SPI凝膠經過加熱后結構破壞比較嚴重,當溫度升高到88 ℃時,達到Tgel-sol。0.1% XG-SPI復合凝膠在溫度達到75 ℃后G′下降速率也非常快,但G′仍略高于G?,未出現Tgel-sol,其結構未完全崩塌。0.3%和0.5% XG-SPI復合凝膠模量下降的速率明顯低于前兩者,G′一直大于G?,雖然高溫對復合凝膠結構有一定的破壞,但其仍維持著相對穩定的網絡結構。XG的分子量大且分枝多,多糖主鏈和側鏈穿插在蛋白網絡里面,起到穩定蛋白的網絡結構的作用,從而緩解高溫對蛋白網絡的損壞。推測多糖的添加可以加強蛋白質之間的相互作用,從而提高蛋白凝膠網絡結構的穩定性[8]。

圖5 凝膠溫度掃描圖Fig.5 Temperature sweep of gels
2.4 掃描電鏡
SPI和XG-SPI凝膠的掃描電鏡圖如圖6所示。SPI和XG-SPI凝膠都具有疏松、多孔的海綿狀網絡結構。通過對比兩種凝膠樣品的微觀結構未見明顯的差別。許多報道都指出多糖會影響蛋白凝膠的微觀結構。Zhao等[9]發現,0.3%和0.5%魔芋膠、結冷膠和卡德蘭膠與SPI形成的復合凝膠均比單一的SPI凝膠具有更加均勻和致密的微觀結構。Chang等[24]在對SPI凝膠進行研究時發現,XG、瓜兒豆膠(Guar gum, GG)的存在對SPI的微觀結構影響較大,SPI單凝膠的微觀結構更加均勻,而混合凝膠的微觀結構則較為粗糙。Perrechil等[10]研究發現,SPI單一凝膠與刺槐豆膠-SPI凝膠的微觀結構相似,但添加刺槐豆膠促進了蛋白質更強烈的聚集,并導致了更緊密的相互連接結構。多糖-蛋白質凝膠最終的微觀結構是由于蛋白質聚集的凝膠化和兩種生物聚合物之間的相分離之間的相互競爭與平衡的結果[24]。本研究添加XG沒有影響SPI凝膠的微觀結構,可能是由于XG-SPI凝膠在制備時經過超聲波處理,而超聲波處理會改善凝膠微觀結構,從而減弱了XG對SPI凝膠結構的影響,也有可能XG對SPI凝膠結構的影響不是體現在亞微米水平而是體現在超微米水平或者更小水平[18]。

圖6 凝膠微觀結構圖Fig.6 SEM images of gels
根據多糖性質的不同,基于SPI的混合凝膠類型可以分為互穿網絡凝膠或半互穿網絡凝膠[1]。對于SPI和凝膠類多糖如卡拉膠、果膠等,主要形成互穿網絡凝膠;對于SPI和非膠凝多糖如半乳甘露聚糖、XG等,主要形成半互穿網絡凝膠[11,30]。XG-SPI復合凝膠形成的過程分成兩個階段,首先通過超聲波將SPI蛋白顆粒分散,此后將XG混合進入SPI分散液中,之后通過加熱和酸化作用開始進行凝膠化過程,最終形成多糖-蛋白的二元凝膠網絡結構。在這個過程中,添加XG通常起到促進SPI凝膠化或調節凝膠結構的作用。非凝膠多糖因不具有凝膠特性,其在蛋白基體系中可能通過體積排斥效應促進了蛋白質分子之間的吸引,并通過減少蛋白質分子與周圍溶液接觸的機會促進了蛋白質分子的排列[31]。因此,非凝膠多糖摻入導致的蛋白質相互作用和蛋白質聚集的改變可能是凝膠質構參數改善的原因。
3 結論
XG作為功能性食品配料,具有潛在的促進健康的作用。本研究研究了XG的加入對酸誘導的SPI凝膠流變性能和微觀結構的影響。結果表明,XG可以提高SPI的粘彈性,降低G′和G?對頻率的依賴性。其次,在自修復性能測試中XG可以幫助SPI凝膠提高恢復率。此外,XG可以提高SPI凝膠的熱穩定性,緩解高溫對網絡結構的破壞性。通過對凝膠進行電鏡掃描未發現其微觀結構上的差異。XG與SPI形成二元凝膠,可以彌補SPI單凝膠的缺點,有利于提高凝膠的穩定性和力學性能,還能為開發具有自修復性能的SPI凝膠提供思路。本研究結果為SPI凝膠的品質調控和應用拓展提供了理論依據。

