細胞因子風暴及其中藥防治的研究?
張彬彬, 于國華, 史淵源,2△
(1.北京中醫藥大學生命科學學院, 北京 100029; 2.深圳北京中醫藥大學研究院, 廣東 深圳 518118)
人冠狀病毒(hCoV)可分為低致病性和高致病性冠狀病毒。低致病性冠狀病毒感染上呼吸道,并引起輕度感冒樣呼吸道疾病。相比之下,高致病性hCoV(如嚴重急性呼吸綜合征CoV(SARS-CoV)、中東呼吸綜合征CoV(MERS-CoV)以及新型冠狀病毒(2019-nCoV)主要感染下呼吸道并引起致命性肺炎。高致病性冠狀病毒引起的嚴重肺炎通常與病毒快速復制、大量炎性細胞浸潤以及促炎性細胞因子和趨化因子應答升高有關[1]。這些高致病性冠狀病毒可通過逃避宿主的抗病毒免疫反應,促使炎癥性細胞因子上調以引起急性感染,這種免疫失調被稱為細胞因子風暴(cytokine storm,CS)。CS可能致命,也是感染患者死亡率上升的重要潛在因素[2]。
不同病毒感染誘導的CS涉及的細胞因子種類有所差別,因此在治療策略上可能也會有所差別。本文述評了人類高致病性冠狀病毒(SARS-CoV、MERS-CoV、2019-nCoV)的免疫病理學過程,分析其中的相同之處和不同之處,剖析不同病毒感染誘導的CS不同特點,為治療CS提供一定的理論依據。同時針對不同的人類高致病性冠狀病毒(SARS-CoV、MERS-CoV、2019-nCoV),分別總結歸納中藥防治的藥理作用,旨在為中藥干預CS提供有意義的臨床指導意見。
1 人類高致病性冠狀病毒引起的CS
1.1 共同之處:干擾素(Interferon,IFN)反應失調
炎癥細胞因子的過度誘導和細胞因子信號的失調,可能促使機體產生相關的炎癥[3]。對病毒最有效和最迅速的宿主反應是產生I型IFN[4],IFN是抵抗病毒感染的第一道防線[5],也是抗病毒先天免疫系統的重要組成部分。首次與病毒接觸產生的IFN會使病毒繁殖減慢甚至停止,延長生物體時間,并有助于建立適應性免疫反應[4]。但SARS-CoV、MERS-CoV、2019-nCoV在侵入人體初期均具有IFN響應延遲和被抑制現象,通過減慢被感染組織細胞中的IFN及其抗病毒基因的表達,病毒可以在感染的最初關鍵階段獲得時間,以便在宿主中不受阻礙的繁殖[6]。SARS-CoV可通過所編碼的nsp3抑制STAT1磷酸化,從而抑制IFN響應[4,7]。MERS-CoV的M,4a,4b蛋白和木瓜蛋白酶(PLpro)會抑制I型IFN和NF-κB信號通路,從而促進先天性免疫逃逸、病毒清除延遲、嗜中性粒細胞浸潤增強以及特異性T細胞應答受損[8]。2019-nCoV感染引起的總中性粒細胞和淋巴細胞變化與SARS、MERS變化類似。2019-nCoV可能會在感染早期促使I型IFN響應延遲,導致病毒復制失控[9]、宿主先天免疫應答失調,同時中性粒細胞和單核/巨噬細胞的流入,也會導致促炎細胞因子的大量產生。
IFN-α的缺乏促進對病毒的抗原呈遞,從而削弱強大的抗病毒適應性Th-1免疫應答發展[10]。IFN反應失調可能最終導致人類宿主從高先天免疫轉向保護性適應性免疫應答的失敗[11]。此外,易受COVID-19影響的人是那些具有潛在疾病的人,包括糖尿病、高血壓和心血管疾病患者。這些事實有力地表明,先天免疫應答是疾病轉歸的一個關鍵因素[9]。
1.2 不同之處
經過查閱文獻并總結歸納3種高致病性冠狀病毒引起CS的發病機理,發現每種冠狀病毒均有其獨特的部分,關注于此將為臨床提供有效的參考依據。
1.2.1 SARS 核衣殼(nucleocapsid,N)蛋白、刺突(spike,S)蛋白與NF-κB相互作用啟動細胞因子釋放 Zhang等[12]研究發現,SARS-CoV的 N蛋白與宿主轉錄因子NF-κB相互作用調節IL-6的表達。Wang等[13]研究發現,SARS-CoV 的S蛋白與鼠巨噬細胞之間的相互作用,可以誘導細胞因子IL-6和TNF-α的釋放,S蛋白觸發NF-κB的激活,然后啟動細胞因子的釋放,這些研究將為探索SARS-CoV 的N蛋白和S蛋白的功能機制、SARS-CoV發病機理提供新的見解,同時為預防和治療SARS-CoV引起的細胞因子風暴提供新的思路。
1.2.2 MERS:MERS-CoV感染T細胞和誘導細胞凋亡可能與MERS的高致死率有關 盡管MERS與SARS高度相似,但MERS的致死率超過35%[14],是SARS的3倍。與SARS-CoV和2019-nCoV不同,MERS-CoV的功能受體為二肽基肽酶4(DPP4)。DPP4是T細胞的激活標記,在T細胞的大量表達可能使細胞更易受MERS-CoV感染。MERS-CoV有效感染CD4+和CD8+T細胞,并下調受感染細胞中的表面DPP4[15]。MERS-CoV能夠有效地從外周血、脾臟和扁桃體感染人T細胞,并且感染MERS-CoV能夠誘導T細胞大量凋亡,其中涉及外部和內在凋亡通路的激活,這可能是MERS高致死率的重要原因。另外,SARS-CoV和MERS-CoV引起淋巴細胞減少的潛在機制可能是不同的,而這種不同可能是T細胞直接感染和感染誘導細胞凋亡的結果。除凋亡外,MERS-CoV感染后T細胞中表面DPP4的急劇消耗,可能會嚴重破壞T細胞的增殖和細胞功能[15]。
1.2.3 COVID-19 IL-6可能在CS中起關鍵作用 許多基質細胞和免疫系統細胞,包括B淋巴細胞、T淋巴細胞、巨噬細胞、單核細胞、樹突狀細胞、肥大細胞和其他非淋巴細胞等均可產生IL-6[16]。COVID-19盡管病死率不高,但感染人數很多,仍有大量患者死亡。隨著越來越多臨床數據的整理和發布,大量數據表明重癥患者存在輕度或重度CS,這是COVID-19患者死亡的重要原因。Michot等通過臨床觀察發現,2019-nCoV引起的CS與白介素和趨化因子失調有關,從首次成功用抗IL-6受體治療嚴重的COVID-19患者觀察結果可以看出,IL-6是引發新冠肺炎患者炎癥風暴中的關鍵炎癥因子[17]。因此,如果有可能阻斷IL-6的信號傳導途徑,則有望成為治療重癥COVID-19患者的新方法[18]。
1.2.4 細胞因子和趨化因子的過度產生 表1示,通過臨床研究分析,SARS-CoV、MERS-CoV、2019-nCoV促使受感染細胞分泌大量的趨化因子和細胞因子,但分泌的趨化因子和細胞因子不盡相同。
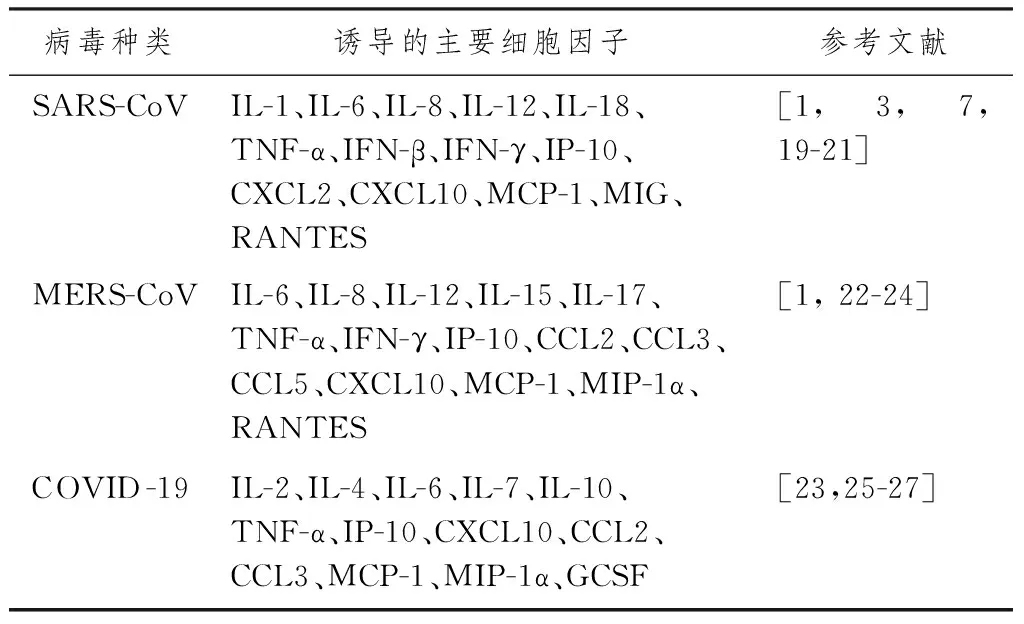
表1 3種高致病性冠狀病毒誘發CS涉及的主要細胞因子
2 中藥對CS的干預作用
經過對文獻的查閱,總結歸納分別用于SARS-CoV、MERS-CoV、2019-nCoV的單味中藥及中藥處方如下。
2.1 中藥對SARS-CoV引起的CS干預作用
在SARS疫情期間中醫藥發揮了重大作用,而后出現了大量關于中藥治療SARS-CoV引起的免疫失調的研究。姜代勛等[28]研究發現,蘆根、大青葉、金銀花、連翹、紫蘇葉、薄荷、黃芪這7味藥可能通過抑制cAMP-PDE(cAMP-磷酸二酯酶)活性,抑制炎性細胞因子的釋放和中性粒細胞的活化,從而實現抗SARS的作用。甘草酸影響細胞信號通路,如蛋白激酶C(PKC)、酪蛋白激酶Ⅱ(CK-Ⅱ)、轉錄因子和NF-κB。此外,甘草酸及其苷元代謝物18β甘草次酸上調巨噬細胞誘導型氧化亞氮合酶的表達,并促進氧化亞氮的產生。Cinatl等[29]初步結果表明,甘草酸在Vero細胞中誘導氧化亞氮合酶的生成,當氧化亞氮供體(NONOate DETA)加入培養基時,病毒復制被抑制。Lau等[30]的研究結果表明,魚腥草水提取物可以顯著且劑量依賴性地刺激小鼠脾淋巴細胞的增殖。通過流式細胞儀發現,魚腥草增加了CD4+T和CD8+T細胞的比例,此外還引起小鼠脾淋巴細胞IL-2和IL-10分泌顯著增加。在抗病毒方面,魚腥草對SARS-CoV 3C樣蛋白酶(3CLpro)和RNA依賴性RNA聚合酶(RdRp)表現出顯著的抑制作用。
大量實驗表明,清開靈注射液、魚腥草注射液、板藍根沖劑對肺部急性炎癥、肺指數、炎性因子、炎性滲出均有明顯的改善作用[31]。常秀娟等[32]通過CS探討熱毒寧注射液對脂多糖(LPS)致大鼠急性肺損傷(ALI)的治療作用及機制,結果表明熱毒寧注射液能夠降低ALI模型大鼠肺臟IL-1β、TNF-α、IL-4、IL-6、IL-8、IL-10、ICAM-1、NF-κB水平,改善大鼠肺組織形態學變化。在SARS爆發期間,Lau等[33]探索在高危人群中使用中藥預防呼吸道病毒感染的可能性研究。在2周內3160名醫護人員食用由桑菊飲和玉屏風散加另外2種抗病毒特性中藥大青葉和黃芩研制成的制劑,其中37人檢查了血清的免疫反應。在服用中藥制劑時,CD4/CD8比值出現短暫性升高,B淋巴細胞持續下降,研究結果顯示,抗病毒中藥制劑在服用過程中可能產生有益的免疫調節作用。
2.2 中藥對MERS-CoV引起的CS干預作用
國家衛生計生委發布《中東呼吸綜合征病例診療方案(2015年版)》,清開靈注射液、參麥注射液分別被列為中醫中藥治療MERS(邪毒壅肺、正虛邪陷)推薦藥物[34]。
清開靈注射液是在傳統名方“安宮牛黃丸”基礎上加減而成[35],被譽為“中藥抗生素”。張平等[36]觀察清開靈注射液對急性肺損傷大鼠免疫功能的影響,結果發現清開靈注射液能增加CD4+T細胞數目,改善CD4+/CD8+比值,對大鼠急性肺損傷具有明顯的修復作用。梁愛華等[37]研究發現,清開靈注射液可以抑制內毒素誘導的體內炎性因子TNF-α和IL-6的產生,同時可抑制內毒素誘導的血小板數目降低。
參麥注射液是《癥因脈治》中 “參麥飲”的衍變方[38],經現代科學技術、大量藥理研究、臨床驗證而成功研制的靜脈注射劑,主要功能是益氣固脫、養陰生津[39]生脈,增強機體免疫力[40]。范曉春等[41]研究發現,參麥注射液能夠降低重癥肺炎患者TNF-α、IL-1β、IL-6水平,提高IL-10水平,具有保護黏膜屏障的功能、調節炎癥因子釋放、減輕肺部炎癥反應等作用。
很多中藥成分對病毒蛋白酶有抑制作用,如草質素(Herbacetin)、補骨脂乙素(Isobavachalcone)、蠟菊亭(Helichrysetin)[42]、丹參酮等能抑制MERS-CoV 3C樣蛋白酶(3CLpro)活性,從而發揮抗病毒復制作用[43]。另外,多酚[44]、丹參酮[45]、肉桂酰胺[46]、泡桐樹果實的甲醇提取物等[47]產生了許多能夠靶向PLpro的小分子,具有PLpro的抑制活性作用。而PLpro會抑制I型干擾素(IFN)和NF-κB信號通路,因此上述中藥成分可能具有抑制先天性免疫逃逸功效。
2.3 中藥對2019-nCoV引起CS的干預作用
2.3.1 新型冠狀病毒肺炎診療方案(試行第七版)中與CS相關的中成藥 新型冠狀病毒肺炎診療方案(試行第七版)指出,建議重癥及危重癥患者使用清肺排毒湯、化濕敗毒方、喜炎平注射液、血必凈注射液、熱毒寧注射液、痰熱清注射液、醒腦靜注射液、蘇合香丸、安宮牛黃丸、參附注射液、生脈注射液、參麥注射液等中成藥。經過查閱文獻發現,上述中成藥基本都有調節細胞因子、趨化因子的作用,從而對CS有一定的干預作用(見表2)。
2.3.2 具有潛在調節2019-nCoV引起CS作用的中藥 IL-6是引發新冠肺炎患者炎癥風暴中的關鍵炎癥因子,尋找對IL-6有調節作用的中藥對臨床用藥有重大意義,因此有必要認真總結對IL-6起調節作用的中藥(見表3)。
3 討論
CS發病前征兆少,發病后救治難度大且后果嚴重。目前針對CS大多采用西藥治療,西藥雖有效但其安全性仍存在爭議[73]。新型冠狀病毒肺炎診療方案(試行第七版)強調中藥治療,中藥作用靶點廣泛,在CS的發生、進展、轉歸階段均有一定的效果,并在此方面有著獨到優勢,因此從中醫藥領域尋找有效方治療COVID-19重癥及危重癥下的CS是值得重點關注的問題。

表2 新型冠狀病毒肺炎診療方案(試行第七版)與CS相關的中成藥匯總比較

表3 對IL-6起調節作用中藥的比較
本文分析了人類高致病性冠狀病毒(SARS-CoV、MERS-CoV、2019-nCoV)引起CS的機理異同點,并歸納總結了中藥對3種冠狀病毒引起CS的免疫調節作用,發現其中有很多中藥均可用于3種病毒引起的CS,如清開靈注射液、參麥注射液、熱毒寧注射液等,因其機理有許多共同之處,如調控TNF、NF-κB等信號通路抑制炎癥反應,降低血清IL-6、IL-8、TNF-α水平等。同時也有些中藥成分具有針對其中某種病毒的作用,如多酚、丹參酮、肉桂酰胺、泡桐樹果實的甲醇提取物等產生了許多能夠靶向PLpro的小分子,具有對PLpro的抑制活性作用,從而抑制MERS-CoV引起的先天免疫逃逸。表3示,因IL-6是2019-nCoV誘發CS的關鍵細胞因子,因此重點關注對IL-6具有調節作用的中藥,將對臨床治療COVID-19有很好的指導作用。關注CS機理的共同之處和不同之處,在未來的研究中可以更好地了解病毒誘發CS的全過程,將CS的發病機理與中藥防治CS的機制緊密聯合起來,高效篩選治療藥物并探討其作用機制[74],這對于研發“廣譜類”抗CS中成藥及“針對性”抗CS中成藥具有重要參考價值。然而不同冠狀病毒引起CS的機理尚未完全研究清楚,中藥干預CS的機制亦是如此。本文只是簡單地比較3種高致病性冠狀病毒引起CS機理的異同以及簡單歸納中藥干預CS的機制,為臨床治療CS提供一定的用藥思路,而中醫藥防治CS仍需探索。

