乳腺癌術前MRI特征對保乳術中切緣陽性的預測價值分析
羅紅兵,王春華,劉圓圓,陳哲,胥豪,周鵬,任靜
乳腺癌是中國及全球女性發病率最高的惡性腫瘤[1-3]。目前,保乳術已成為早期乳腺癌的主要手術方式[4]。在保乳術中,腫瘤的切緣狀態則是決定保乳手術是否成功及影響患者預后的關鍵因素[5]。MRI作為乳腺癌早期診斷、準確分期的重要檢查方法[6-7],其具備全面、準確評估乳腺癌病灶范圍的優勢,已成為國內乳腺癌保乳術前的推薦檢查方式[4]。本研究通過分析、比較浸潤性乳腺癌保乳術中切緣陽性和陰性組病例的術前MRI特征和臨床病理特征差異,探討MRI特征對浸潤性乳腺癌保乳術中切緣陽性狀態預測的可行性及價值,旨在為乳腺癌保乳術前提供更精準和個性化的影像診斷信息。
材料與方法
1.研究對象
本研究回顧性收集本院2017年9月-2019年6月經手術后病理確診且有完整術前MRI資料的浸潤性乳腺癌(invasive breast carcinoma,IBC)患者共445例。排除以下病例:①3例為雙乳癌;②66例臨床病理數據不完整;③38例MRI檢查前外院已行手術;④62例MRI檢查前已接受化療;⑤100例首次手術方式為乳房全切術。最終本研究共納入176例(63.77%,176/276)首次手術方式為保乳術的病例進行分析,包括術中切緣為陽性病例56例(31.8%,56/176),最終12例(21.4%)切緣陽性病例手術方式改為乳房全切術,另44例(78.6%)最終手術方式仍為保乳術,術中切緣為陰性病例120例(68.2%,120/176)。所有患者均為女性。既往手術方式的選擇是由乳腺外科醫生,根據患者意愿、病灶情況等綜合因素進行的選擇,而本中心的保乳手術的適應證是:對有保乳意愿,能夠達到切緣陰性及滿意外形效果的患者選擇保乳手術。而保乳手術的絕對禁忌證:病灶廣泛且難以達到切緣陰性,又不可耐受放療的患者。對保乳治療后存在局部復發相關的危險因素的患者,可以在取得患者充分知情的前提下,外科醫生根據具體情況選擇行保乳手術。這些危險因素包括:①活動性結締組織病,尤其是硬皮病和系統性紅斑狼瘡或膠原血管疾病者,對放療耐受性差。②多中心病灶(多中心病灶指在2個或2個以上象限存在1個及以上病灶,或病理學類型和分子分型完全不一樣的兩個乳腺病灶)。③同側乳房既往接受過乳腺或胸壁放療者,需獲知放療劑量及放療野范圍。④腫瘤直徑大于5 cm。⑤侵犯乳頭(如乳頭Paget’s病)。⑥已知乳腺癌遺傳易感性強(包括BRCA1/2等已知的致病性突變),保乳術后同側乳腺腫瘤復發風險增加的患者[4]。本研究經本院倫理委員會審核通過(審批號SCCHEC2015029)。
2.MRI掃描方法
采用Siemens Skyra 3.0 T磁共振掃描儀,專用16通道雙側乳房相控線圈,取俯臥位且頭先進,雙側乳房自然懸垂于線圈內。掃描范圍包含雙側乳腺組織及腋窩,掃描序列[8-9]為:平掃橫軸面和矢狀面T2WI掃描:使用TIRM序列, TR 3570 ms,TE 70 ms,層厚4.0 mm,層間距1.5 mm,FOV 340 mm×340 mm,采集矩陣358×448。橫軸面Resolve-DWI掃描,TR 5700 ms,TE 66 ms,層厚5.0 mm,采集矩陣86×192,分段采集次數 3,b值分別取0 s/mm2和800 s/mm2。動態增強多期MRI掃描:采用超快速并行采集技術(CAIPIRINHA)、水脂分離壓脂技術(Dixon)及時間分辨交叉隨機軌跡成像(TWIST)三種技術的容積插入法屏氣掃描檢查(CDT-VIBE)序列,TR 5.64 ms,TE 3.69 ms,FOV 360 mm×360 mm,矩陣224×179,層厚2.5 mm,采用無間隔掃描,翻轉角10°,共采集圖像26期,單期時間分辨率約為13 s,總采集時間6分鐘左右。橫軸面薄層延遲期掃描:采用橫軸面VIBE序列,TR 4.1 ms,TE 1.6 ms,FOV 320 mm×320 mm,矩陣448×358,層厚0.8 mm,翻轉角10°。動態增強掃描開始前按0.1 mmol/kg體重注射釓雙胺注射液,流率2.5 mL/s,后追加15 mL生理鹽水以同樣流率注射。
3.MRI分析及特征提取
由2名從事乳腺影像診斷的高年資醫師,在不知道病理結果的情況下,依據乳腺影像報告和數據系統(breast imaging reporting and data system,BI-RADS)結合乳腺磁共振檢查及診斷規范專家共識[10],對所有患者術前乳腺MRI資料進行獨立分析,意見不統一時協商達成一致。每個病例需分析的MRI特征包括:①乳腺纖維腺體組織(fibro-glandular tissue,FGT)構成分類:a類(全脂肪類)、b類(散在纖維腺體類)、c類(不均質纖維腺體類)和d類(絕大部分纖維腺體類);②乳腺病灶同側和對側的乳腺實質背景強化(background parenchymal enhancement,BPE)類型:幾乎不強化型、輕微強化型、中度強化型和明顯強化型;③病灶類型:分為腫塊,非腫塊樣強化(non-mass-like enhancement,NMLE)型;④針對腫塊型病灶測量病灶最長徑(增強后動脈早期序列測量),單位為毫米,分析腫塊病灶形態(分為圓形、卵圓形和不規則兩類),腫塊病灶的邊緣(分為清晰和不規則、毛刺狀兩類);⑤針對NMLE病灶評價其分布特征:分為小范圍分布(包括線狀、葉段分布或局灶分布)和大范圍分布(包括區域、多區域或彌漫分布);⑥評價是否存在多中心病灶(多中心病灶指在2個或2個以上象限存在1個及以上病灶)。
4.病理資料
從每個病例手術后病理報告中提取病理資料:①術中切緣陽性的判定標準:依據術后的病理報告結果,在術中取材部位包括腫瘤中心、不同方向的腫瘤肉眼邊界、切緣和腫瘤周圍組織,且分別在腫瘤上下、左右、前后切緣6個點取材全面分析切緣情況,當距殘端2 mm以內有癌細胞者判定該患者為切緣陽性病例[11]。②并收集基本病例診斷資料:包括每個病灶的病理診斷,細胞分級,是否伴有導管原位癌(intra-ductal carcinoma in situ,DCIS),淋巴結轉移情況,ER、PR、HER2表達情況和Ki-67表達情況(根據Ki-67指數<20%為低表達,而≥20%為高表達)[12]。
5.統計學處理方法
采用SPSS 20.0軟件處理數據。連續數據采用平均值±標準差表示,分類數據采用賦值的方式。采用獨立樣本t檢驗比較保乳術中切緣陽性與切緣陰性組間連續數據的差異,根據具體情況采用Pearson或連續校正的卡方檢驗比較兩組間各分類數據的差異;將經單因素分析后有P<0.1的MRI特征和基本臨床病理特征,進行多因素Logistic回歸分析(采用向前LR法)。最后通過受試者操作特征(receiver operating characteristic,ROC)曲線并計算曲線下面積(area under curve,AUC)來評價回歸模型對保乳術中切緣陽性的預測診斷效能。以雙側P<0.05為差異有統計學意義。
結 果
1.納入研究病例基本情況和病理類型分布
本研究176例浸潤性乳腺癌中:保乳術中切緣陽性組病例為56例(31.8%,56/176),年齡31~77歲,平均年齡約49歲,含2例浸潤性小葉癌,1例浸潤性微乳頭狀癌,1例伴有大汗腺特征和1例為伴髓樣特征的癌,余51例為非特征類型浸潤性癌;保乳術中切緣陰性組病例為120例,年齡31~78歲,平均年齡為47歲,含1例浸潤性小葉癌,1例化生性癌,2例髓樣癌,4例乳頭狀癌,余112例為非特殊類型浸潤性癌。
2.兩組間基本臨床、病理資料單因素比較結果
兩組的各項基本臨床和病理特征,經單因素分析結果顯示,除浸潤性癌伴導管原位癌(ductal carcinoma in situ,DCIS)成分(F=21.475,P=0.000)和HER2陽性表達(F=5.663,P=0.017)差異有統計學意義外,其余各項臨床及病理特征差異均無統計學意義(表1)。
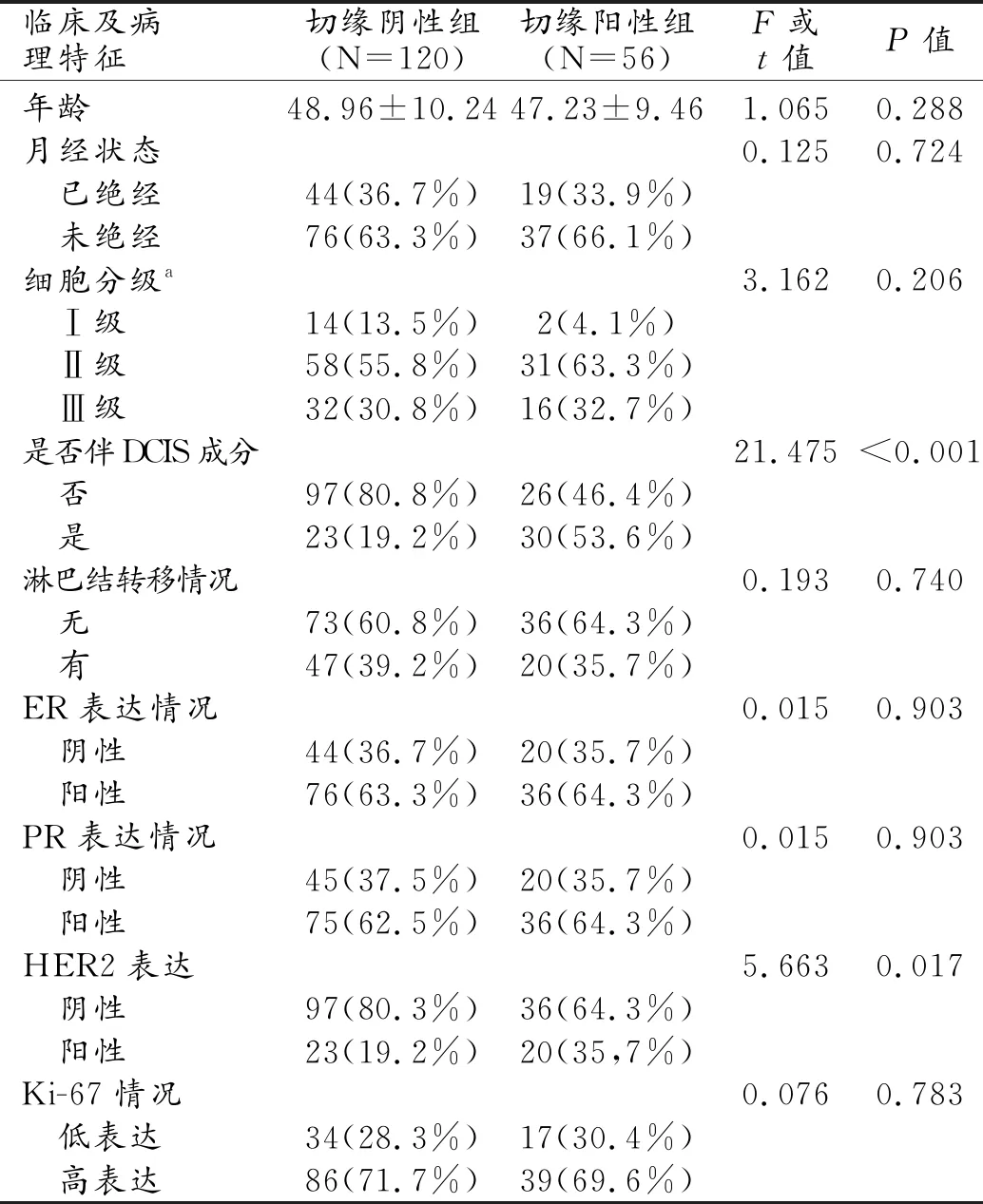
表1 兩組間基本臨床及病理特征比較
3.兩組間MRI特征的單因素比較結果
所有MRI特征經單因素分析顯示,保乳術中切緣陽性組的MRI測量的病灶最長徑(24.4±9.0)mm與術中切緣陰性組間病灶MRI測量最長徑(20.5±6.9)mm間差異有統計學意義(t=3.162,P=0.002);且在切緣陽性組中,存在多中心病灶的比率(32.1%,18/56)要高于切緣陰性組中存在多中心病灶的比率(7.5%,9/120),F=17.853,P<0.001;切緣陽性組中NMLE病灶類型的比率(19.6%,11/56)也要高于切緣陰性組中NMLE的比率(3.3%,4/120),F=11.019,P=0.001(表2,圖1、2)。
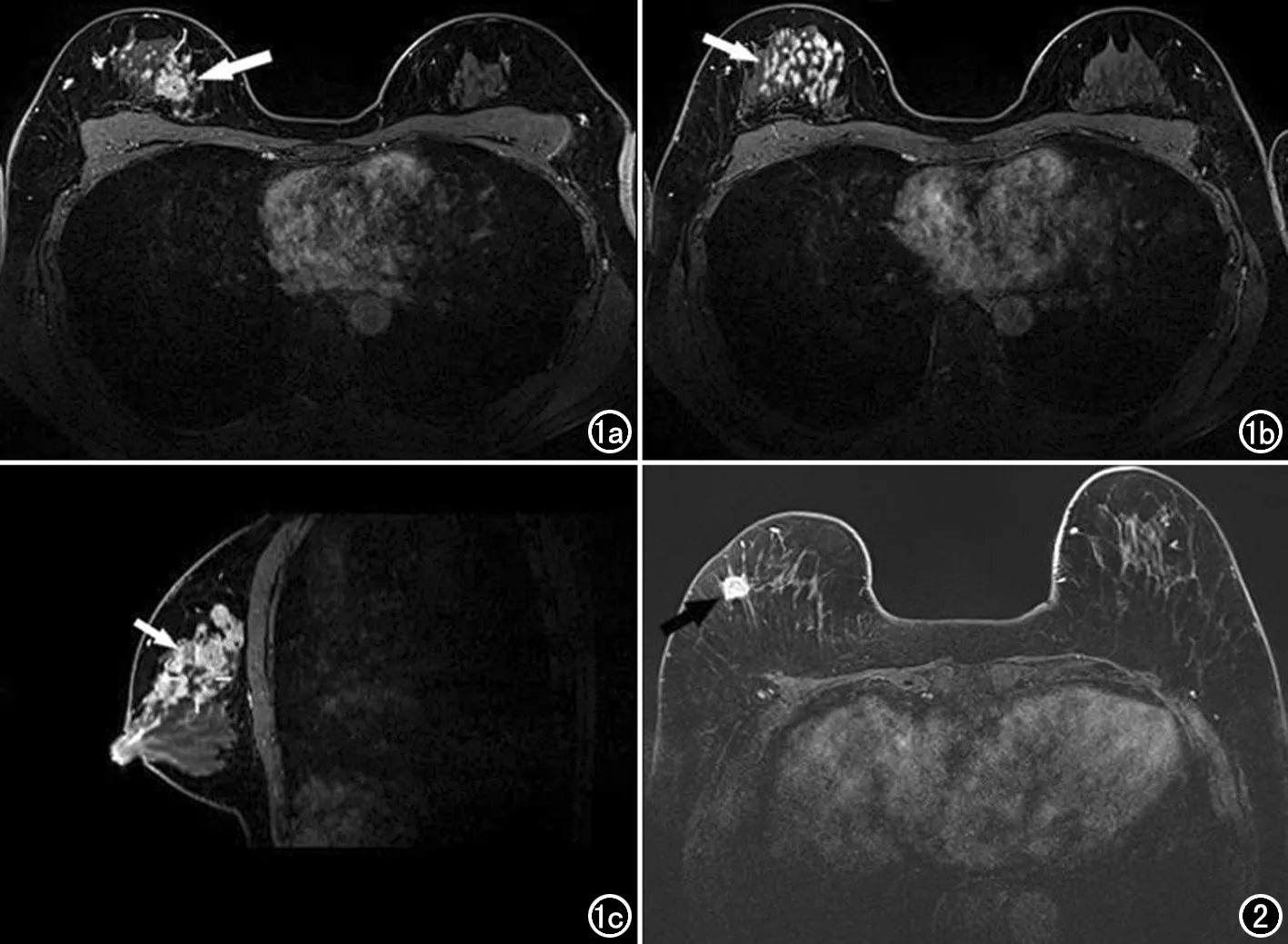
圖1 女,31歲,首次保乳術中切緣陽性,術后病理確診為非特殊類型浸潤性癌II級,伴50%區域為導管原位癌成分(中核級,粉刺型)。a)增強早期MRI圖像示腫塊樣主病灶(箭),大小約24mm×16mm; b) 增強早期鄰近層面圖像示多中心病灶特征(箭); c) 增強MRI矢狀面圖像示主病灶周圍多區域分布的非腫塊樣強化特征(箭)。 圖2 女,68歲,首次保乳術中切緣陰性,術后病理確診為非特殊類型浸潤性癌II級。MRI增強早期示病灶為孤立腫塊,大小18mm×15mm。
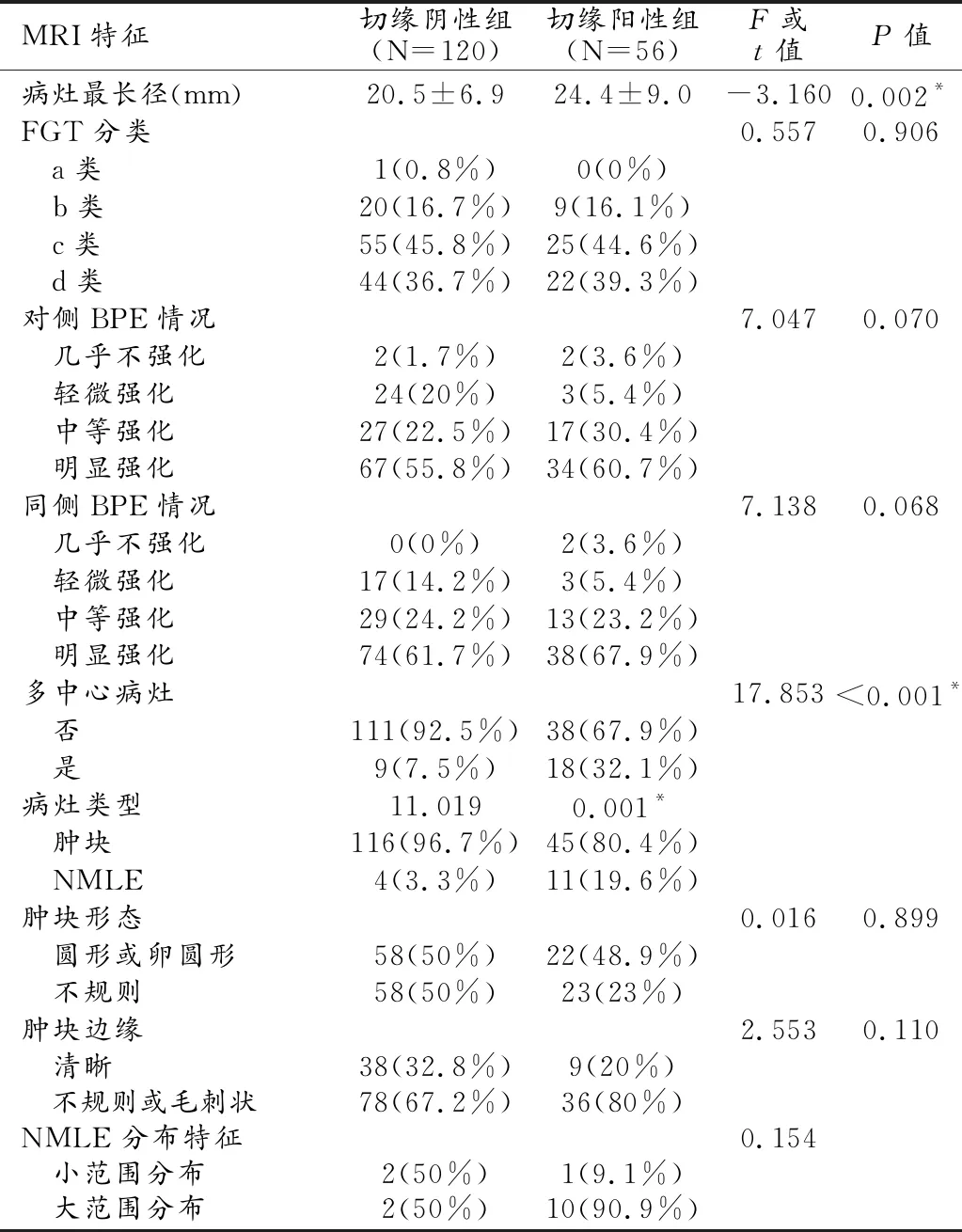
表2 兩組間主要MRI特征比較
4.多因素Logistic回歸分析結果及模型診斷效能
將經單因素分析后有P<0.1的MRI特征包括病灶最長徑(P=0.002),存在多中心病灶(P<0.001),病灶類型(P=0.001),同側BPE(P=0.068)和對側BPE(P=0.070)情況,以及基本臨床病理特征包括是否伴DCIS成分(P<0.001),HER2表達狀態(P=0.017)進行多因素Logistic回歸分析。結果顯示,對浸潤性乳腺癌保乳術中切緣陽性預測最有價值的特征是多中心病灶(OR=4.381,P=0.004),浸潤性癌伴DCIS成分(OR=4.211,P<0.001),較大的病灶最長徑(OR=1.796,P=0.019),其回歸模型對術中切緣陽性預測診斷的曲線下面積為0.750(表3,圖3)。
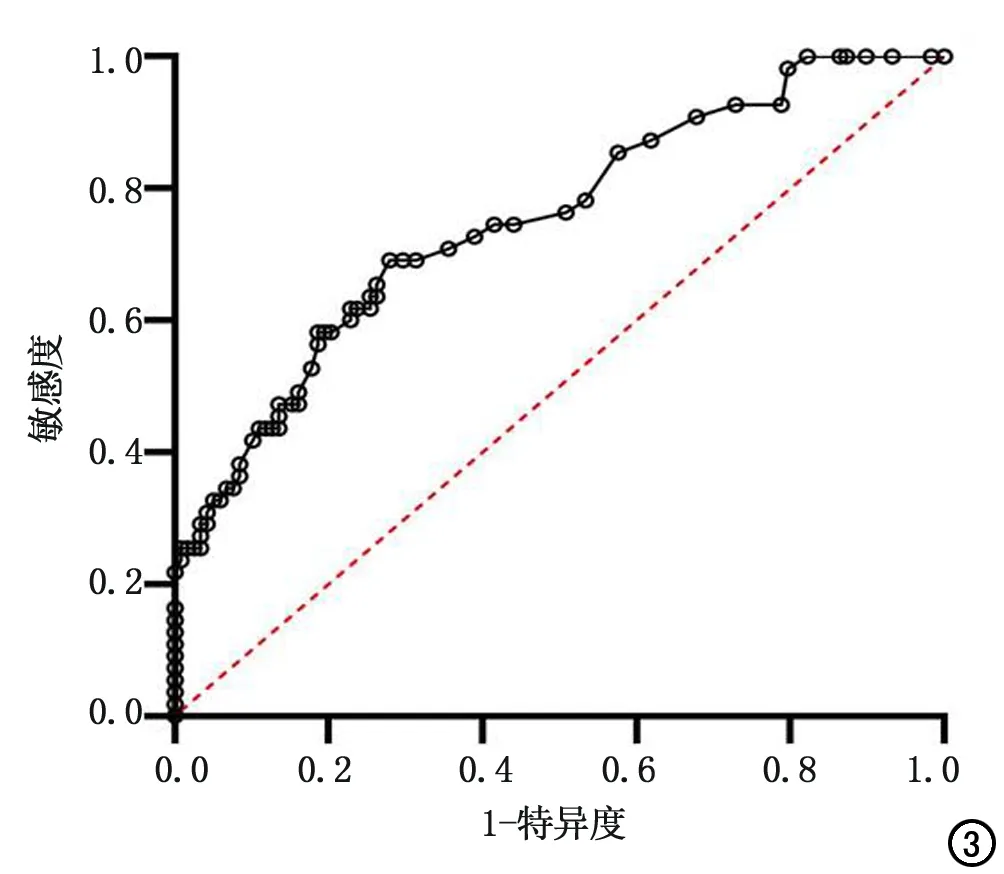
圖3 回歸模型對浸潤性乳腺癌在保乳術中切緣陽性的預測診斷價值ROC曲線。
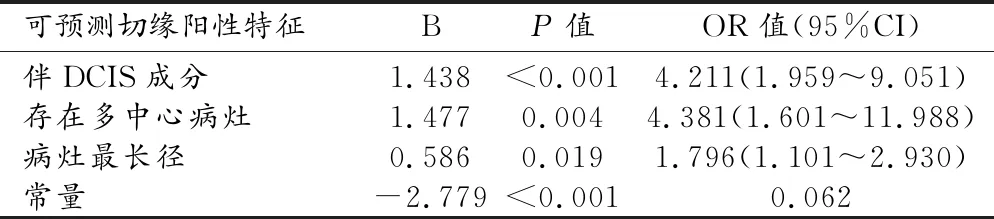
表3 回歸分析結果顯示對保乳術中切緣陽性有預測價值的特征
討 論
在過去幾十年間,乳腺癌的手術方式已發生了革命性的變化。很多權威研究結果[13-18]顯示,保乳手術在切緣陰性基礎上聯合局部放療,能達到與全乳切除術療效一致而生活質量顯著提高的治療效果。因此,保乳術已經成為目前早期乳腺癌標準的治療策略[4]。然而,乳腺癌保乳術后局部復發是影響患者預后的關鍵臨床問題,既往研究顯示[5,19-20]保乳術中切緣陽性則是乳腺癌保乳術后局部復發的關鍵因素。本研究通過對保乳術前乳腺癌影像特征、基本臨床病理特征的分析和比較,幫助乳腺科醫生對保乳術中切緣狀態進行更個性化的術前評估和預測,旨在降低保乳術中切緣陽性率,提高保乳手術成功率及患者的預后。單因素分析結果示MRI特征中病灶最長徑,存在多中心病灶,NMLE的病灶類型,和病理特征中的浸潤性癌伴DCIS成分,HER2陽性表達是乳腺癌保乳術中切緣陽性的預測因素;而多因素分析結果示,多中心病灶(OR=4.381,P=0.004)、浸潤性癌伴DCIS成分(OR=4.211,P=0.000)和較大的病灶最長徑(OR=1.796,P=0.019)是預測浸潤性乳腺癌保乳術中切緣陽性最有價值的因素。
MRI作為乳腺癌保乳術前評估的重要手段,其在全面評估乳腺癌病變范圍[21],發現多中心病灶[11]等方面,要明顯優于乳腺X線攝影術和超聲檢查[22-24]。既往國內外研究也表明[25-28],MRI可以降低乳腺癌保乳術中的切緣陽性率和再次手術率。本研究和既往Bae等[29]、Kang等[30]及Van等[31]研究都顯示,在MRI特征中,乳腺癌多中心病灶和MRI測量的病灶大小是浸潤性乳腺癌保乳術中切緣陽性的重要預測因素,且多中心病灶是更重要的MRI特征。而且近期一項針對19272例患者的Meta分析結果也顯示[32],多中心病灶與保乳術后乳腺癌局部復發風險增加密切相關。依靠MRI較好的軟組織分辨率和多序列、多功能成像的優勢,使MRI對乳腺癌多中心病灶的檢出和診斷,要明顯優于鉬靶和超聲檢查[4,11]。所以基于上述研究結果,影像醫生在對浸潤性乳腺癌保乳術前MRI評估時,要特別注意對多中心病灶的發現、甄別和診斷,以減少這類患者術中切緣陽性的風險,提高保乳手術成功率和預后。
在本研究中,浸潤性癌伴DCIS成分這個術后病理特征是另外一個保乳術中切緣陽性的重要預測因素,與既往Kang等[30]及Van等[31]研究結果類似。Bae等[29]研究結果也顯示術前穿刺病理的浸潤性癌伴DCIS成分是保乳術中切緣陽性的危險因素。雖然通過穿刺或術后病理可以明確診斷浸潤性癌伴DCIS,但作為預測保乳術中切緣陽性的術前預測因素,只能依靠術前穿刺病理才有臨床應用前景。然而術前穿刺往往都是針對浸潤性癌病灶中心區域進行,但實際上DCIS成分卻常常出現在浸潤性癌周圍,所以大大限制了術前穿刺病理在發現浸潤性癌伴DCIS的敏感性[31]。已有的研究結果顯示MRI對DCIS的檢出率可高達92%,是明顯優于乳腺X線攝影術[22-23]的影像檢查方法,而且MRI還具備更全面、準確評估DCIS病變范圍[21,33]的能力。所以如何能依靠MRI征象,幫助乳腺外科醫生在保乳術前能更高效地發現并診斷浸潤性癌伴DCIS這個術中切緣陽性的重要預測特征,是未來乳腺癌保乳術前MRI評估中一個重要且值得深入研究的臨床問題。既往Kuhl等[27]通過MRI引導活檢并標記的方法,提高了浸潤性癌伴DCIS的診斷率并顯著降低了保乳術切緣的陽性率,已經初步展示了術前MRI對浸潤性癌伴DCIS準確評估的臨床應用價值和前景。
筆者的單因素研究結果顯示NMLE的病灶類型,HER2陽性表達是浸潤性乳腺癌保乳術中切緣陽性的預測因素,但經多因素分析后,這些因素卻沒有明顯統計學意義。既往也有研究顯示HER2陽性是保乳術中切緣陽性的預測因素[34-35]。這些不同的研究結果,分析原因可能與不同研究樣本的構成差異有關,如在楊陽等[35]的研究樣本中只納入HER2過表達型(激素受體陰性)病例數僅9例,而本研究中既納入HER2過表達型,也納入了Luminal B(HER2陽性)型的HER2陽性病例進行研究。既往Park等[34]和Bae等[29]研究中還發現BPE也是保乳術中切緣陽性的預測因素之一。筆者也研究了同側和對側BPE狀態對保乳術中切緣陽性預測的價值,但結果顯示即使在單因素分析中P值都小于0.1,卻都沒有統計學差異,在納入多因素分析后同樣沒有統計學差異。這些相對矛盾的研究結果,首先可能與目前多數關于BPE研究還是依據BI-RADS分級而進行的四分類定性研究有關,所以在BPE評價過程中就不可避免地存在主觀偏倚。其次筆者還發現在不同研究中,對BPE進行統計分析采用的分組方法也有很大差異,如Park等[34]在統計分析時將BPE只分成弱強化型和明顯強化型兩組;而Bae等[29]依據BPE四分類進行分組分析時沒有統計學差異,后將BPE分為輕微強化和其他(輕度、中等、明顯強化)兩組后,才具有了統計學差異。這些BPE評價的主觀偏倚和不同研究者在統計分析時對BPE分組方法的差異,也許是BPE與保乳術中切緣陽性關系研究結果的差異性和不可重復性的重要原因,未來定量化BPE研究可能是克服這些研究差異的重要方法之一[36]。
本研究也存在一定的局限性,如限于回顧性研究的性質,既往不同臨床醫生在把握保乳手術指針時也可能存在差異,從而可能不可避免地造成部分納入研究病例的選擇偏倚。
總之,術前病灶大小、多中心病灶的MRI特征以及浸潤性乳腺癌伴DCIS成分是浸潤性乳腺癌在保乳術中出現切緣陽性最有價值的預測因素,這有利于影像和臨床醫生對乳腺癌做出更準確和個性化的術前評估。

