基于乳腺X線攝影的影像組學對乳腺腫塊和鈣化良惡性分類的研究
馬明明,崔應譜,劉想,楊潔瑾,張耀峰,李昌欣,張曉東,秦乃姍,王霄英
乳腺X線攝影是乳腺疾病初檢篩查的首要方法,已被廣泛應用于乳腺病變的良惡性鑒別[1]。乳腺癌在X線攝影中常見表現為腫塊、鈣化[2],鑒別腫塊和鈣化的良惡性是重要的影像學任務,與診斷者的經驗相關。通常根據病灶特征給出乳腺影像報告和數據系統(breast imaging reporting and data system,BI-RADS)分類,對BI-RADS 4、5類乳腺病變進行活檢[3]。由于部分病灶的影像特征不典型,可能造成診斷困難以及診斷者的不一致。因此,需要更客觀、準確的方法鑒別乳腺病變的性質。
影像組學(Radiomics)技術可用于乳腺圖像的輔助診斷[4]。有研究探討了利用影像組學特征在乳腺MR對乳腺癌分子亞型區分[5]和乳腺X線攝影圖像上乳腺鈣化良惡性病變鑒別的應用[6]。近年來深度學習在醫學圖像分割方面得到了廣泛應用,尤其是病變自動分割不僅減輕醫師工作強度、還能提高病變檢出的一致性[7],本單位已訓練了基于深度學習分割乳腺X線攝影圖像中鈣化和腫塊的模型,對病變檢出的效果較好,為進一步探索對乳腺腫塊和鈣化進行良惡性分類奠定了基礎。本研究探討基于乳腺X線攝影的影像組學在乳腺腫塊和鈣化良惡性鑒別中的應用價值,并將結果與有經驗的放射科醫生進行對比。
材料與方法
本研究經過倫理審查委員會的批準[批件號2019(168)],研究工作按照本單位影像組學項目研發規范來進行。
1.研究對象
回顧性收集本院PACS系統中2014年5月1日-2020年3月1日診斷性乳腺X線攝影檢查(臨床查體或超聲檢查有乳腺異常)的影像資料,從圖像中提取乳腺腫塊和鈣化的影像組學特征用于鑒別良惡性病變。所有乳腺X線攝影檢查均由Hologic Selenia數字化全視野乳腺X線機采集,采用標準內外斜位(medial lateral oblique,MLO)和頭尾位(cranio caudal,CC)投照,選擇自動曝光控制模式。以患者最終病理結果及臨床隨訪結果(良性檢查結果的患者)為金標準。
乳腺良惡性腫塊影像組學模型的納入標準:①由兩名放射科醫師(讀者A和讀者B,分別擁有5年、15年以上乳腺X線攝影診斷經驗)明確圖像中有乳腺腫塊、且范圍明確;②乳腺惡性腫塊有已知病理結果,良性腫塊有病理結果證實或隨訪一年期間未發現惡性結果。排除標準:①多發性腫塊性病灶(難以確定病理穿刺病灶者);②失訪患者。共納入患者188例,均為女性,年齡29~91歲(58.9±12.1歲)。最終得到X線圖像316幅(圖1),將乳腺腫塊數據集按7:3的比例隨機分成訓練集和測試集。
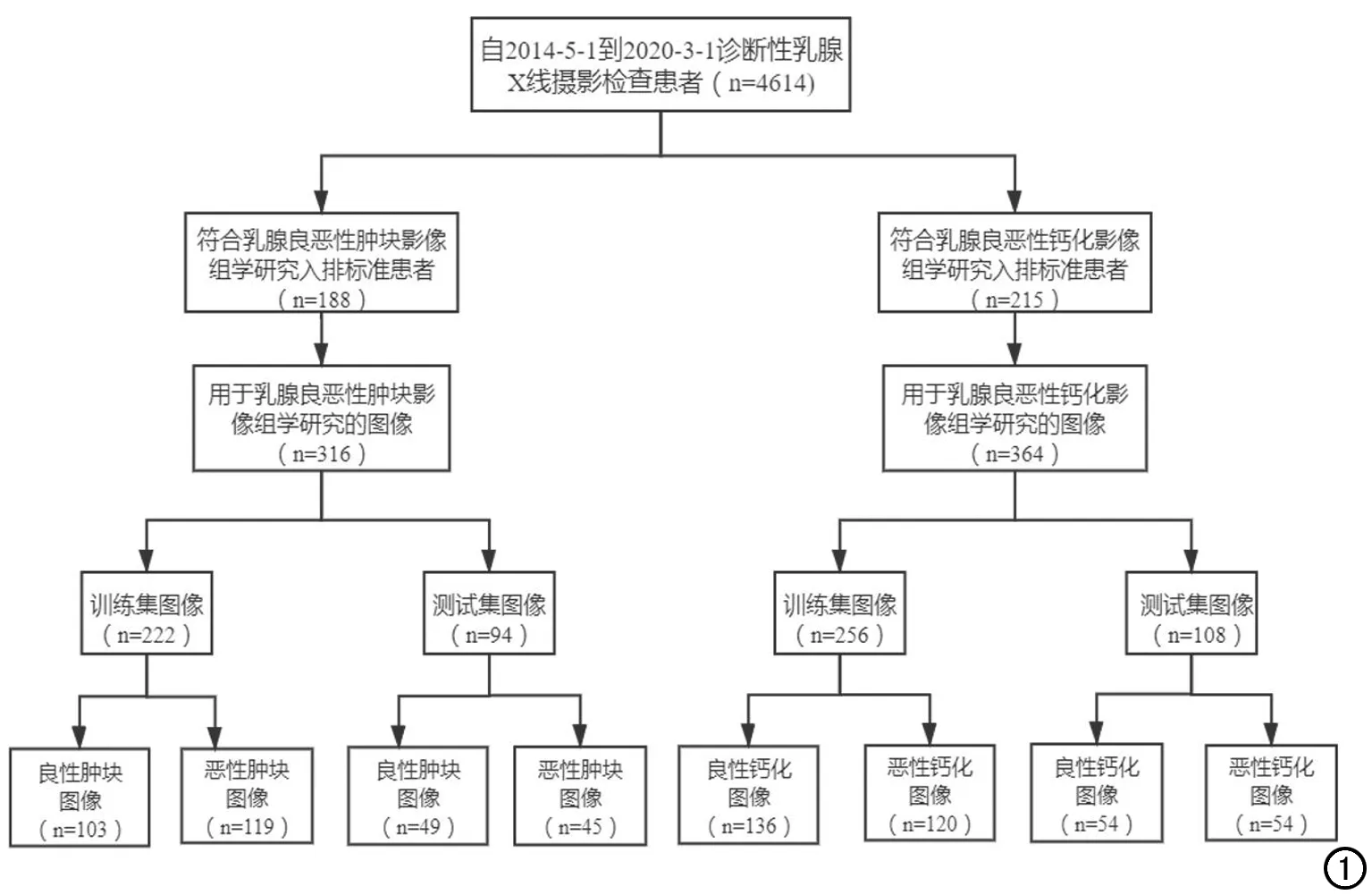
圖1 乳腺腫塊、鈣化影像組學研究對象納入流程圖。
對于乳腺良惡性鈣化影像組學模型的納入標準:①由兩名放射科醫師(讀者A和讀者B)明確圖像中有乳腺鈣化、且顯示清晰;②乳腺惡性鈣化有已知病理結果,良性鈣化有病理結果證實或隨訪一年期間未發現惡性結果。對于同時存在乳腺良惡性鈣化、或多發不確定鈣化的情況,基于病理證實結果,通常僅取乳腺鈣化為惡性的區域入組。當同一圖像上同時存在良性鈣化或不確定鈣化時,這些區域如未能獲得病理證實,則不入組,如果獲得了病理證實,則可以入組。排除標準:①乳腺鈣化小于4個像素;②失訪患者。共納入患者215例,均為女性,年齡31~86歲(57.8±12.9歲)。最終得到X線圖像364幅(圖1),將乳腺鈣化數據集按7:3的比例隨機分成訓練集和測試集。
2.乳腺病變分割
采用Ronneberger等提出 U-Net算法進行病灶分割[8],使用本院已經訓練好的乳腺X線攝影中腫塊和鈣化的分割模型,輸入乳腺X線攝影圖像,輸出腫塊和鈣化的分割結果。由兩名放射科醫師(讀者A和讀者B)對分割模型輸出的分割結果進行評估及修改。乳腺腫塊分割模型預測結果合格標準如下:①模型輸出的腫塊區域為穿刺病理結果證實的腫塊,或隨訪一年以上的良性腫塊;②模型輸出的腫塊邊緣與腺體分界清晰且與人工判斷的邊緣一致。乳腺鈣化分割模型預測結果合格標準:①模型輸出的鈣化區域為穿刺病理結果證實惡性或良性區域,或隨訪一年以上的良性鈣化;②模型輸出的鈣化區域為每一個鈣化點。
3.影像組學分析
影像組學模型構建和測試的所有過程在Python (v 3.6.0)的FeAture Explorer Pro (FAEPro,v.0.3.4)[9]開源平臺上進行。建立影像組學模型主要步驟包括:①特征提取;②特征降維;③特征選擇;④模型訓練。基于分割模型預測結果作為圖像分析興趣區(region of interest,ROI),使用Python的PyRadiomics package[10]提取腫塊和鈣化的組學特征,訓練了乳腺X線攝影腫塊和鈣化的影像組學模型。
4.模型效能判斷
采用受試者操作特征(receiver operating characteristic,ROC)曲線并及計算ROC曲線下面積(area under curve,AUC)以定量評估影像組學模型對乳腺腫塊和鈣化良惡性二分類的鑒別效能。以影像組學模型鑒別乳腺病變良惡性的最佳截斷值(cutoff value)來計算符合率(accuracy,ACC),敏感度(sensitivity,SEN)和特異度(specificity,SPE)。
5.放射科醫師診斷效能
由一位高年資(7年以上乳腺X線攝影診斷經驗)放射科醫師以第5版BI-RADS標準[11]回顧性評估腫塊及鈣化性病變并分類。乳腺X線診斷BI-RADS 2~4a類定義為良性病變,BI-RADS 4b~5類定義為惡性病變,計算放射科醫師的ACC、SEN、SPE。
6.統計學分析
采用SPSS 22.0進行統計學分析,繪制ROC曲線并計算AUC。選擇cutoff值一般取約登指數最大時對應的值,約登指數為敏感度+特異度-1。采用配對卡方檢驗評估放射科醫師和影像組學模型兩種方法的診斷結果的一致性,以P<0.05為差異有統計學意義。
結 果
在乳腺腫塊模型預測腫塊區域絕大部分得到放射科醫師認可,僅少數(10%)乳腺X線圖像中腫塊病變需要人工修改,而乳腺鈣化分割模型預測結果完全覆蓋乳腺X線圖像中鈣化區域。
乳腺腫塊和鈣化組學特征提取均為102個,對特征向量進行歸一化、降維后選擇模型達到最優效能的組學特征,分別為9個、13個。本研究兩種影像組學模型建模流程見表1,描述了各自的歸一化方法、降維方法、特征選擇器、分類器。

表1 影像組學模型構建流程
影像組學模型對乳腺腫塊和鈣化區域分割模型預測的ROI分析結果見圖2~5。影像組學模型鑒別乳腺腫塊和鈣化良惡性的ROC曲線見圖6,訓練集的AUC均達1,測試集的AUC分別為0.84、0.88,影像組學模型對腫塊和鈣化良惡性二分類的cutoff值分別為0.644、0.676。乳腺X線攝影腫塊和鈣化的影像組學模型和高年資放射科醫師診斷能力評估見表2,影像組學模型的ACC、SPE、SEN與高年資放射科醫師類似,腫塊、鈣化組學模型分別與放射科醫師的診斷結果的一致性對比,差異無統計學意義(P=0.66、0.69)。
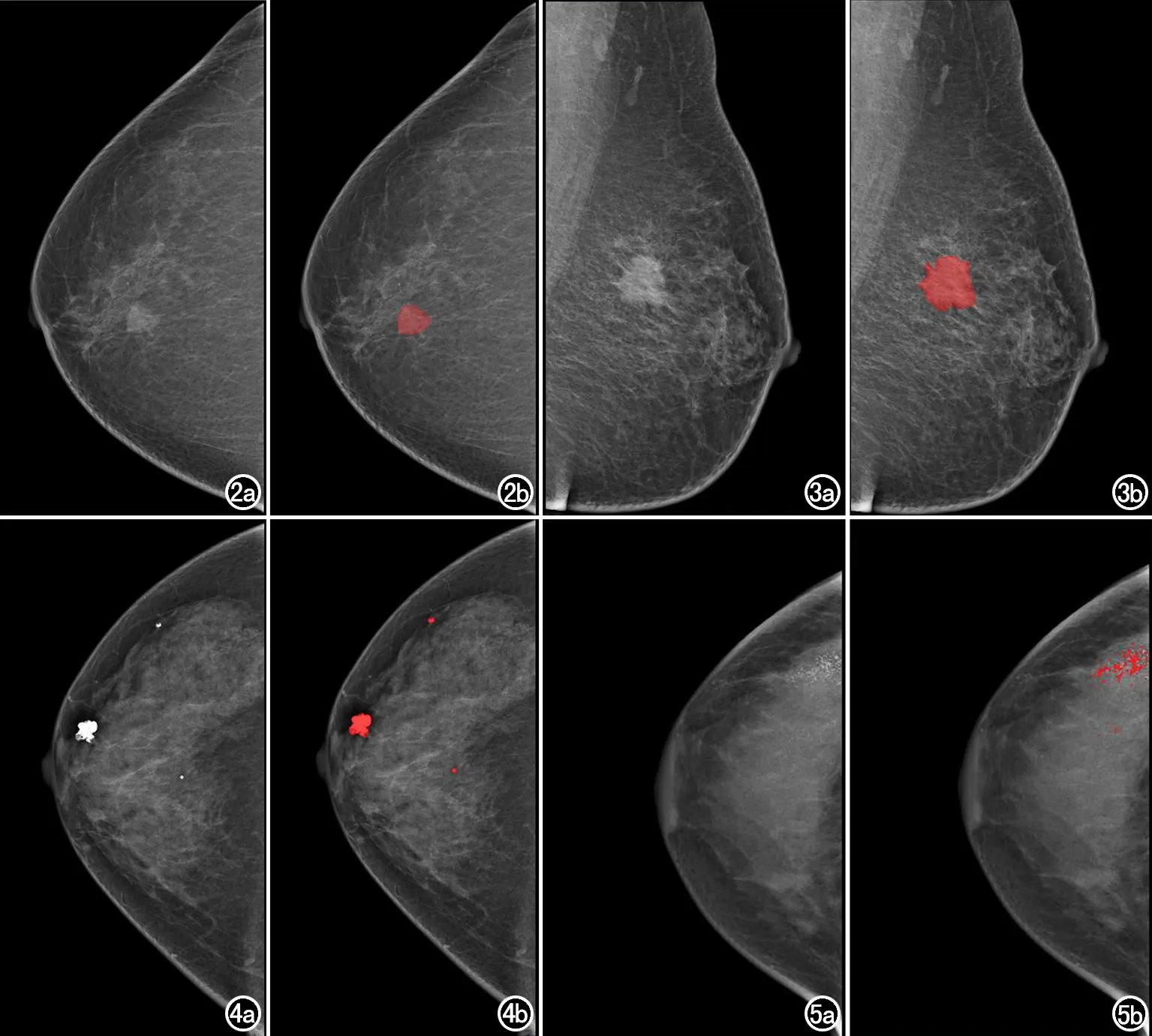
圖2~5 乳腺X線攝影中常見病變的分割模型對乳腺腫塊和鈣化區域預測的ROI(紅色區域)。 圖2 女,56歲,右乳內上象限顯示邊界清晰、邊緣光滑的稍高密度腫塊,徑線約1.5cm×2.1cm,高年資放射科醫師診斷為BI-RADS 4a類,影像組學評分(Rad-score)為0.272,行手術切除,病理結果為纖維腺瘤。 圖3 女,48歲,左乳外上象限顯示邊緣分葉狀、短毛刺稍高密度腫塊,徑線約2.4cm×2.9cm,高年資放射科醫師診斷為BI-RADS 5類,Rad-score為0.966,行手術切除,病理結果為浸潤性導管癌。 圖4 女,32歲,右乳散在點狀、圓形、顆粒狀鈣化影,高年資放射科醫師診斷為BI-RADS 2類,Rad-score為0.001,1年后隨訪乳腺超聲及乳腺X攝影檢查未見惡性結果。 圖5 女,38歲,右乳外上象限顯示砂礫樣、不均質鈣化,呈區域分布,高年資放射科醫師診斷為BI-RADS 5類,Rad-score為0.997,行手術切除,病理結果為浸潤性導管癌。
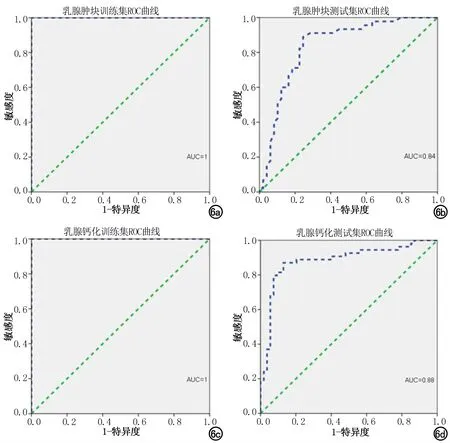
圖6 a)乳腺腫塊在影像組學模型在訓練集的ROC曲線;b)乳腺腫塊在影像組學模型在測試集的ROC曲線;c)乳腺鈣化在影像組學模型在訓練集的ROC曲線;d)乳腺鈣化在影像組學模型在測試集的ROC曲線。
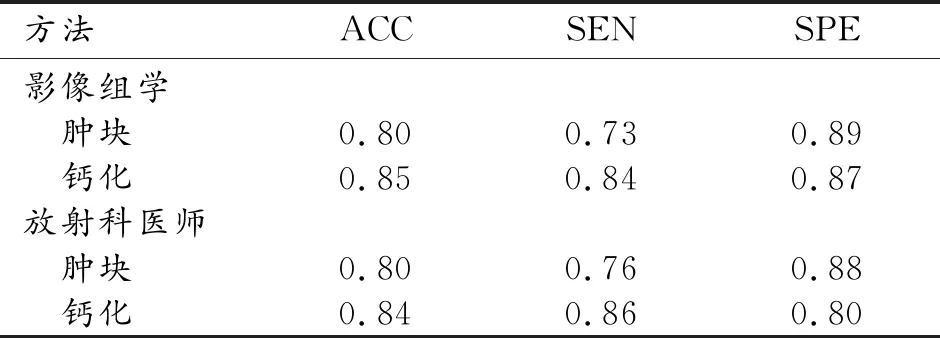
表2 影像組學模型和放射科醫師在測試集中預測效能
討 論
乳腺X線攝影檢查已廣泛應用于女性乳腺癌篩查檢查中,乳腺癌在其中最為常見且直接的征象是腫塊和鈣化[12],依據病變特征(如徑線、邊緣、形態)進行BI-RADS分類,但是特征之間存在復雜的相互作用,因此對于放射科醫師做出準確診斷仍是具有挑戰性的。基于人工智能的影像組學是利用大量醫學影像數據進行有效定量分析和預測的新興技術,從臨床醫學圖像中提取肉眼無法識別的定量特征,并利用影像組學特征與病理結果之間關聯,建立個性化預測模型[13]。影像組學已成功應用于腫瘤學領域,包括肺癌[14]、前列腺癌[15]、乳腺[16]等,進行相關的病理類型、分子分型、腫瘤分期、療效評估等研究。既往已有研究采用影像組學技術基于乳腺X線圖像來鑒別乳腺癌[17]、鈣化良惡性[18]以及預測淋巴結轉移[19]等。
目前較少有針對乳腺X線圖像中腫塊和鈣化良惡性鑒別的研究。Lei等[18]研發了基于乳腺X線圖像的影像組學模型對于BI-RADS 4類鈣化良惡性鑒別,在測試集中AUC為0.8。本研究探討影像組學模型鑒別乳腺腫塊和鈣化的良惡性,結果顯示,在測試集中乳腺腫塊和鈣化的影像組學特征有明確的預測價值,AUC分別為0.84、0.88;乳腺腫塊和鈣化組學模型和有經驗放射科醫師對比差異均沒有統計學意義(P>0.05)。本研究與既往研究的不同之處有兩點:第一,本研究輸入的是全部鈣化,而非僅BI-RADS 4類。BI-RADS定義了良惡性鈣化的類型及表現,選擇4、5類鈣化進行分析,有可能幫助醫生提高診斷符合率。但在實際場景中,如果模型僅識別4、5類病灶,則需要醫生先檢出鈣化、行BI-RADS分類,如有4、5類病灶,則將這些區域輸入模型預測,得到預測結果后,醫生結合模型預測結果做出最終診斷。這個流程中醫生參與了較多環節。筆者希望的場景是:攝片完成后,圖像自動輸入到模型中,模型針對所有鈣化灶自動預測,全部結果返回后,醫生結合模型預測結果做出最終診斷,醫生打開報告即可見到已預測好的良惡性分類結果。在模型準確性較高的前提下,這個場景醫生花費的時間較短。因此,筆者目前把所有鈣化都輸入組學模型進行訓練。第二,本研究采用了半自動標注方法,這是影像組學研究的一個常用技術路線。通常人工標注的ROI雖具有較高的準確性、重復性,但也有耗時、費力的缺點,因此越來越多的研究試圖使用自動或半自動方法完成標注。本單位既往大量研究中對乳腺鉬靶病灶的分割技術已經非常成熟,基于AI分割病灶的精確性和可重復性高,本研究分割范圍大部分得到專業醫師的認可,僅有一小部分(10%)的病變需要修改,因此選擇了以AI為基礎的半自動標注方法。
本研究有一定局限性。第一,作為回顧性研究,納入腫塊病例均為邊界相對明確者,存在一定選擇偏倚。而實際臨床中乳腺腫塊性病變表現多種多樣,如邊界不清、腫塊合并鈣化等,因此需要增加樣本量,入組復雜病例,必要時進行更多的亞組分析,最終應行前瞻性研究評估影像組學模型對乳腺腫塊各種病變表現的良惡性鑒別。第二,本研究基于病灶進行數據分析。研究圖像選擇的原則是根據最終病理或隨訪結果:惡性病灶必須獲得病理證實才能入組,良性病灶應隨訪至少一年以上。由于影像組學是研究病灶局部特征,因此獲得病理或隨訪證實的圖像,無論其位于CC還是MLO都可以入組,結果分析也是基于病灶,與攝片體位無關。在臨床工作中,如CC或MLO上均有可見病灶,通常醫生讀片時會判斷CC和MLO上的病灶是否為同一病灶,如為同一病灶則將二者特征綜合考慮。本研究不涉及判斷不同體位圖像中病灶是否為同一病灶的內容,這是本研究的不足之一。第三,本研究中乳腺X線圖像中高密度鈣化病變評估有一定優勢,但是對于敏感度相對較低的腫塊病變,常聯合乳腺超聲檢查圖像,來提高診斷的符合率,今后研究中可聯合乳腺X線片及超聲圖像建立乳腺病變的組學模型,進而增加研究結果的臨床應用價值。最后,本研究僅是對乳腺病變良惡性鑒別,而在實際工作報告中BI-RADS分類對于病變有更明確的風險分層及臨床建議,因此后續應探討組學模型對乳腺常見病變的BI-RADS分類應用價值的研究,并與臨床結構式報告對接、優化工作流程。
總之,本研究建立的影像組學模型可以提取并量化乳腺X線圖像紋理特征,在鑒別乳腺邊界清晰腫塊和鈣化的良惡性方面是可行的,有潛在的臨床應用價值。但是,本研究依然有未完善之處,后續探索可在研究設計、圖像納入、病變分類方面更加符合臨床場景,成為輔助放射科醫師診斷的新技術。

