基于Cu-Ce復合氧化物的低濃度CH4催化燃燒性能及微觀機理
張晨航,豆寶娟,滕子豪,吳亮鍇,郝慶蘭,賓 峰
(1.天津科技大學 海洋與環境學院,天津 300222; 2.中國科學院力學研究所 高溫氣體動力學國家重點實驗室,北京 100190)
0 引 言
我國每年通過乏風瓦斯向環境中排放大量的甲烷氣體,作為重要的溫室氣體,甲烷對全球增溫的能力是CO2的21倍[1]。乏風瓦斯熱值比較高(甲烷的熱值為35.9 MJ/m3),若能夠將其合理利用,具有環境保護和能源利用的雙重價值。目前,催化燃燒技術[2]被視為乏風瓦斯的潛在處理技術之一。甲烷,化學式CH4,是最簡單的烴,由1個碳和4個氫原子通過sp3雜化的方式組成,因此甲烷分子的結構為正四面體結構,4個鍵的鍵長相同鍵角相等。因其具有4個穩定的C—H鍵,鍵能達到413 kJ/mol,甲烷難以被一般的催化劑活化[3],故設計高性能的催化劑使其適用于甲烷的催化燃燒就成了解決乏風瓦斯高效燃燒問題的關鍵。
國內外許多學者針對甲烷催化氧化開展了大量試驗研究[4-6],典型的催化劑為負載型貴金屬和過渡金屬氧化物。貴金屬催化劑盡管具有很高的活性,尤其是Pd和Pt,然而在較高溫度下易燒結和升華,容易導致活性組分流失。與貴金屬相比,負載型過渡金屬氧化物雖然活性比較低,但是在苛刻的環境條件下更具有耐熱性、抗毒性強等特點,相比之下具有更高成本效益。
在非貴金屬類催化劑方面上,銅-鈰催化劑因具有較高的活性和耐久性,被視為貴金屬催化劑的替代品[7]。其中,Cu基催化劑本身也具有優良的催化性能和耐久性,在500~700 ℃時能夠實現乏風瓦斯的氧化,但Cu基催化劑的塔曼溫度較低[8],在甲烷催化燃燒中單獨使用,易因高溫導致燒結而失活,若將Cu負載在另一種過渡金屬氧化物表面,即可獲得顯著的耐燒結性能,且載體上的Cu基氧化物具有較高的分散度,進而降低了團聚現象[9]。除了抑制燒結及團聚現象以外,雙金屬、多金屬的協同增效作用有利于催化活性的提高。CHOUDHARY等[10]研究發現Cr、Co、Mn等過渡金屬氧化物摻雜在Cu基催化劑中使甲烷的燃燒活性顯著提高,原因是過渡金屬氧化物的摻雜致使催化劑內部形成一定的晶格缺陷,以提高氧的遷移效率。CH4催化反應的主要活性位是CuOx。相關研究證實[11],高度分散的CuOx簇通常被確定為CuO-CeO2的活性成分,而CeO2作為助劑,其特有的螢石型結構能夠有效促進Cu物種的分散,并且Ce會通過Ce4+和Ce3+的變換,使得CeO2具有優良的儲放氧性能。KANG等[12]研究發現CO氧化反應主要發生于CuO-CeO2表面分散的CuOx和CeO2相鄰的氧空位交界處。但是目前對CuO、CeO2和CuO-CeO2在CH4催化燃燒反應過程中活性位確定的相關研究較少,同時由于CH4分子的結構穩定性,一般催化劑表面的活性氧通常很難與目標氣體結合。Cu-Ce催化劑以其高效的協同特性與活化性能被應用于結構穩定氣體的催化燃燒。現有的研究針對Cu、Ce及Cu-Ce活性位點對CH4催化燃燒反應的作用機制尚不明晰。為此,筆者采用溶膠凝膠法制備CuO、CeO2和CuO-CeO2三種催化劑,首先采用XRD、XPS、H2-TPR和O2-TPD等方法考察其物理化學特性,再利用原位紅外光譜和分壓反應動力學方法研究反應物的化學吸附和反應途徑。該研究成果將為催化燃燒甲烷的催化劑活性位點和微觀反應機理提供新的見解,為乏風瓦斯大氣污染治理及余熱高效利用提供借鑒。
1 試驗方法
1.1 CuO/CeO2/CuO-CeO2的制備
Cu(NO3)2·3H2O和Ce(NO3)3·6H2O試劑以物質的量比1∶1混合,完全溶解在乙醇溶液中(80 ℃、140 mL),再快速加入草酸溶液(0.24 mol/L、造孔劑),恒溫攪拌溶液使乙醇蒸發,直至形成凝膠。凝膠在室溫下老化48 h后,在105 ℃下干燥12 h,然后在550 ℃下煅燒2 h,所得催化劑記為CuO-CeO2。為了比較銅氧化物和鈰氧化物對CH4氧化性能的影響,采用相同的方法分別制備CuO和CeO2催化劑。
1.2 樣品表征
催化劑的晶體結構由XD-3型全自動衍射儀測得(XRD),掃描方式和速度分別是2θ/θ連續掃描和0.02 ℃/min。采用共聚焦顯微拉曼光譜儀(HORIBA LabRAM HR Evolution)在488 nm的激光波長下測定催化劑的氧空位濃度(光譜范圍:10~9 000 cm-1,行程范圍:112 mm×76 mm)。使用Kratos Axis Ultra DLD型X射線光電子能譜儀光譜儀進行了XPS分析。在測試前,將分析室腔體內的真空度抽到5.0×10-7Pa 。在TP5080B化學吸附儀上開展程序升溫還原(H2-TPR)分析:20 mg催化劑置于石英反應管中,在5% H2/Ar中以10 ℃/min的程序升溫速率升至500 ℃;改通100% O2后,在O2中吸附30 min,然后暴露于N2中升溫至300 ℃再降到室溫,改通O230 min,用N2吹掃20 min用來吹掉表面物理吸附的O2,再以10 ℃/min程序升溫速率升溫至980 ℃,全程使用熱導池檢測器進行跟蹤檢測。采用TP5080B化學吸附儀探究催化劑表面吸附或氧化的情況(O2-TPD)。使用在線氣體分析儀(Maihak)來監測流出的CH4、O2和CO2(CH4體積分數為0%~30%,精度為±2%FS;O2體積分數為0~40%,精度為±3%FS;CO2體積分數為0~10%,精度為±3%FS)。在FOLI10-R儀器上開展原位紅外光譜研究,采用磁驅動透射式原位池,用50 mL/min的N2升溫到300 ℃進行預處理,降到室溫后,采用總流量50 mL/min的10%CH4+90%Air進行背景光譜采集,其中約3 mg催化劑和溴化鉀被壓入支撐架中開展CH4氧化反應探究。
1.3 催化劑活性評價
CH4催化燃燒的活性評價在固定床反應器上進行,氣體流量用質量流量計控制,總流量為200 mL/min,反應氣的體積組成為1% CH4,78% N2和21% O2。催化劑質量0.2 g,填充于內徑為3 mm的石英玻璃反應管中,試驗采用程序升溫的方法,溫度控制在100~550 ℃,升溫速率為5 ℃/min。反應前后的氣體組分及濃度由北京麥哈克紅外氣體分析儀(QGS-08)在線測定。
2 結果與討論
2.1 XRD分析
CuO、CeO2和CuO-CeO2的XRD衍射譜圖如圖1所示。從圖1中均可觀察到3種催化劑均以典型的CeO2立方螢石結構存在,衍射峰位于28.5°,33.1°,47.5°和56.3°,分別對應(111)、(200)、(220)和(311)晶面[13]。另外,圖1中35.6°和38.8°歸屬CuO的衍射峰,對于CuO和CuO-CeO2催化劑,CuO-CeO2催化劑中該峰強度與CuO相比明顯減弱,并結合其螢石結構峰型寬化現象,表明CuO-CeO2催化劑形成CuCeOx固溶體或以分散性良好的CuO團簇形式存在,并錨定于CeO2表面[12]。
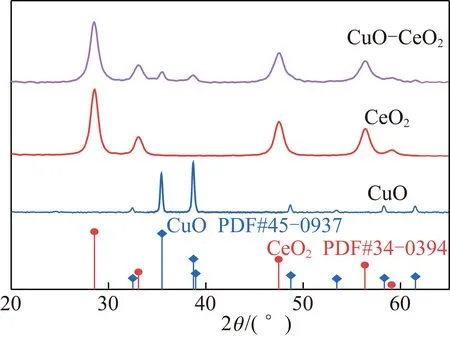
圖1 3種催化劑的XRD衍射圖Fig.1 XRD diffraction map of CuO, CeO2,and CuO-CeO2 catalysts
2.2 XPS分析
催化劑表面元素組成和化學狀態由XPS測定。Cu 2p在催化劑上的XPS譜圖如圖2所示,Cu 2p3/2峰具有不對稱性,原始曲線可以分峰擬合為933.2 eV和934.8 eV,分別對應于Cu+和Cu2+,這表明在CuO和CuO-CeO2催化劑中存在著Cu+/Cu2+氧化還原對。此外,941~944 eV處出現的衛星峰也證明了Cu2+的存在。
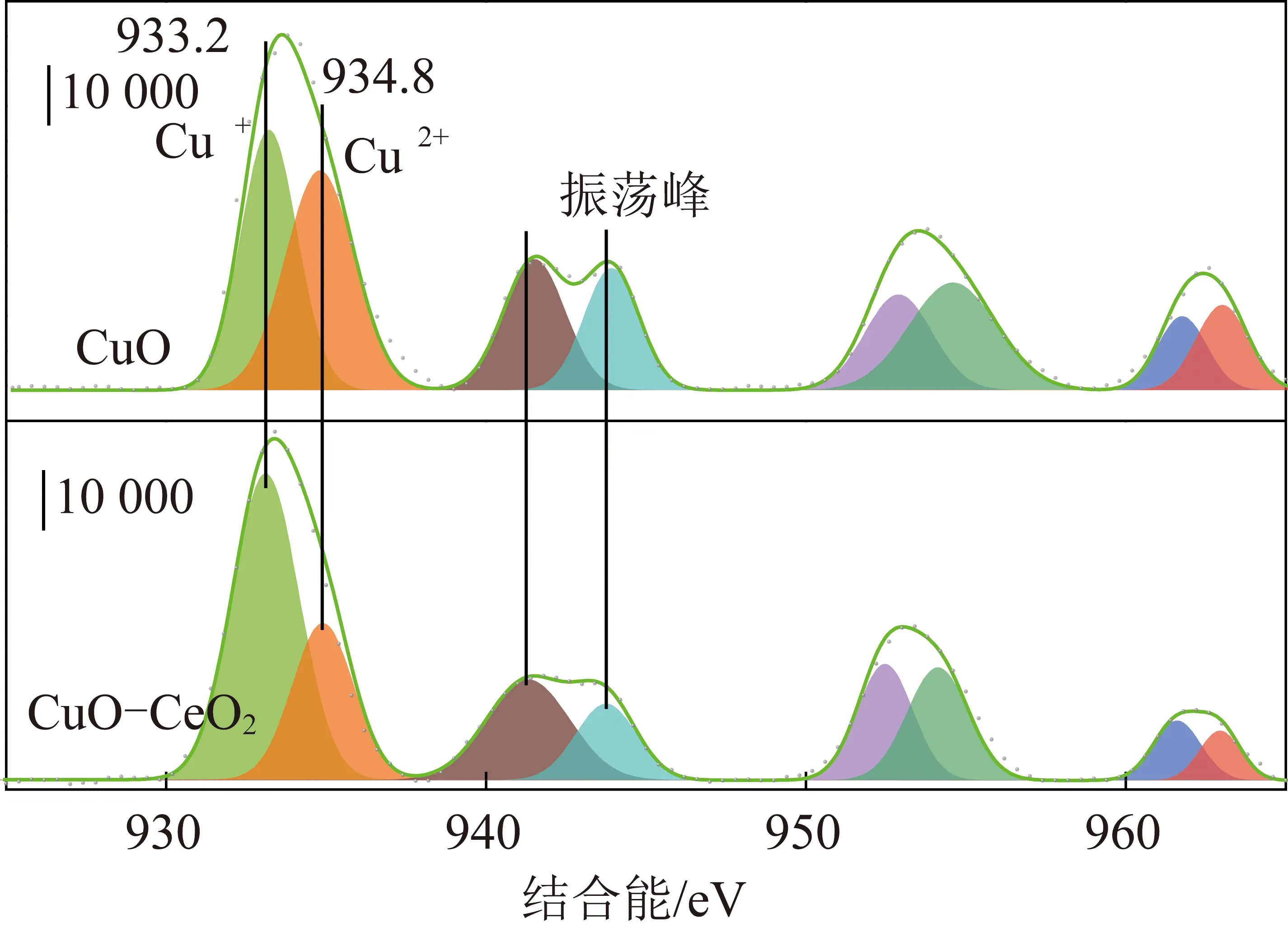
圖2 Cu 2p在催化劑上的XPS譜圖Fig.2 Cu 2p XPS spectrum in the catalysts
Ce 3d能譜由8個峰位組成(圖3),將其分解成4對自旋軌道雙峰(用u、v標記):其中u、u2和u3峰對應于Ce4+的3d3/2水平,而標記為v、v2和v3的峰分配給Ce4+的3d5/2;882.6和900.8 eV處分別歸屬為Ce 3d5/2和Ce 3d3/2。CuO-CeO2催化劑4個強度比較高的882.6、900.8、898.3、917.0 eV峰歸屬于Ce4+物種中不同的Ce 4f電子排布,2個比較弱的峰(889.3、907.3 eV)代表Ce3+中可能得電子情況下2種排布的一種。Ce4+是正六面體穩定結構,可以增加活性物種CuO的分散狀態,同時Ce3+不是正六面體結構且氧空位數量多,所以增強Ce3+對O的吸附能力,Ce在三價和四價的轉換顯著提升催化劑儲氧放氧能力因此能夠提高催化劑活性。根據表1列出的銅和鈰物種的表面組成,CuO-CeO2的Cu+/Cu2+和Ce3+/Ce4+比分別高于塊狀CuO和CeO2,表明這些Cu+物種產生于Cu+-[Ov]-Ce3+界面([Ov]=表面氧空位)通過Ce4+還原形成了Ce3+。
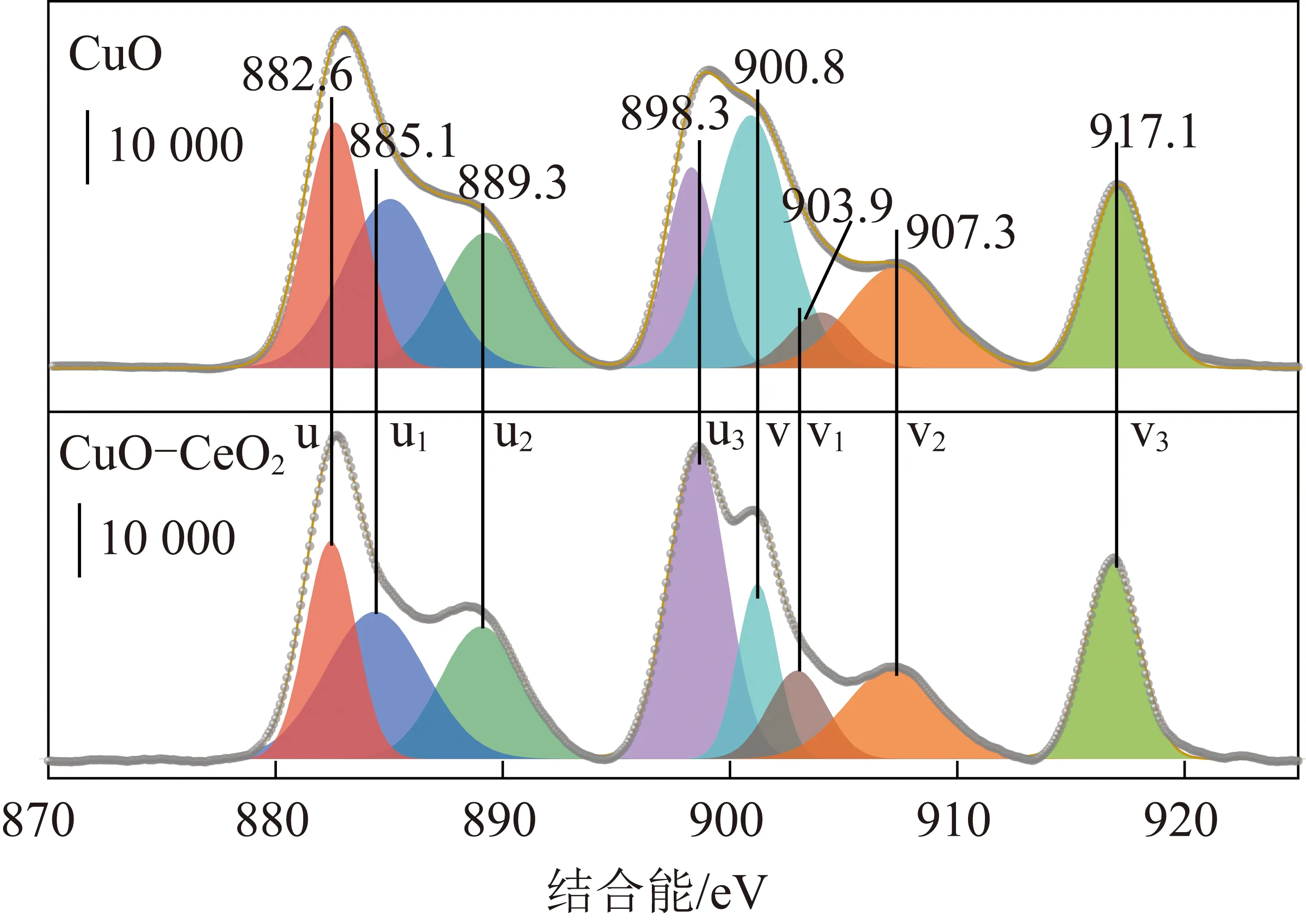
圖3 催化劑上的Ce 3d XPS譜圖Fig.3 Ce 3d XPS spectrum in the catalysts

表1 催化劑的表面組成
2.3 H2-TPR試驗結果分析
采用H2-TPR測試催化劑的氧化還原能力,如圖4所示,CuO的還原峰由216 ℃的γ峰和184 ℃的β峰組成,分別歸因于分散的CuOx團簇和結晶CuO中銅物種的還原[12]。而CuO-CeO2催化劑在153 ℃(α峰)、186 ℃(β峰)和202 ℃(γ峰)有3個重疊的還原峰,其中α峰歸因于CuCeOx固溶體的還原。CuO-CeO2中α峰的溫度較低就證實了與氧結合的能力強于CuO,而CuO和CeO2之間的協同效應導致CuO-CeO2比純CeO2更低的還原溫度(α峰的存在)。3種催化劑的氫氣消耗量見表2。由表2可知,CuO催化劑的H2消耗量最大,其原因是銅物種比鈰物種更易還原,且該催化劑的銅含量最高,CuO-CeO2的H2消耗量次之,CeO2耗氫量最少。需要指出的是,催化劑的氧化還原性能主要取決于其較低的還原溫度,所以3種催化劑的氧化還原能力排序為CuO-CeO2>CuO>CeO2。
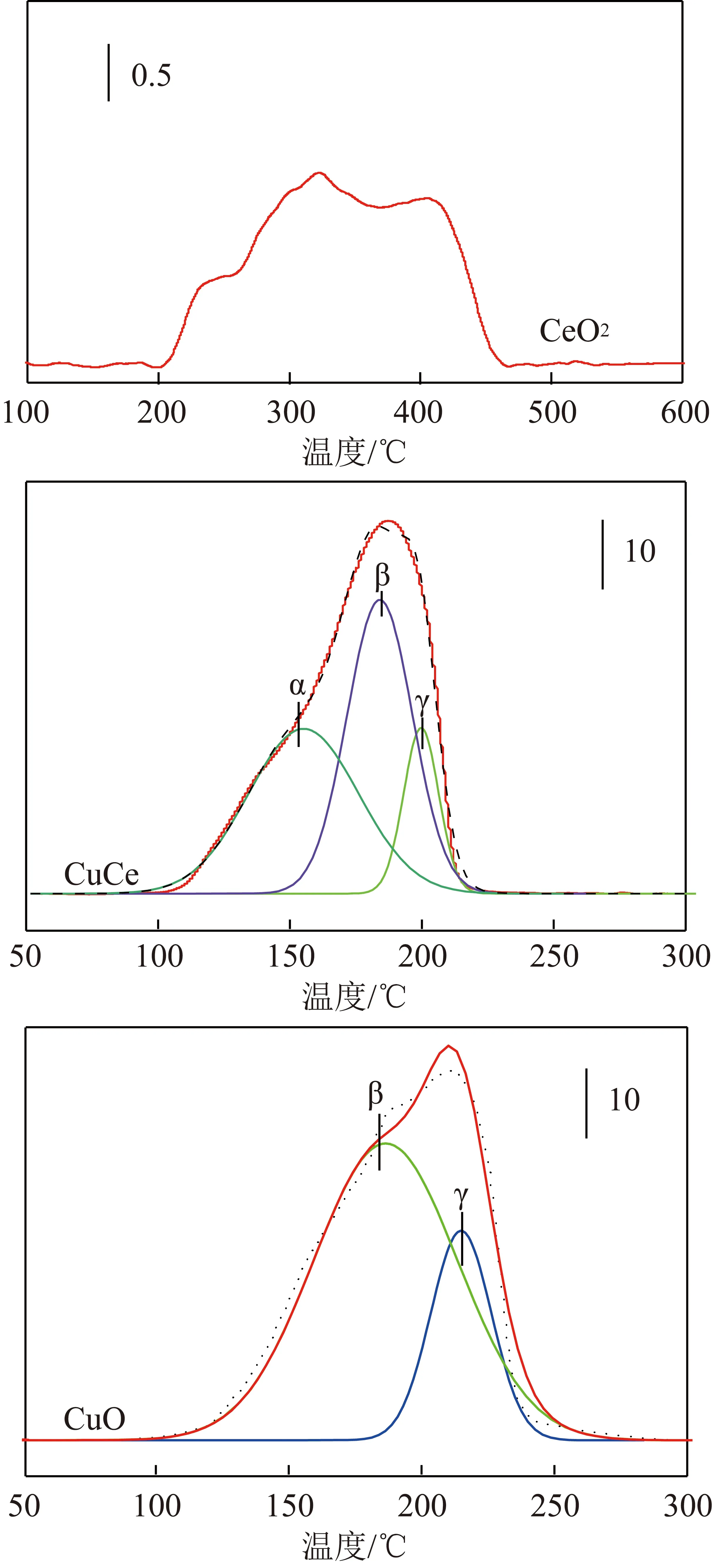
圖4 3種催化劑的H2-TPR曲線Fig.4 H2-TPR curves of CuO, CeO2, CuO-CeO2 catalysts

表2 3種催化劑的H2消耗量
2.4 O2-TPD試驗結果分析
采用O2-TPD方法考察催化劑中氧物種的遷移率,如圖5所示。CuO和CuO-CeO2催化劑的O2-TPD曲線分別在300 ℃和800 ℃左右出現低溫峰和高溫峰。CuO、CeO2和CuO-CeO2三種催化劑的低溫峰主要由于表面物理吸附氧脫附引起,而CuO和CuO-CeO2的高溫峰來源于催化劑中的體相晶格氧脫附。在高溫段,CuO催化劑在820 ℃的脫附峰對應從Cu離子逃逸的晶格氧,CeO2催化劑良好的熱穩定性致使體系中無晶格氧脫附,XPS結果也證實,純CuO是一種非化學計量比氧化物,晶格氧脫附后所形成的金屬離子缺陷比CeO2更容易吸附氧。純CeO2上的氧空位對氧吸附的貢獻十分有限。然而,銅和鈰之間的協同效應導致氧的解吸峰向低溫(790 ℃)移動。盡管CuO-CeO2的脫附峰面積小于CuO催化劑的峰面積,但脫附溫度下降,表明CuO-CeO2催化劑有更強的氧流動性,加速氧從內部到表面的遷移,有利于高溫下的氧化反應,從而提高甲烷催化燃燒的催化活性。
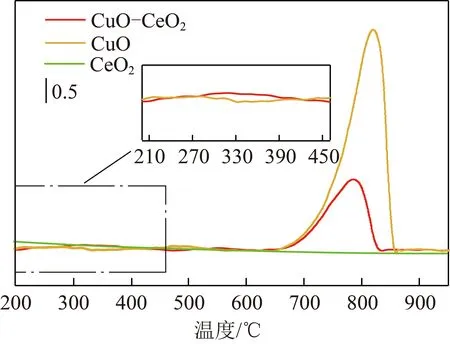
圖5 CuO、CeO2、CuO-CeO2催化劑的O2-TPD圖Fig.5 O2-TPD diagram of CuO, CeO2 and CuO-CeO2 catalysts
2.5 催化劑活性評價
CH4催化燃燒的活性評價在自行建立的固定床反應器上進行,反應氣總流量控制為200 mL/min(1% CH4、78% N2和21% O2),所得到的CH4催化燃燒活性曲線如圖6所示。3種催化劑的活性順序為CuO-CeO2>CuO>CeO2。CeO2的T10(轉化率為10%所對應的溫度)為438 ℃,T90(轉化率為90%所對應的溫度)為530 ℃,效果最差;效果較好的CuO的T10和T90分別為348 ℃和483 ℃,而效果最好的CuO-CeO2催化劑T10為323 ℃,T90為444 ℃,結合XRD和XPS分析結果,研究表明CuO與CeO2相互摻雜形成一定的晶格缺陷,這些缺陷提高了氧的遷移速率,從而促進CuO-CeO2催化活性明顯提升。據文獻[14-16]報道,Cu系催化劑對甲烷的轉化率與負載量呈正比關系,指出負載量過高會導致金屬分散度降低和表面活性位堆積。然而本研究引入金屬Ce不但帶來更高的移動活性氧,也提高了Cu的分散性。故CuO-CeO2催化劑在催化氧化CH4的活性評價中表現出比CuO和CeO2更高的低溫活性。

圖6 CuO、CeO2、CuO-CeO2催化劑催化燃燒CH4的轉化率曲線Fig.6 Conversion rate curves of CH4 combustion overthe CuO, CeO2 and CuO-CeO2 catalysts
2.6 分壓反應動力學分析
為了探究CH4與O2對反應速率的影響規律,在催化劑活性評價臺上進行分壓反應動力學試驗,反應過程中CH4的轉化率控制在<10%。保持CH4或O2壓力不變,N2作為平衡氣,總流量200 mL/min,基于CuO-CeO2催化劑確定CH4催化燃燒反應速率方程和O2對反應速率的影響規律,其動力學試驗結果見表3。
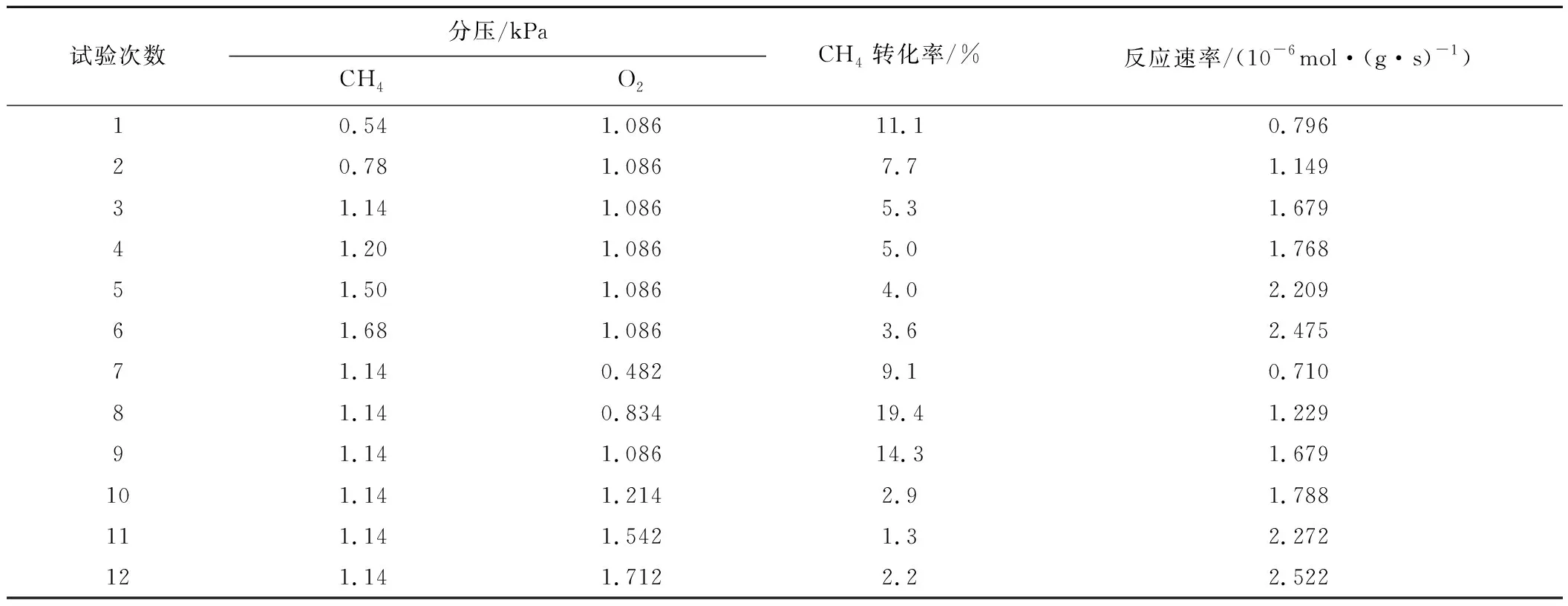
表3 CuO-CeO2催化劑的動力學試驗結果
筆者采用Polymath 6.10建立了基于質量作用定律的動力學經典模型:
r(CO)=kPa(CH4)Pb(O2),
(1)
其中,r(CO)為CO轉化率;k為反應速率常數,s-1;P(CH4)和P(O2)為CH4分壓和O2分壓;a和b為CH4和O2的反應級數。經過模型計算,CuO-CeO2的動力學模型為:r(CO)=1.33P(CH4)1.029P(O2)0.948,曲線擬合的相關系數大于0.999。因此,CuO-CeO2催化劑CH4(1.029)和O2(0.948)的反應級數相差不大(圖7),但CH4的反應級數大于O2,反應遵循L-H機理,即吸附的CH4與吸附的O2發生反應。
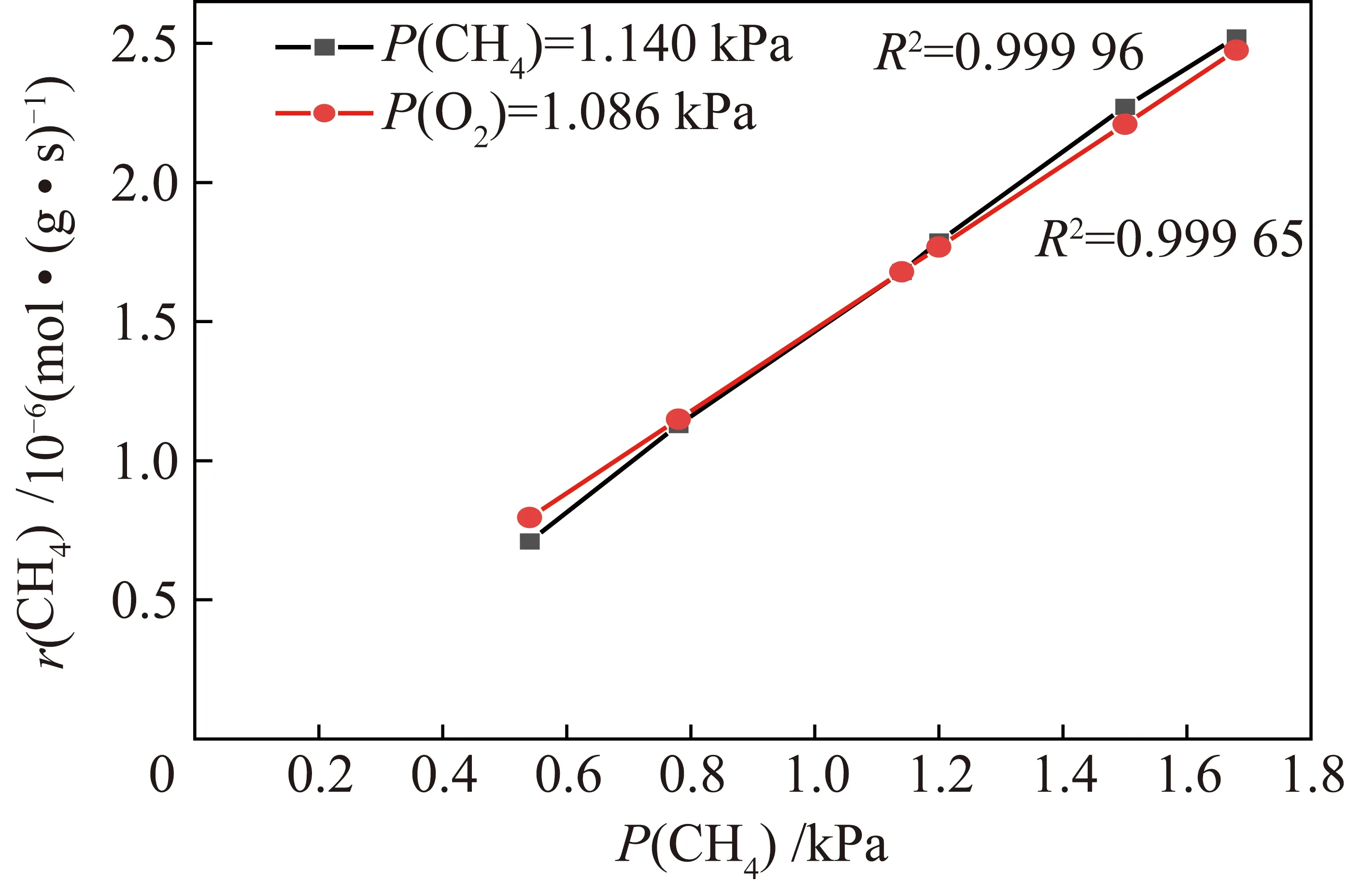
圖7 CuO-CeO2催化劑的CH4催化燃燒反應速率Fig.7 CH4 reaction rate of the CuO-CeO2 catalyst
2.7 In-situ DRIFT結果分析
為進一步分析CH4催化燃燒過程的吸附中間產物,采用原位紅外光譜儀探究了CuO-CeO2催化劑上CH4催化燃燒反應過程,結果如圖8所示。
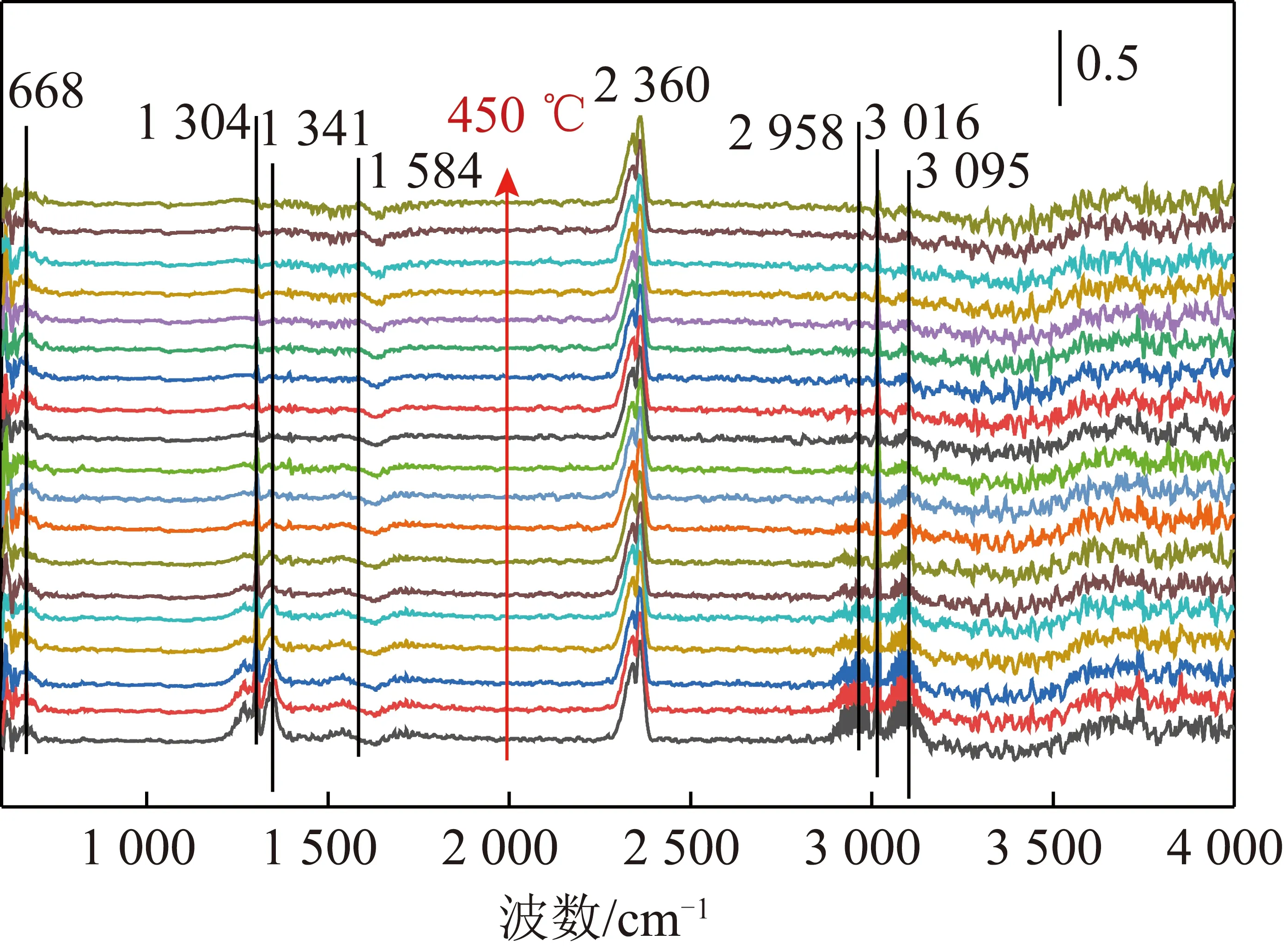
圖8 CuO-CeO2上CH4催化燃燒原位紅外光譜分析Fig.8 In-situ infrared spectroscopy analysis for CH4 catalyticcombustion over CuO-CeO2
由圖8可知,50 ℃時,波數為1 304、1 341及1 584 cm-1處的特征峰主要歸屬于CH4與O2吸附在CuO-CeO2催化劑CuCeOx固溶體上形成碳酸鹽(RCO3)物種[17-20]。2 958、3 016 及3 095 cm-1處為CH4化學吸附在催化劑上的CuCeOx固溶體及分散性CuOx的Cu位點上,形成了甲氧基物種(Cu—OCH3)與甲酸鹽物種(Cu—OOCH)[21]。2 360 cm-1處的特征峰歸屬于CO2的產生峰。隨著反應溫度的升高,甲氧基與甲酸鹽物種的不飽和C—H鍵的強度急劇降低,與吸附氧反應生成了CO2;同時碳酸鹽分解也產生了CO2。由以上結果可知,CuCeOx固溶體及分散性CuOx是反應的主要活性位點,吸附的甲烷與吸附的氧生成中間物種(甲氧基、甲酸鹽及碳酸鹽),進而分解產生CO2和H2O,反應遵循L-H機理,結果與反應動力學結果一致。
3 結 論
1)使用溶膠凝膠法制備了3種催化劑(CuO/CeO2/CuO-CeO2),并通過催化劑活性評價,發現CuO-CeO2催化劑在甲烷催化燃燒表現出了最佳活性,CH4開始轉化溫度為246 ℃,完全轉化溫度461 ℃。
2) XPS、XRD、H2-TPR、O2-TPD結果表明過渡金屬氧化物CuO的摻雜,引入了一定量的晶格缺陷,提高了氧的遷移速率。Ce3+/Ce4+和Cu2+/Cu+電子對均參與CH4的催化循環(Cu++Ce4+←→Cu2++Ce3+),活性氧的主要來源是CuO。同時Ce3+和Ce4+的轉換也提高催化劑的儲氧放氧能力,Ce的引入提高了Cu在催化劑表面的分散性,并且形成了CuCeOx固溶體。CuO-CeO2催化劑上分散性CuOx與CuCeOx固溶體是主要的反應活性位,促進活性的提高。
3) 提出了甲烷在CuO-CeO2催化劑上可能存在的反應機理。通過分壓動力學試驗及模型計算表明,在催化燃燒過程中,CuO作為CH4和與O2的吸附活性位,在催化劑表面的反應級數相差不大且接近1(CH4:1.029,O2:0.948),即吸附的CH4與吸附的O2發生反應,反應遵循L-H機理。同時原位紅外試驗結果表明,吸附的甲烷與吸附的氧生成中間物種甲氧基、甲酸鹽及碳酸鹽。甲氧基與甲酸鹽物種的不飽和C—H鍵與吸附氧反應以及碳酸鹽的分解產生CO2和H2O,反應遵循L-H機理,2者進行了相互驗證。

