不同培養液對大菱鲆致病性纖毛蟲
——貪食邁阿密蟲種群增長及復壯毒力的影響
黃智慧 王慶敏 馬愛軍 郭曉麗
(1 中國水產科學研究院黃海水產研究所,農業農村部海洋漁業可持續發展重點實驗室,山東省海洋漁業生物技術與遺傳育種重點實驗室,青島市海水魚類種子工程與生物技術重點實驗室,山東青島 266071; 2 青島海洋科學與技術試點國家實驗室海洋生物學與生物技術功能實驗室,山東青島 266071)
海洋纖毛蟲在微生物食物環中占據重要而又特殊的地位,也是引發赤潮和養殖動物病害的常見種,從而成為人們日益關注的對象。盾纖毛蟲隸屬于纖毛門(Ciliophora)、寡膜綱(Oligohymenophorea)、盾纖目(Scuticociliatida)[1]。該類纖毛蟲通常自由生活在海水中,但在一些情況下,如魚體受傷、環境惡化等,可引起海水養殖動物感染,纖毛蟲表現為寄生性,以宿主細胞或組織為食,并在其組織中生長、繁殖,導致養殖動物大量死亡[2]。目前已有報道,海洋尾絲蟲(Uronemamarinum)、水滴偽康纖蟲(Pseudocohnilembuspersalinus)和貪食邁阿密蟲(Miamiensisavidus)等能夠引起大菱鲆(Scophthalmusmaximus)[3-4]、鱸魚(Dicentrarchuslabrax)[5]、比目魚(Paralichthysolivaceus)[6]、海龍(Phyllopteryxtaeniolatus)[7]、虹鱒(Oncorhynchusmykiss)[8]、藍鰭金槍魚(Thunnusmaccoyii)[9]等海洋魚類發病[10]。近年來,有關海洋纖毛蟲分離培養的研究僅限于不同培養液對其種群增長的影響,而對寄生性的纖毛蟲在不同培養液中的毒理學實驗數據報道較少。本研究從山東煙臺地區患病大菱鲆的體表分離出貪食邁阿密蟲,挑取單個蟲體進行純化培養,并篩選了4種盾纖毛蟲常用的體外培養液,研究了不同培養基對其種群生長及復壯毒力的影響。
1 材料和方法
1.1 盾纖毛蟲的分離與純化培養
2018年10月,從山東省煙臺市某大菱鲆養殖場收集被盾纖毛蟲感染的大菱鲆(體長約15 cm),刮取病魚體表的潰爛組織,鏡檢發現有大量的盾纖類纖毛蟲,經鑒定為貪食邁阿密蟲(Miamiensisavidus)。在實驗室進行蟲體分離。步驟為:剪取魚體部分病灶組織,剪碎,加入50 mL離心管中,置于18~20 ℃恒溫培養箱內培養24~36 h。吸取纖毛蟲培養液,滴入裝有濾紙的漏斗進行過濾,反向滴洗濾紙,獲得10 mL蟲體收集液,經在顯微鏡下計數,其密度大于3×102個/mL。
1.2 4種培養液的制備
1.2.1 大腸桿菌培養液(DH)
取-80 ℃凍存的DH5α大腸桿菌100 μL作為細菌母液,于超凈工作臺中進行如下操作:在5個50 mL離心管中分別加入LB培養液,每管40 mL;用移液槍取25 μL細菌母液分至5個離心管中,將離心管放入37 ℃、200 r/min恒溫搖床中搖菌24 h。然后將在恒溫搖床中的LB液體培養基取出,放入離心機,以7 000 g離心10 min。于超凈工作臺中傾倒上清,加滅菌海水至10 mL,重懸大腸桿菌沉淀,再加海水至40 mL,放入離心機,以7 000 g離心10 min,反復沖洗2次。重懸大腸桿菌沉淀,再加海水至30 mL。于4 ℃冷藏備用。
1.2.2 牛肉浸膏培養液(BEV)
分別取牛肉浸膏10 g溶于100 mL人工海水中,配制成100 g/L牛肉浸膏培養液,靜置24 h后備用。
1.2.3 米粒培養液(RV)
每100 mL滅菌人工海水中加入30粒消毒米粒,即配制成米粒培養液(RV)。
1.2.4 改良L-15培養液(鹽度為10)(L-15)
配制640 mL的L-15(Leibovitz)培養液。分別添加腺苷(adenosine)、胞啶(cytidine)、尿苷(uridine)各90 mg,鳥苷(guanosine)150 mg,以及葡萄糖(glucose)5 g。添加250 mL脂質液(從干粉蛋黃中溶解1.6 mg/mL卵磷脂,以純凈水溶解0.8 mg/mL Tween 80,制備脂質液)。通過0.22 μm濾膜過濾。在無菌條件下,添加100 mL的10%胎牛血清FBS,添加前FBS應在56 ℃下水浴30 min滅活。最后添加10 mL 100×抗真菌劑(antibiotic antimycotic solution)。調節pH到7.2,再用0.22 μm濾膜過濾。
1.3 不同培養液對貪食邁阿密蟲種群生長的影響
試驗在12孔細胞培養板中進行,每孔加入2 mL培養液,參考張立坤等[11]的步驟進行接種:將處于種群生長平衡期的蟲體分別接種至4種培養液中,在23 ℃條件下進行培養,每種培養液設3個平行試驗組。定時計數,取3次樣品的平均值。按以下公式[12]計算種群自然增長率。
lnNt=lnN0+rt,
(1)
式(1)中,Nt為經過t時長后的種群密度(個/mL);N0為種群初始密度(N0=1×102個/mL);以時長為橫坐標,因變量是纖毛蟲密度的自然對數,其斜率即種群自然增長率r。
將試驗所得數據代入以上公式,可求出種群自然增長率r。
1.4 不同培養液對大菱鲆貪食邁阿密蟲復壯毒力的影響
選取健康大菱鲆幼魚[體質量為(30.0±7.2)g]共計120尾進行攻毒試驗。將幼魚暫養7 d,饑餓3 d后開始試驗,試驗期間正常投喂。試驗水溫為(16±1)℃,鹽度為30,用氧氣泵連續充氧,水體溶解氧保持在7.3 mg/L以上。通過腹腔注射貪食邁阿密蟲,即注射不同培養液濃縮獲得的0.1 mL貪食邁阿密蟲PBS懸浮液(蟲的濃度為1×105個/mL),參照Paramá等[13]的注射步驟進行操作。試驗時間共3周,其間記錄試驗魚首次出現感染的時間、死亡時間,統計死亡率等數據。
1.5 數據分析
采用SPSS 16.0統計軟件進行數據處理和分析。用Duncan’s檢驗法進行顯著性分析和多重比較,數據結果以“平均值±標準差”的形式表示,設P<0.05為差異顯著。
2 結果
2.1 不同培養液對貪食邁阿密蟲種群增長曲線分析
試驗結果顯示,貪食邁阿密蟲在4種培養液中均可以生長,且在種群增長過程中均存在停滯期、指數期、穩定期、衰退期4個時期,其生長情況見圖1所示。其中,BEV和L-15組較先達到密度高峰,DH和RV組則遲24 h才達到密度高峰。L-15組的種群密度最高,且穩定期較長,衰退期較晚;RV組次之。由圖1可看出,各組種群增長曲線之間在不同時間點存在不同程度的差異。
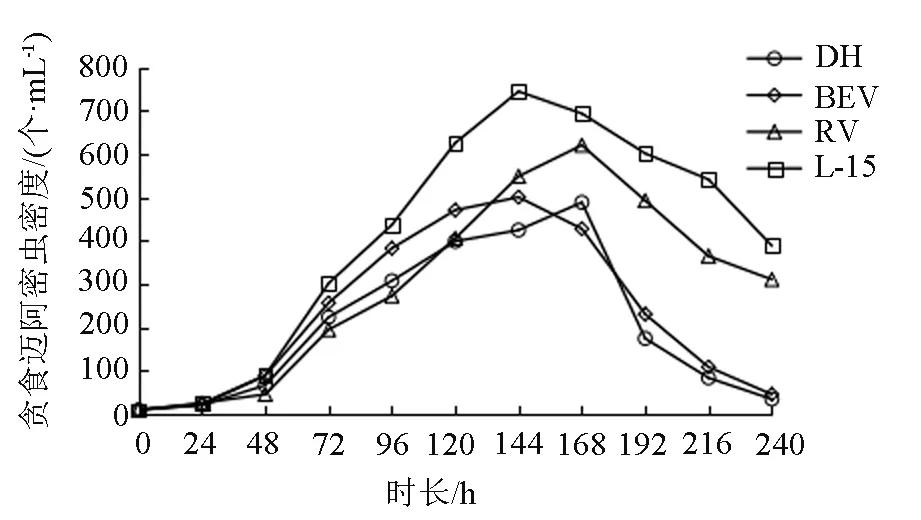
圖1 貪食邁阿密蟲在4種培養液中的種群增長曲線
2.2 不同培養液對貪食邁阿密蟲的復壯毒力分析
在不同培養液條件下貪食邁阿密蟲感染大菱鲆的毒力分析見表1。結果顯示,在DH與RV兩種培養液中生長的貪食邁阿密蟲毒力較弱,其致死率分別為43.80%和49.30%,而BEV和L-15組毒力顯著高于其他2組(P<0.05),其中L-15致死率最高,達85.10%。從感染時間來看,BEV和L-15組感染較早。4種培養基的首末尾感染歷時沒有顯著差異(P>0.05)。L-15首尾死亡時間最早,僅(6.00±0.66)d即死亡,其次為BEV、RV、DH,而4種培養基的首末尾死亡歷時沒有顯著差異(P>0.05)。因此可以判斷,L-15培養液最符合貪食邁阿密蟲的寄生環境,BEV次之。
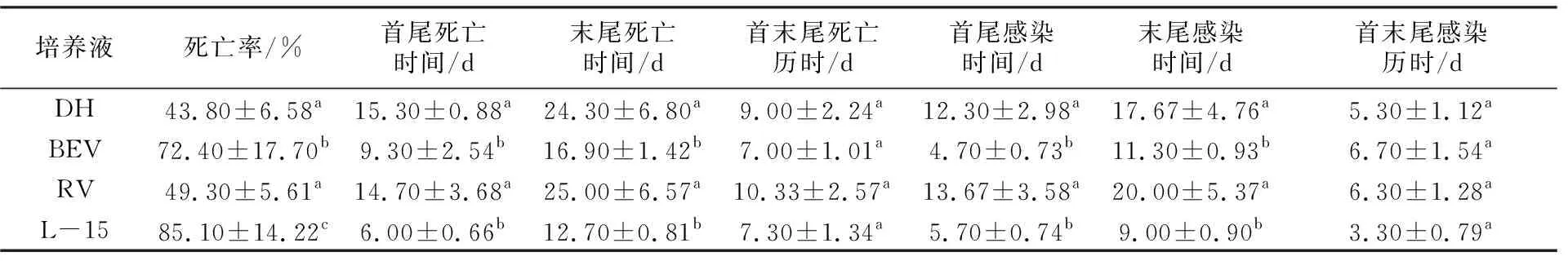
表1 不同培養液下貪食邁阿密蟲感染大菱鲆的情況比較
3 討論
貪食邁阿密蟲屬于兼性或機會寄生種盾纖毛蟲,通常情況下營自由生活,在特定條件下可在養殖魚類體內外營寄生生活,如在養殖魚類傷殘,養殖環境水溫、酸堿度等發生較大變化,魚體免疫力降低等情況下,纖毛蟲會直接危害魚體[14]。貪食邁阿密蟲對環境變化有很強的適應力,且有較高的種群自然增長率,這是纖毛蟲病傳染迅速的原因。本研究從養殖場患病大菱鲆體表分離出盾纖毛蟲,經初步鑒定為貪食邁阿密蟲,之后對其進行了實驗室培養,研究不同培養液對其毒力的影響。結果顯示,在培養液篩選試驗中,改良L-15組貪食邁阿密蟲種群密度最高,且穩定期較長,衰退期較晚,因此判斷該培養液更適合于盾纖毛蟲的體外培養。本研究結果與高延奇等[10]的研究結果相似。推測其原因是L-15中含有無機鹽、氨基酸、維生素,而且氨基酸含量較高,高水平的氨基酸對體外培養纖毛蟲的生存和繁殖很重要。復壯后的毒力分析發現,L-15組培養的纖毛蟲死亡率最高,達到85.10%,而L-15組的感染時間較早,首尾魚死亡時間也最早,表明改良L-15組蟲體毒力更強。筆者推測,改良后的L-15中含有胎牛血清,這樣的環境條件模擬了盾纖毛蟲的寄生環境。這一結果與Paramá等[13]的研究結果相似。因此可以判斷,改良L-15培養液最符合貪食邁阿密蟲的寄生環境,BEV次之。
纖毛蟲病是我國大菱鲆、牙鲆養殖中普遍發生的1種疾病,而目前我國對海洋中有關致病性纖毛蟲原生動物個體及其實驗生態學的研究較薄弱,仍無特效防治方法[11]。在實驗室研究中,保持寄生蟲的種群自然增長率及寄生毒力是免疫診斷等試驗順利開展的前提,也是試驗數據科學準確的重要保障。本研究探討了實驗室常用的纖毛蟲培養液對纖毛蟲的生長及毒力的影響,為開展新型殺蟲物質研究和開發增強魚體自身免疫力的抗蟲藥物提供了安全、高效的蟲體培養方案。

