基于金屬有機骨架材料和酶切放大的適配體熒光法檢測副溶血性弧菌
馮潤嬋,袁 萍,譚樹良,毋福海,蘇政權,白 研,賀錦燦
(廣東藥科大學 公共衛生學院,廣東 廣州 510310)
副溶血性弧菌(Vibr io parah aemol yticus,V.P)是革蘭氏陰性菌,多存在于海水、海產品及鹽漬食品中[1]。誤食V.P污染的海產品容易導致胃腸道疾病[2],致病率甚至超過鼠傷寒沙門氏菌、大腸桿菌等食源性細菌[3]。由V.P引起的食物中毒事件越來越多,對食品質量安全和人體健康造成了極大威脅。目前,檢測V.P的方法主要有傳統平板培養法、雙層平板法、酶聯免疫法、PCR法、實時熒光PCR法、雙重PCR法、環介導等溫擴增法(LAMP)、納米材料輔助信號法等[4-9]。其中平板法操作復雜、耗時長,無法實現V.P的快速檢測[4-5];免疫法和PCR法操作不當易導致假陽性結果[6-7];LAMP法對技術人員的要求高[8]。基于納米材料的分析方法具有簡單、快速的優點,但靈敏度有限。因此,建立一種快速、靈敏的海產品中V.P的檢測方法具有重要意義。
納米材料與DNA酶放大技術結合可顯著提高納米分析方法的靈敏度。例如,Lu等[9]以納米石墨烯為熒光猝滅平臺,建立了一種核酸酶輔助信號放大法檢測三磷酸腺苷和可卡因的分析方法,檢出限比未放大的方法低3個數量級。金屬有機骨架材料(MOFs)[10]是一類由金屬離子(或簇)與有機配體連接而成的晶體結構的雜化材料,比表面積大,孔隙率高,在分離、催化、生物傳感等領域中具有重要應用[11]。特別地,MOFs可通過π-π作用和電荷作用吸附帶負電的單鏈DNA分子[12],且過渡金屬離子的開放位點以及有機配體的共軛π電子系統具有熒光猝滅性質,背景信號低,是理想的納米熒光猝滅材料。核酸適配體(Aptamer)[13]是對特定靶標具有特異性識別作用的短鏈DNA分子,具有特異性好和親和力高等特點,可以提高方法的選擇性[14-16]。核酸外切酶Ⅰ(ExoⅠ)[17]具有特異性好、敏感性高、操作簡單、反應條件簡單、無需依賴特定識別位點等優點,在信號放大[18]中起關鍵作用。
本文基于Cu-MOF的熒光猝滅性質,適配體的特異性和ExoⅠ的催化水解作用,建立了一種快速、靈敏檢測V.P的適配體熒光法。在室溫下合成Cu-MOF,研究其形貌、結構及熒光猝滅機理,通過優化Cu-MOF的體積、猝滅時間、ExoⅠ用量及恢復時間等分析條件,建立了快速檢測V.P的適配體熒光分析方法,并成功應用于實際水產品中V.P的檢測。
1 實驗部分
1.1 儀器與試劑
F-7000熒光分光光度計(日本日立有限公司);FA1204B電子分析天平(上海佑科儀器儀表有限公司);DF-101S磁力攪拌器(鞏義市予華儀器有限責任公司);H3-18K臺式高速離心機(河南可成儀器設備有限公司);YC-S30恒溫水浴鍋(天津市泰斯特儀器有限公司);LGJ-10C冷凍干燥機(北京四環科學儀器廠有限公司);Hitachi S-4800掃描電子顯微鏡(日本日立有限公司);SmartLab X射線衍射儀(日本理學有限公司);Zsizer Nano ZS90 zeta電位儀(英國馬爾文公司)。
均苯三甲酸(H3BCT)、醋酸銅(上海阿拉丁生化科技股份有限公司);V.P(ATCC17802)、沙門氏菌(S.A,ATCC14028)、單增李斯特菌(L.M,ATCC19115)、大腸桿菌(E.coli,ATCC25922)、TCBS瓊脂(廣東環凱微生物科技有限公司);熒光素標記的V.P核酸適配體(3′-FAM-TCTAAAAATGGGCAAA GAAACAGTGACTCGTTGAGATACTAAA-5′[19])購于生工生物工程(上海)股份有限公司;ExoⅠ(C610019,BBI生命科學有限公司);實驗用水為三次蒸餾水。
1.2 實驗方法
1.2.1細菌培養及計數將復蘇液(3%NaCl堿性蛋白胨水)加入到V.P凍干菌種中混勻,制成菌懸液,于36℃培養箱中培養24 h。用生理鹽水稀釋至不同濃度,參考國標測定菌落總數[20],用傾注平板法進行V.P計數,以濁度為橫坐標,濃度為縱坐標,得到標準曲線回歸方程。
1.2.2Cu-MOF的合成量取100 mL 20 mmol/L的H3BCT加入250 mL三頸燒瓶中,一邊攪拌一邊加入等體積、等濃度的醋酸銅溶液,攪拌30 min后轉移至15 mL離心管中,離心,用乙醇-水溶液(2∶8,體積比)洗滌兩次,通過凍干機獲得Cu-MOF藍色凍干粉末。
1.2.3分析方法向微量離心管中依次加入一定體積的Cu-MOF溶液(2.32 mg/mL)、熒光素FAM標記的適配體溶液,在渦旋器上振蕩混勻,避光猝滅一定時間;加入一定濃度的V.P菌懸液、適量ExoⅠ溶液和緩沖溶液,于37℃下孵育一段時間后,混合液置于熒光分光光度計中檢測。設置實驗組和對照組,每組平行3次。
1.2.4樣品處理與分析準確稱取25 g新鮮蝦肉、八爪魚,分別向其中加入225 mL 3%的NaCl堿性蛋白胨水,采用均質器混勻,離心[21],取上清液,按照“1.2.3”實驗方法進行測定。
2 結果與討論
2.1 分析原理
本研究的原理見圖1,Cu-MOF具有熒光猝滅性質及保護適配體不被ExoⅠ水解的作用,當熒光分子標記的核酸適配體吸附在Cu-MOF上,熒光被猝滅,加入V.P后,核酸適配體與V.P選擇性結合,脫離Cu-MOF表面,熒光得到一定程度的恢復。在ExoⅠ的催化作用下,脫離Cu-MOF表面的適配體被水解,釋放出V.P,V.P進一步結合其他吸附在Cu-MOF上的適配體,使水解反應循環進行,熒光信號進一步放大。在一定范圍內,V.P濃度與熒光恢復程度(ΔF)呈線性關系,據此建立MOFs材料和酶切放大的適配體熒光法。

圖1 方法的原理圖Fig.1 Schematic illustration of the method
2.2 Cu-MOF的表征
采用掃描電子顯微鏡(SEM)對Cu-MOF的外觀和尺寸進行掃描。如圖2A所示,Cu-MOF表面粗糙呈不規則多面體晶型結構,棱角較為分明,顆粒粒徑約為50~200 nm。采用X射線衍射儀(XRD)對Cu-MOF進行表征,得到的圖譜見圖2B。在11°左右出現特征衍射峰,與文獻報道相符[22],說明Cu-MOF具有較好的結晶度。
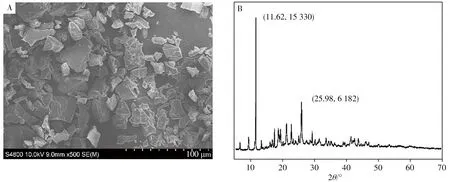
圖2 Cu-MOF的掃描電鏡圖(A)及粉末X射線衍射圖(B)Fig.2 Scanning electron microscope graph(A)and powder-XRD pattern(B)of Cu-MOF
2.3 熒光猝滅機理的考察
從圖3可以看到,修飾了FAM的適配體溶液在激發波長490 nm時,在522 nm處有一最大發射峰;加入Cu-MOF后,熒光被猝滅;引入V.P后,熒光發生一定程度的恢復;加入ExoⅠ后熒光恢復程度顯著增大。而加入銅鹽溶液或H3BCT溶液后,熒光被大幅度猝滅,引入V.P后,熒光基本不恢復。加入溶劑(乙醇-水,2∶8),熒光未被猝滅,由此推測熒光猝滅效果主要由Cu(Ⅱ)和H3BCT導致。其中Cu(Ⅱ)的d電子層存在空軌道,這種結構容易發生光誘導電子轉移(PET),引起熒光猝滅[12];而H3BCT和FAM分子由于都含有芳香環,存在n電子,二者共存時易發生n-n堆積效應,導致熒光共振能量轉移(FRET),從而引起熒光猝滅[13]。
此外,Cu-MOF的Zeta電位為+1.59 mV,適配體的Zeta電位為-2.31 mV,將Cu-MOF和適配體混合后,得到混合溶液的Zeta電位為-0.051 4 mV,說明適配體與Cu-MOF之間發生了靜電相互作用,因此推測靜電作用是引起熒光猝滅的另一個原因。
2.4 實驗條件的優化
2.4.1Cu-MOF體積的影響當Cu-MOF的用量不足時,熒光無法被完全猝滅,使體系的背景值過高,進而降低方法的靈敏度;而Cu-MOF用量過多時,則會阻礙V.P與其適配體的特異性結合。因此,考察了不同體積Cu-MOF(2.32 mg/mL)溶液對體系的熒光猝滅情況,結果如圖4A所示。當加入體積為90μL時,熒光猝滅效率最大(達到92%),繼續加入Cu-MOF未出現更大的猝滅效率。因此,后續實驗選擇90μL作為Cu-MOF的加入體積。
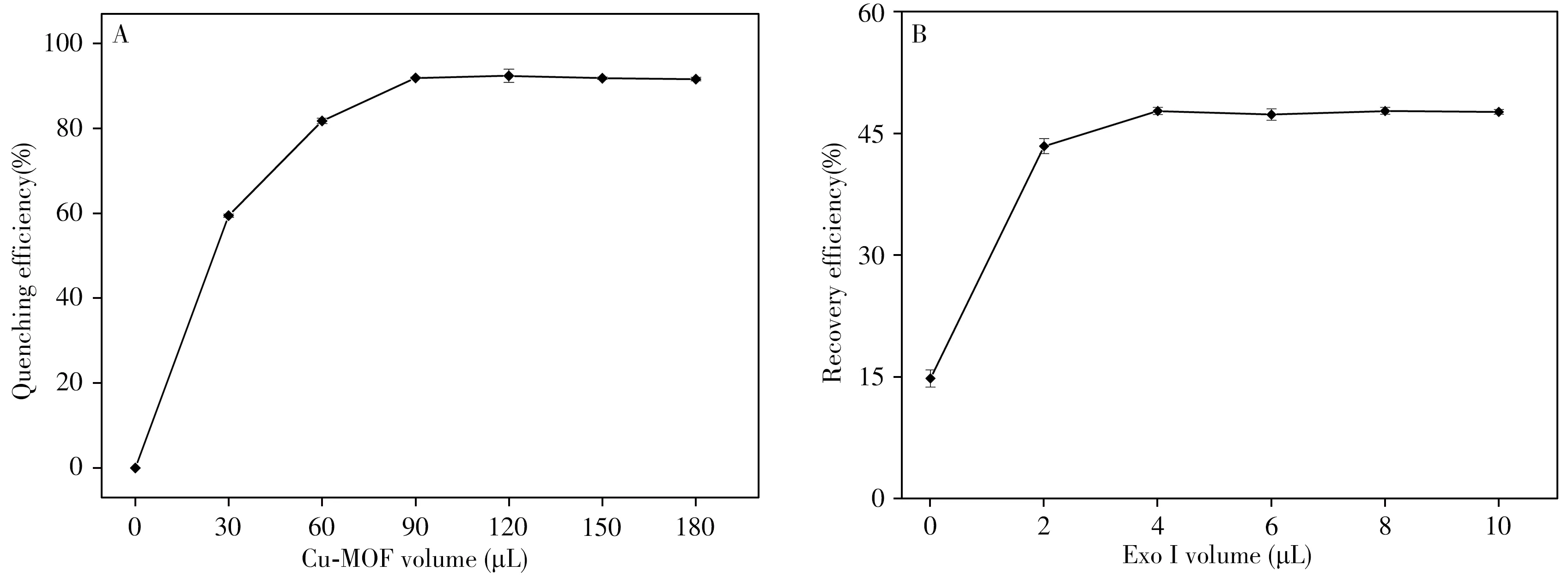
圖4 Cu-MOF體積對熒光猝滅效率的影響(A)及酶體積對熒光恢復效率的影響(B)Fig.4 Cu-MOF volume on effect of fluorescence quenching efficiency(A),and enzyme volume on effect of fluorescence recovery efficiency(B)
2.4.2猝滅時間的影響Cu-MOF與適配體結合需要一定的時間。若時間過短,Cu-MOF對適配體的吸附不充分,導致猝滅不充分,影響背景值;若時間過長,則Cu-MOF對適配體吸附過于牢固,后續加入V.P需更長時間脫附,不能滿足快速檢測的需求。本文考察了不同猝滅時間(0、10、20、30、40、50和60 min)對實驗結果的影響。結果顯示,當猝滅時間為10 min時,猝滅效率達到91%,隨著時間的延長,猝滅效率趨于穩定。因此,實驗選擇10 min作為猝滅時間。
2.4.3ExoⅠ體積的影響為了評估ExoⅠ輔助信號放大的效果,考察了ExoⅠ體積對熒光恢復的影響,結果如圖4B所示。當ExoⅠ的體積為0時,熒光恢復效率為15%,當ExoⅠ的體積為4μL時,熒光恢復效率達到48%。由此對比,后者的信號放大了3倍左右,且隨著體積增大,信號趨于穩定。因此,實驗選擇4μL ExoⅠ溶液作為最佳實驗條件。
2.4.4熒光恢復時間的影響V.P與適配體結合需要一定的時間。時間過短,結合不充分,將會影響方法的重現性;時間過長,ExoⅠ的酶切效率可能受影響。實驗考察了熒光恢復時間(10、20、30、40、50 min)的影響。結果顯示,當恢復時間為20 min時,熒光恢復效率最大且趨于穩定,30 min后熒光恢復程度下降。綜合考慮,選擇20 min作為恢復時間。
2.4.5加入順序的影響由于Cu-MOF的吸附性較強,可能對細菌產生一定的吸附作用而影響實驗結果,實驗通過篩選試劑的加入順序以降低吸附作用的影響。如圖5所示,加入或未加入ExoⅠ時,Cu-MOF+V.P+Aptamer的加入順序均比Cu-MOF+Aptamer+V.P的熒光恢復效率低,說明Cu-MOF對菌株具有一定的非特異性吸附作用,降低了體系的熒光恢復效率。值得注意的是,對于不同加入順序,存在ExoⅠ的體系均比不存在ExoⅠ時得到的熒光恢復效率高,且加入ExoⅠ后,兩種不同加入順序得到的熒光恢復效率的差值(ΔRE)由2.49%降至0.95%,說明ExoⅠ的引入不但放大了熒光信號,同時也降低了Cu-MOF對菌株的非特異性吸附造成的影響。因此,為了減少Cu-MOF對細菌的非特異性吸附,提高方法的靈敏度,實驗選擇Cu-MOF+V.P+Aptamer+ExoⅠ作為試劑的加入順序。
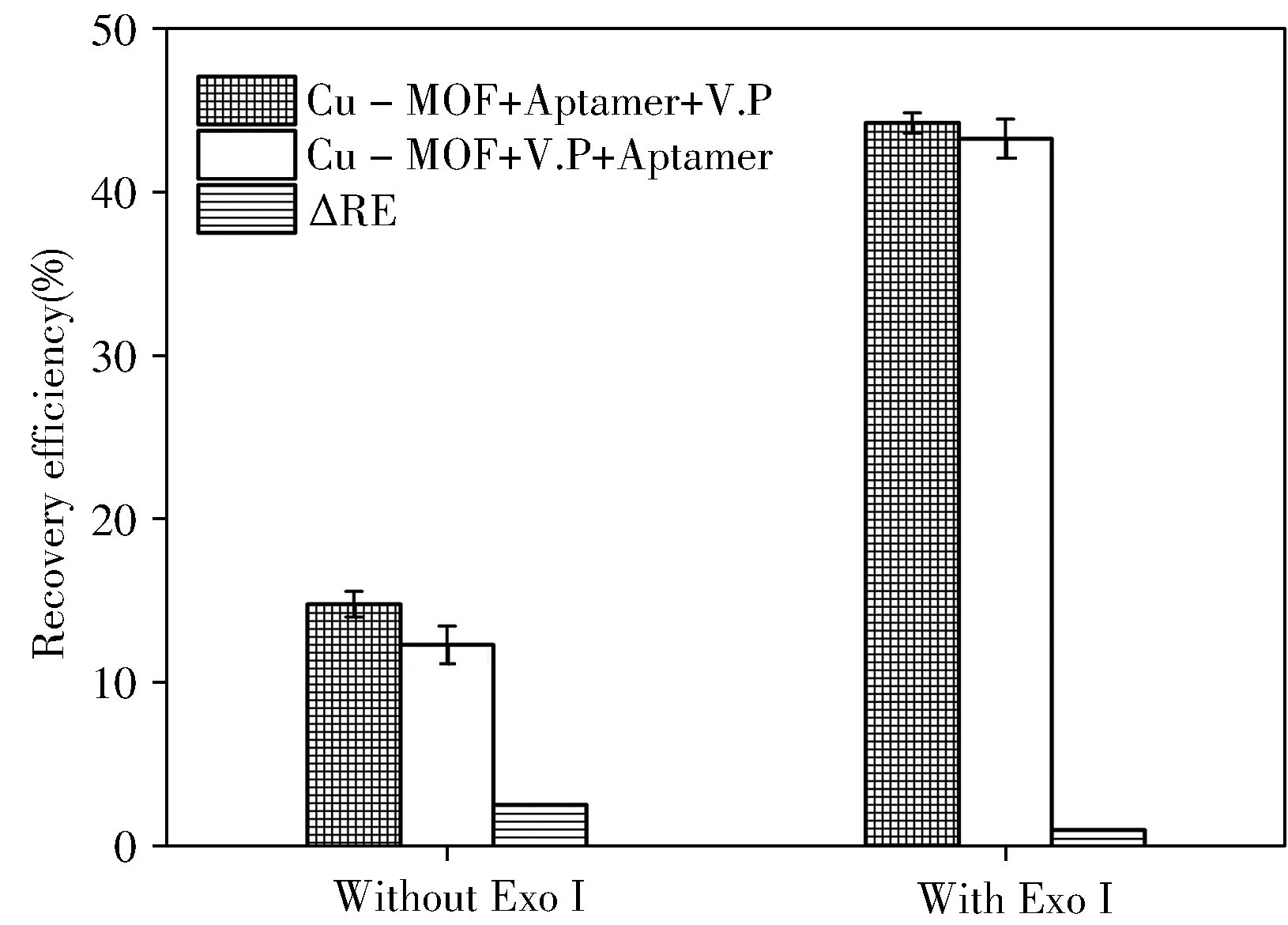
圖5 試劑加入順序的影響Fig.5 Effect of the agents’addition order on fluorescence recovery efficiency
2.5 線性范圍與檢出限
根據上述優化實驗條件,在該體系中加入不同濃度的V.P菌懸液,測定熒光強度。實驗結果顯示,在8.4×102~2.0×105CFU/mL濃度范圍內,V.P濃度的對數與熒光恢復程度(ΔF)呈良好線性關系,線性方程為ΔF=7.30lgc-19.58(r2=0.998 6),檢出限為37 CFU/mL。同時比較了不加ExoⅠ的非放大熒光法,得到的線性范圍為4.12×104~8.23×106CFU/mL,檢出限為1.0×104CFU/mL。說明ExoⅠ的加入拓寬了方法的線性范圍,降低了檢出限。
2.6 方法的選擇性
在優化條件下,用濃度均為105CFU/mL的V.P、沙門氏菌(S.A)、李斯特菌(L.M)、大腸桿菌(E.coli)進行實驗,結果如圖6所示,只有加入V.P體系的熒光恢復程度最大,加入其他3種細菌熒光基本不能恢復,說明該方法對V.P具有高選擇性。
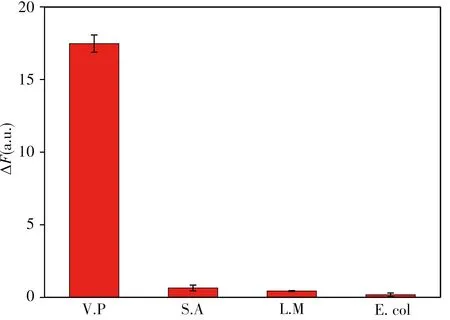
圖6 不同細菌加入該體系后的熒光恢復情況Fig.6 The value of fluorescence recoveries after adding different bacterias in the system
2.7 實際樣品的分析
在優化條件下,將該方法用于蝦肉和八爪魚樣品中V.P的分析。結果顯示,蝦肉和八爪魚樣品均未檢出V.P。分別加入6.79×104、6.79×105、6.79×106CFU/mg V.P進行回收率實驗,測得加標回收率為88.8%~109%,相對標準偏差(RSD)為3.7%~6.6%(見表1),說明該方法的準確度和精密度較好。
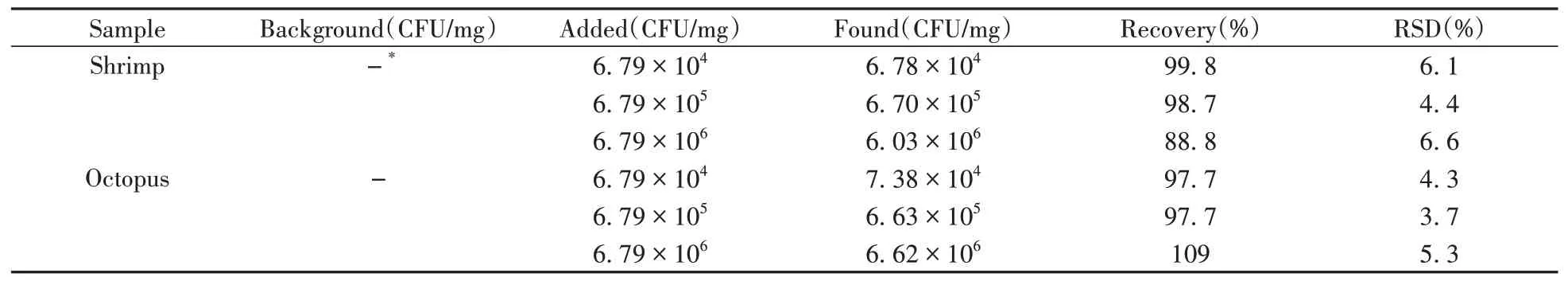
表1 蝦、八爪魚樣品中V.P的加標回收實驗Table 1 Spiked recoveries of V.P in shrimp meat and octopus samples
3 結 論
本文建立了一種基于Cu-MOF和酶切放大的適配體熒光法。在8.4×102~2.0×105CFU/mL濃度范圍內,V.P濃度的對數(lgc)與熒光恢復程度(ΔF)呈良好線性關系,線性方程為ΔF=7.30lgc-19.58(r2=0.998 6),檢出限為37 CFU/mL,整個分析過程不超過30 min。將方法應用于蝦、八爪魚樣品的檢測,加標回收率為88.8%~109%,RSD為3.7%~6.6%。該方法具有檢測速度快、線性范圍寬、靈敏度高、選擇性好等優點,對實際食品樣品中V.P的分析具有一定潛力。

