天然生物材料在組織工程化血管構建中的作用及研究進展
陳國寶,楊 歡,周江一,田吉迅,鄧雅心
(重慶理工大學 藥學與生物工程學院, 重慶 400054)
如今,心血管疾病成為發達國家中主要的死亡原因之一[1],中國的心血管疾病患病率也是常年居高不下。據統計推算表明,中國現存心血管疾病人數已達到3.3億人,每5例死亡人數中有2例死于心血管病[2]。心血管疾病的高死亡率原因與其引起的一系列并發癥以及不良反應有關,表現在感染病毒風險的提高以及意外事故,如劇烈運動而導致猝死的機率增大[3]。心血管糖積聚導致的動脈粥樣硬化則是主要的心血管疾病之一[4],除了通過施加藥物改善血管內膜血栓的凝結的狀況外,血管的修復與置換也成為當今流行的解決方案。
目前,針對心血管疾病的主要治療策略是對外周動脈瘤進行插管處理,對頸動脈進行支架搭橋手術處理,從而改善局部動脈血管的堵塞情況[5],而搭橋支架手術的關鍵在于血管創傷處的組織血管化建立。其中用于搭橋的支架生物相容性就成為關鍵點。異種血管移植的方法無論是在短期的相容性或者長期的力學性能上都不能滿足天然血管的要求[6]。同樣,通過人工合成的高分子聚合物以及金屬支架也無法有效地解決血管支架降解和相容性問題,而通過組織工程學原理構建的含有天然生物材料的復合支架為解決這一難題提供了可能。
組織工程學是通過將細胞生物學和材料學相結合,從而開發出恢復、修護、改善組織功能的生物替代物的新興學科[7]。通過這種策略制備的支架材料具有良好的自組織能力,能形成結構和功能都與天然組織相似的生物組織,使受損組織或器官重獲新生。其中,天然生物材料具有良好的生物相容性、可降解性、低免疫原性以及快速誘導血管新生而展現出巨大的臨床應用潛能。
目前,用于心血管支架的天然生物材料主要分為細胞外基質衍生物類生物材料、蛋白質類生物材料與多糖類生物材料等。其中,蛋白質類生物材料包括膠原、絲素蛋白、角蛋白等,多糖類生物材料包括殼聚糖、纖維素、海藻酸鹽等。不同類別的天然組織在力學性能、化學性能和生物學性能等方面均存在較大的差異,如何利用各類天然生物材料的特性研制出優良的支架材料成為組織工程的關鍵。
本文綜述了近幾年天然生物材料在血管組織工程中的研究進展,包括對各類生物材料的特點與優勢、局限性及應用等進行了總結與討論,并展望了天然生物材料在血管組織工程的應用前景。
1 脫細胞血管基質來源類生物材料
組織工程中血管網絡的構建需要經歷漫長的時間,目前已經出現了許多模仿天然細胞外基質(extracellular matrix,ECM)結構和成分的方法以促進血管生成。但內皮細胞很難從合成的ECM中出芽形成新的血管。脫細胞基質是將來源于各種物種的組織/器官通過物理、化學、酶等方法進行細胞分離并消除免疫原后保留得到的細胞外基質。脫細胞基質不僅能為細胞提供結構支持,還能提供各種生化信號,從而促進細胞黏附、增殖和分化等[8]。由于不同基質的結構和組成各不相同,來源于不同組織/器官中的脫細胞基質具有誘導向特定組織重塑的潛力[9]。因此,脫細胞血管以及脫細胞血管基質復合支架已成為促進血管再生的理想材料,如圖1所示。
1.1 脫細胞血管
脫細胞血管具有與天然血管相似的順應性,以承受血壓的變化,并且包含了大量促血管生成因子,可直接作為移植物用于血管修復[10]。血管組織的力學性能很大程度上來自高度保守的ECM蛋白,Dahl等[11]制備出了在體外培養的豬主動脈脫細胞基質支架,從此開啟了脫細胞血管基質支架的大門。在大直徑(>8 mm)和中等直徑(6~8 mm)動脈制造中,人工聚合物合成血管可作為有效的血管替代物,而在小直徑(<6 mm)動脈中,人工聚合物血管替代物的通暢率較低,且較容易發生血栓或增生等現象,使其應用受到了限制[12]。相較于人工聚合物血管替代物,ECM衍生類生物材料擁有巨大優勢。在結構蛋白的空間結構保留相對完整的同時[13-14],脫細胞血管基質還能提供細胞組織間的信息通訊,促進細胞黏附、增殖、遷移與分化[15]。另外,脫細胞血管基質支架可以通過調節基質中含有的膠原、彈性蛋白含量,從而改善較為欠缺的力學性能[16]。不僅如此,通過靈長類動物實驗結果看出,在長達6個月的脫細胞血管基質支架移植實驗后,支架的直徑和長度未發生明顯變化,表明脫細胞基質血管替代物擁有良好的耐用性[17]。另外,Syedain等[18]的實驗表明,脫細胞血管基質支架在植入年輕受體體內后,可能具有生長的能力,在植入脫細胞血管基質支架的幼羊模型的一年隨訪結果中顯示,最初植入的脫細胞血管支架經歷了真正的軀體生長,而不是簡單地機械擴張。
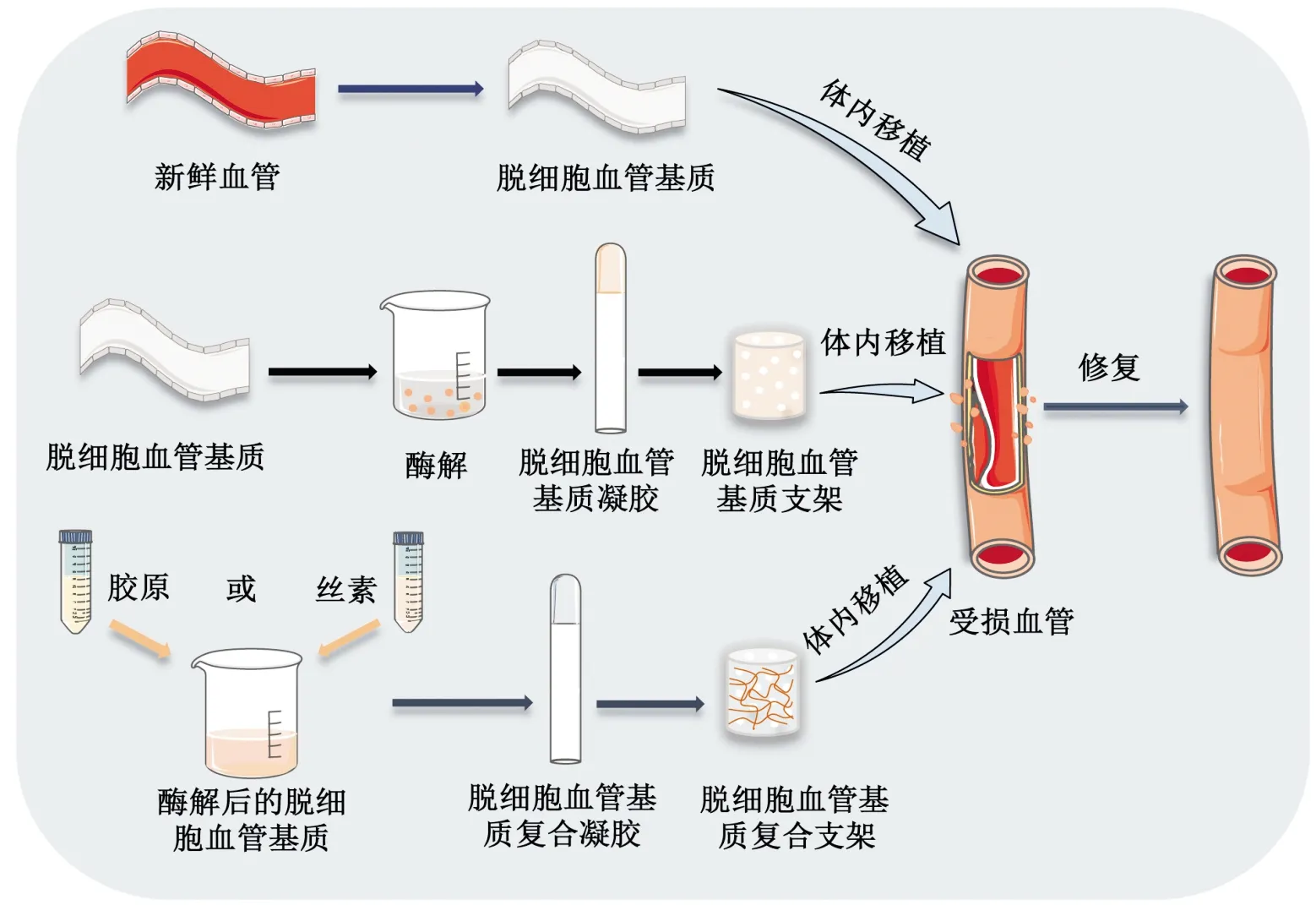
圖1 用于血管組織工程的脫細胞血管基質來源類生物材料
1.2 脫細胞血管基質復合支架
脫細胞血管雖然在生物相容性及誘導血管再生方面具有天然的優勢,但是僅把脫細胞血管作為移植物限制了其在臨床上對不規則組織修復的應用。通過酶解的方法將脫細胞血管水解成凝膠后,不但能擴大其使用范圍,而且脫細胞血管基質中促血管生成能力也得到一定程度的保留[19]。由于酶解后會對結構蛋白造成破壞,導致脫細胞血管基質凝膠的力學性能無法與組織相匹配。將其他材料與脫細胞血管基質共混成為了最簡易的改善其力學性能的方式。天然高分子材料,如絲素蛋白與脫細胞血管基質凝膠共混后,制備得到的支架能有效地提高整體的力學性能。與純絲素支架相比,共混支架在植入大鼠皮下4周后形成了極為豐富的血管網絡[20]。將膠原與脫細胞血管基質共混形成凝膠,不但彌補了脫細胞血管基質中流失的膠原成分,同時改善了它的生物力學強度,并且該復合凝膠通過調節間充質干細胞的旁分泌作用加速了受損腎臟中血管網絡的形成,從而誘導腎臟再生[21]。總之,脫細胞血管凝膠在組織工程血管化方面具有巨大的應用前景。
雖然高分子材料具有理想的機械強度和生物力學性能,但仍然存在與種子細胞的生物相容性不佳、降解產物會影響種子細胞的生物學特性和工程化組織的形成等關鍵問題[22]。相比之下,以ECM為主的脫細胞血管基質及其復合支架為種子細胞提供了超微結構的三維培養空間,提高了種子細胞的生物相容性、黏附、增殖和遷移能力,成為構建組織工程血管的理想支架材料。
2 蛋白質類生物材料
蛋白質作為生命體最重要的物質基礎,廣泛存在于自然界中。相比于人工合成的聚合物材料,蛋白質類生物材料具有良好的生物相容性與生物降解性等優點,所以被廣泛應用于包括制備組織工程血管支架在內的各個研究領域中。目前組織工程化血管支架的制備常用的蛋白質類生物材料包括膠原、角蛋白、彈性蛋白、纖維蛋白、明膠、蛋清及絲素蛋白等,如圖2所示。

圖2 用于組織工程血管的蛋白質類生物材料
2.1 膠原
膠原蛋白是人體及動物ECM中一種非常重要的結構蛋白,是構成血管、皮膚和韌帶等身體部分的主要組織成分。近年來,因其具有弱的抗原性、良好的生物相容性、無細胞毒性、高可降解性以及促進細胞生長等優點,所以在組織工程血管支架研究領域中應用較為廣泛。
研究表明,由小腸粘膜下層獲得的膠原可在體外成功參與血管支架的制作,并且在血管支架的制備過程中,利用膠原蛋白作為機械支撐,可成功克服彈性蛋白等生物材料極限拉伸強度較低的缺點[23-24]。對于膠原類血管的力學性能,Zhou等[25]進行了深入測試,利用細胞外基質成分膠原、肝素和透明質酸通過交聯技術共同構建雙層血管導管,對交聯后的導管在干燥情況下的最大拉伸強度及最大斷裂伸長率與濕態情況下平均抗拉強度與斷裂伸長率進行測試記錄,數據顯示該雙層血管導管在干燥情況下與在濕態情況下的斷裂伸長率分別為84.88%、72.05%,濕態情況下的斷裂伸長率仍達到真實血管的最低標準,說明該膠原類血管支架具有良好的力學性能。但膠原易導致血栓形成,所以在血管支架制備方面,其應用受到了一定的限制[26]。后續研究發現,可以在膠原支架進行體外研究實驗時,對其進行有效的表面涂層或者預先植入一種具有活性的細胞,達到減少該類膠原支架在體內退化引起血管疾病及發生血栓可能性的目的[27]。
2.2 角蛋白
角蛋白是構成生皮表皮、毛皮毛囊的主要蛋白質。角蛋白生物材料具有良好的生物可降解性、生物相容性及無免疫原性,是一種有效的天然生物材料[28]。目前,角蛋白基材料常被用于制造微針、藥物輸送、傷口敷料以及血管支架等。角蛋白作為一種結構蛋白,含有大量的二硫化物,具有較好的機械強度和還原反應性。角蛋白中豐富的二硫鍵可被谷胱甘肽(Glutathione,GSH)還原成半胱氨酸殘基,然后長期催化亞硝基谷胱甘肽(Nitrosoglutathione,GSNO)的內源性供體產生一氧化氮,產生的一氧化氮在加速血管重構中發揮了關鍵作用。有研究采用靜電紡絲法制備含有角蛋白的聚己內酯(Polycaprolactone,PCL)血管支架,研究結果表明:PCL/角蛋白支架能夠成功催化GSNO釋放NO,可促進人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)增殖的同時抑制人臍動脈平滑肌細胞(human umbilical artery smooth muscle cells,HUASMCs)增殖,從而達到促進血管重構的目的[29]。此外,磺化角蛋白-PCL納米纖維支架被證明能夠促進內皮細胞的生長,同時抑制平滑肌細胞的增殖并降低血小板的黏附[30]。這一研究結果證實磺化的角蛋白能夠改善角蛋白的凝血功能,進一步提高在血管組織工程中的應用前景。
2.3 彈性蛋白
彈性蛋白是彈性纖維的主要成分,其可賦予所在組織器官良好的彈力及抗張能力,且具有良好的生物相容性,在生物材料領域得到了廣泛的應用。
彈性是彈性蛋白的最重要物理化學性質,在天然膠原蛋白支架中添加適當的彈性成分,能夠使支架的整體性能得到改善。對脫細胞肌腱切片衍生的天然膠原支架進行研究發現,當膠原蛋白支架與不同濃度的彈性蛋白交聯時,支架的彈性得到了顯著改善[16]。評估不同濃度彈性蛋白對膠原蛋白支架力學性能的影響,并根據結果選擇合適的彈性蛋白濃度進行進一步分析發現,在膠原蛋白支架中添加適宜濃度的彈性蛋白后,支架的延展性和楊氏模量發生明顯的變化,構件在最大載荷時的楊氏模量和拉伸應力顯著降低,并且在最大載荷時的拉伸應變得到一定程度上的增加。此外,研究表明,彈性蛋白也能夠使血管的順應性增強。動脈壁含有豐富的彈性蛋白,有儲存彈性能量及高應變等特性,可以確保血流暢通[31]。由可溶性彈性蛋白和膠原復合制成的支架具有孔隙率和表面積,適合小直徑移植物的制作。不溶性彈性蛋白的應變恢復率高于膠原蛋白。研究表明,在膠原凝膠中加入彈性蛋白可以增強內皮細胞的增殖能力,同時顯著抑制動脈平滑肌細胞的增殖[19]。綜上,可見彈性蛋白是一種極具潛力的、用于血管組織工程的支架材料。
2.4 纖維蛋白
纖維蛋白為凝血酶作用于纖維蛋白原而成的產物,不僅具有良好的生物相容性、生物可降解性及無毒性等優點,而且能促進血管生成與組織修復,因此被廣泛應用于組織工程血管支架材料的制備[32]。
在纖維蛋白類材料血管支架的理想型探究方面,Pankajakshan等[32]釆用溶劑澆鑄的方法制備出了一種新型的纖維蛋白類血管支架。將內皮細胞與該類支架材料進行復合培養,2 h后觀察到內皮細胞附著于支架表面,24 h后觀察到附著的內皮細胞明顯擴散,15 d后,支架表面出現一層連續的內皮細胞單層,30 d時,支架上具有較大表面積內皮細胞層,此時能較為清楚地觀察到內皮細胞層遷移到孔表面且細胞邊界清晰,該研究說明該纖維蛋白類支架材料極有可能成為一種較為理想的人工血管支架材料。為避免血管植入體內發生異物反應,研究表明,事先由從患者血液中獲得纖維蛋白從而制成支架,同時種植自體來源的細胞,可有效避免異物植入帶來的排斥反應[33]。目前用于心血管組織工程中的可生物降解腳支架常表現出有毒降解和炎癥反應,Ye等[34]通過把纖維蛋白凝膠作為可降解三維支架進行組織工程血管研究發現,細胞在該類支架上生長情況良好,無炎性反應且產生無毒性降解產物,進一步證實了纖維蛋白類支架材料在組織工程血管制備中的潛在可行性[26]。
但是,纖維蛋白類材料血管缺乏較好的機械性能和穩定性,其應用在一定程度上受到了限制[27]。因此,纖維蛋白支架材料如何提高機械性能及穩定性是未來的研究重點之一。
2.5 明膠
明膠是膠原變性的產物,沒有固定的結構和相對分子量,屬于一種大分子的親水膠體,具有良好的生物相容性和生物可降解性,其降解產物易被吸收且不產生炎癥反應,被廣泛應用于臨床醫學研究中。
支架能否實現自身的“血管化”是組織工程血管能否成功應用于生物體內最重要的一項指標[26]。Frerich等[35]以明膠作為血管支架,以脈動灌流培養內皮細胞,16 d后,觀察到內皮細胞在支架上的黏附性良好,支架內出現廣泛的“毛細血管”網狀結構,并且部分毛細血管樣網絡高度連通。此研究說明以明膠作為組織工程血管支架材料能夠解決支架腔內或壁內細胞的營養及氧氣供給問題。
明膠的內在機械強度較低,所以現在大多作為制備復合支架的材料,可以在明膠中加入明膠甲基丙烯酰可以增加交聯度,從而提高機械性能。明膠的另一個缺點是它的溶解性,在37 ℃或以上溫度條件下會以膠體溶膠的形式溶解,在較低溫度下(室溫)形成凝膠,這個缺點限制了它的長期移植應用。相關研究表明,用低毒的京尼平交聯明膠納米纖維墊可以顯著提高其楊氏模量和斷裂應力分別至990 MPa和21 MPa[36]。此外,使用血管壁間充質干細胞進行初步體外復合發現細胞在明膠支架上具有良好的細胞活力及粘附性[36]。所以,可以通過對明膠的交聯增強其穩定性,進一步延長明膠的降解時間,同時達到增強明膠耐水性的目的。
2.6 蛋清
蛋清指蛋內的半透明液體,因其有天然無毒、生物相容性好、無明顯炎癥反應、可利用性強、成本低廉、來源豐富等特點,被廣泛用于生物材料。不同蛋白有著不同的功能,如卵清蛋白在刺激細胞增殖方面具有一定優勢[37],卵巨球蛋白在抑制炎癥、促進細胞增殖和遷移方面具有一定的優勢等[38],蛋清也是一種制備血管支架材料的可用材料[39]。
天然血管主要由內膜、中層和外膜3層構成。呈單層結構的血管不能滿足組織工程血管移植物應用的要求。采用靜電紡絲和同軸3D打印相結合的方法制備3層血管支架(triple-layered vascular scaffold,TVS),即聚己內酯-膠原(polycaprolactone-collagen,PCL-Col)通過靜電紡絲法制備TVS的內層,使用蛋清參與TVS中間層的形成[40]。但由于蛋清很難保持其生物活性,而海藻酸鈉在鈣離子的催化下可以迅速形成凝膠,所以,混合是生產更完整的生物材料的有效方法之一。通過同軸3D打印和交聯機制擠出蛋清/海藻酸鈉(egg white/sodium alginate,EW/SA)共混水凝膠,形成中空纖維,沿圓周方向纏繞內層表面,作為TVS的中間層。最后,將靜電紡絲PCL-Col納米纖維包裹在水凝膠層表面作為TVS的外層。所制備的TVS與天然血管相比,極限拉應力、斷裂應變等機械性能均與天然血管相近。此外,通過HUVECs對TVS的生物相容性進行的研究表明,細胞能夠成功附著在移植物表面,并保持較高的存活率[40]。蛋清參與制備得到的新型3層血管支架具有適當的力學性能和良好的生物學性能,在組織工程血管移植中具有非常大的應用潛力。
2.7 絲素蛋白
絲素蛋白是從蠶絲中提取的一種天然高分子纖維蛋白,因其具有良好的生物相容性、穩定的化學性能及機械性能等優點,所以在組織工程中可為各種類型的細胞提供理想的支架,在血管組織工程支架的制備方面應用尤為廣泛[41]。
Suzuki等[42]以家蠶和野生柞蠶的蠶繭為原料,采用脫膠法分離出絲素蛋白,測量結果表明絲素蛋白具有較強的機械力學性能。Marcolin等[43]將電紡絲素管狀基質良好的生物相容性及力學性能與明膠優異的細胞相互作用特性相結合,成功制備出一種絲素類復合管狀材料,對該材料進行拉伸等力學測試,結果顯示所制備出的絲素類復合管狀材料的柔順性及粘彈性等機械性能均與天然血管相當,此結果證實絲素類復合管狀材料可用作小口徑血管支架材料。也有相關研究表明,由純的絲素溶液進行靜電紡絲得到的纖維機械強度均比原始絲的機械性能有所降低,不能達到人工血管等材料的強度要求。將絲素蛋白分別與PCL和聚二惡烷酮共混進行靜電紡絲,可使得到的絲素蛋白纖維紡絲抗斷強度及延展性能等有明顯的改善[44-45],該研究說明將絲素蛋白與其他高聚物共紡,可以提高血管假體的機械強度。但絲素蛋白在體內的降解速度也將成為一個問題,Horan等[46]通過體外酶類實驗表明絲素蛋白會在一個相對較長的時間內緩慢降解,可以為組織生成提供足夠的時間,但降解速度緩慢容易導致宿主反應,這將影響絲素蛋白在血管組織工程領域的進一步發展。
3 多糖類生物材料
天然多糖類物質作為一類資源豐富、易于獲得的天然高分子生物材料,因其具有優秀的生物相容性和良好的生物可降解性,且分、降解產物對人體安全無害的特性,所以在生物材料領域應用廣泛,包括制備組織工程血管支架。目前組織工程化血管支架的制備常用的多糖類生物材料包括殼聚糖、細菌纖維素、海藻酸鹽以及透明質酸等,如圖3所示。
3.1 殼聚糖
殼聚糖又稱脫乙酰甲殼素,具有優秀的生物相容性、生物降解性、無毒性與抗菌性。作為一種組織工程的支架材料,因其具有易形成多孔結構、易于修飾及體內大分子親和力高等特點,在血管支架材料研究方面應用廣泛。

圖3 用于組織工程血管支架的多糖類生物材料
在制備小孔徑血管方面,殼聚糖與PCL通過靜電紡絲法復合制成的血管支架具有類似天然ECM微/納米結構的多孔結構,這樣的結構利于細胞的黏附及生長[47]。同時,殼聚糖也可與細菌納米纖維素中復合,從而制成力學性能和生物相容性都有明顯提升的復合血管支架[48]。在制備大孔徑血管方面,其與明膠復合制備的大孔水凝膠復合支架能夠很好地模擬血管的性能,支架具有的雙層結構也能夠很好地促使細胞黏附增殖[49]。因此,殼聚糖在組織工程血管支架制備的應用中有很大的可能性。未來,在探究殼聚糖的復合運用等方面勢必將成為研究熱點。
3.2 細菌纖維素
細菌纖維素是在不同條件下,由醋酸菌屬、土壤桿菌屬、根瘤菌屬和八疊球菌屬等微生物合成的纖維素的統稱。因其具有無毒、細纖維網絡、高純度、良好的抗拉性能及可塑性特點,在血管支架材料運用中具有巨大潛力[50]。
Malm等[51]為探究細菌纖維的實用可能性,在綿羊頸動脈中植入由細菌纖維素制成的小口徑血管支架,結果發現血管支架保持了長達13個月的通暢期,同時也無血栓形成的跡象,這表明細菌纖維素具備作為血管支架材料的潛力。但植入早期血管閉塞率過高、細胞內皮化不足等問題仍待解決。周霄楠[52]對細菌纖維素管狀材料制備與表面改性方法進行了優化,將其在體外預先進行內皮化,減少了體內血栓形成與內皮增生的問題,而后將REDV多肽修飾在細菌纖維素表面,增加了材料表面內皮化的能力。
3.3 海藻酸鹽
產自藻類的海藻酸不溶于水,但其鹽溶液溶于水后遇鈣離子易形成凝膠,這種材料的穩定性、粘性、安全性使之擁有成為血管支架材料的可能性。王薇等[53]使用以滌綸編織管為增強基的海藻酸鈣/聚丙烯酰胺水凝膠血管材料擁有低溶脹率、良好力學性能等特性,且經過長時間浸泡,這些性能均未出現明顯變化。這種血管支架材料的形態、溶脹性、力學性能等方面雖符合臨床要求,但因以滌綸為基,所以在生物相容性及降解性能等方面需要進一步研究。
Ruther等[54]將海藻酸二醛明膠生物墨水通過3D打印的方法制備出血管支架,體外細胞實驗發現這種支架不會對成纖維細胞與內皮細胞造成損害,具有良好的細胞相容性。此外,通過構建具有不同孔徑大小的蜂窩狀海藻酸鹽血管支架并在其表面用纖連蛋白固定,隨后涂有基質膠。接種內皮細胞到這種支架上后可以穩定的生長且可以承受生理水平的流體剪切力的刺激并保持支架完整[55]。這些研究表明:海藻酸鹽支架為建立持久的血管生成模塊提供了合適的基質,可以用于增強器官的血運重建。
3.4 透明質酸
透明質酸作為一種酸性多糖,自從其從牛眼玻璃體中提取出來后,因其天然可降解且降解產物可以被機體吸收的特性在臨床上用途廣泛。而高分子透明質酸能夠誘導體內血管生成,降解而成的低分子透明質酸也具有促進血管生成的作用[56],因而透明質酸擁有作為組織工程血管支架材料的可能性。孫秀娟等[57]將類人膠原蛋白與透明質酸混合經過真空凍干制作出的血管支架材料擁有良好的孔隙率(>90%),經細胞毒性實驗、細胞種植實驗、皮下植入實驗得到透明質酸的組織相容性、細胞相容性、生物降解性良好的結論。此外,使用高速旋轉收集器用PCL制備了排列良好的納米纖維支架,并用透明質酸修飾了這些表面,研究支架在體外對內皮細胞行為的協同作用[58]。體外細胞實驗發現透明質酸涂層排列的PCL納米纖維支架可以高度促進附著并引導HUVECs與平行排列的納米纖維雙極擴散。此外,支架上的HUVECs形成了匯合的單內皮細胞層,并表現出血管性血友病因子(von Willebrand factor,vWF)較高的蛋白質表達水平[58]。這一研究表明:排列整齊的納米結構聯合透明質酸更能促進用于血管組織工程的功能性內皮的再生。
4 結論
天然生物材料在組織工程血管支架的構建中扮演著重要角色,不僅是在生物相容性、信息通訊、藥物傳送、生物降解方面表現良好,更是在支架機械特性方面擁有先天優勢,這使得天然生物材料在治療心血管疾病中的運用越發廣泛,其優缺點如表1所示。近些年來,關于天然生物材料的研究發展迅速,在臨床試驗中也表現出良好的運用前景,越來越多的生物支架研究者開始把目光投向天然生物材料的復合運用。

表1 用于組織工程化血管構建的常見天然生物材料的優缺點
盡管天然生物材料在力學性能、組織相容性等方面表現出色,但由于在移植后期容易誘發血栓形成,是導致試驗失敗的原因[59],所以目前還沒有成功的人造小口徑血管支架移植試驗案例。如何解決支架移植時炎癥的發生、降低移植后期血栓發生機率、掌握支架降解速率、減少移植物周圍組織血管化等問題仍需要進一步研究。此外,取自實驗動物的天然生物材料更需要注意個體之間的不同性與多變性等不可預見的問題[60]。只有在充分了解各類天然生物材料的特性,掌握有效的制備方法后,才能設計出擁有良好的各項指標的組織工程支架。
未來,隨著組織工程學進一步發展,天然生物材料在再生醫學的運用將愈來愈多,研究開發具有生物活性的組織工程材料將勢必成為熱點。因此,由生物學與臨床醫學共同支撐的再生醫學將會大步邁進。設計出具有細胞親和性、力學性能良好、抑制血栓及新生內膜增生等特點的血管支架,不僅能推動學術科研的大前進,更能促進醫藥產業的發展,為人類健康事業服務。

