miR-579-3p/DEFA3調控膿毒血癥的炎癥反應及靶向關系驗證
楊 燕 劉德智 付 云 高尚蘭(新鄉市中心醫院,新鄉醫學院第四臨床學院重癥醫學科二區,新鄉 453003)
膿毒血癥、膿毒血癥休克綜合征是當今醫學的難點問題。每年約有3 000 萬新發病例,600 萬人病死,該病的治療選擇非常有限[1-2]。microRNA(miRNA)可以更好地診斷膿毒血癥,并有助于診斷、治療措施[3]。miR-579-3p 雖在膿毒血癥中出現異常,但其具體的功能及機制尚未十分清楚[4]。編碼人中性粒細胞肽1-3(human neutrophilic peptide 1-3,HNP1-3)的α 防御素1-3(alpha-defensin 1-3,DEFA1/DEFA3)基因在膿毒血癥中出現基因異常上調,并且與膿毒血癥患者的病情惡化和生存有關[5-6]。本研究旨在探討miR-579-3p、DEFA3 在膿毒血癥中的功能及相互作用關系。
1 材料與方法
1.1 材料 100只6周齡雌性C57BL/6小鼠,體質量(13±2)g,購自南京大學模式動物研究所;過表達miR-579-3p 轉基因小鼠、敲減DEFA1/DEFA3 轉基因小鼠均購自賽業(廣州)生物科技有限公司;血漿miRNA 提取試劑盒購自北京百奧萊博生物公司;血漿蛋白提取試劑盒購自上海康朗生物科技有限公司;小鼠TNF-α檢測試劑盒、IL-8檢測試劑盒購自南京森貝伽生物公司;IL-6檢測試劑盒購自武漢賽培生物科技有限公司;半胱氨酸天冬氨酸酶1(Caspase-1)活性檢測試劑盒購自Biovision;末端標記法(TUNEL)染色試劑盒購自北京博爾邁生物技術有限公司;雙熒光素酶報告基因檢測試劑盒購自上海碧云天生物公司。
1.2 方法
1.2.1 膿毒血癥小鼠模型的建立 參照趙喆等[7]在研究中使用的盲腸結扎法建立膿毒血癥小鼠模型。
1.2.2 實驗分組 實驗共分為5組,每組20只小鼠,分別為Blank組、Control組、Model組、miR-579-3p組、si-DEFA3組。各組的處理方法為:Blank組不做任何處理,正常飼養;Control組做同樣的操作,不結扎盲腸;miR-579-3p 組為將過表達miR-579-3p 的轉基因小鼠進行盲腸結扎操作,si-DEFA3 組為將敲減DEFA3的轉基因小鼠進行盲腸結扎操作。
1.2.3 ELISA 實驗檢測小鼠血清中TNF-α、IL-8 和IL-6 的水平 眼眶靜脈采血法采集小鼠的血液,2 000 g 離心15 min 收集血清。用小鼠TNF-α 檢測試劑盒、小鼠IL-8檢測試劑盒、小鼠IL-6檢測試劑盒分別檢測血清中TNF-α、IL-8和IL-6的含量。
1.2.4 流式細胞術檢測內皮細胞焦亡 按照張鑫紅等[8]的方法分離和培養Blank組、Control組、Model組、miR-579-3p組、si-DEFA3組小鼠的肺血管內皮細胞。具體步驟為:在無菌條件下剪取肺組織接種到細胞培養皿,不加培養基,待組織塊貼壁后加入DMEM 完全培養基。48 h 后肺血管內皮細胞開始生長,72 h 后,取出組織塊,1 d 更換1 次培養液,至第8 天。以后開始正常培養2 d 更換1 次培養液。用Caspase-1 活性檢測試劑盒和TUNEL 染色試劑盒檢測Caspase-1陽性和PI陽性的細胞,流式細胞術檢測雙陽性的細胞。將雙重染色細胞的百分比作為焦亡細胞的百分比。
1.2.5 qRT-PCR 檢測小鼠血漿中miR-579-3p 的表達 將小鼠血漿用血漿miRNA 提取試劑盒提取miRNA,并將其逆轉錄成cDNA,-80℃保存備用。用qRT-PCR 檢測cDNA 中miR-579-3p 的表達,結果以U6 為內參,2-ΔΔCt法計算相對表達。所用引物為:miR-579-3p(5'-3'),正向引物CGTGCCGTTCATTTGGTATAAAC,反向引物CGTGCCGTTCATTTGGTATAAAC;U6(5'-3'),正向引物CTCGCTTCGGCAGCACA,反向引物AACGCTTCACGAATTTGCGT。
1.2.6 Western blot檢測小鼠血漿中DEFA3蛋白表達 將小鼠血漿用血漿蛋白提取試劑盒提取總蛋白,進行BCA 定量后,沸水煮沸10 min 變性處理。取上清液用于蛋白電泳檢測,將凝膠上的蛋白用轉膜儀轉移至PVDF 膜上。將膜2%脫脂奶粉封閉后,一抗(1∶1 000)4℃孵育過夜。取出膜,在室溫下二抗(1∶500)孵育2 h。最后用ECL電化學發光試劑盒對膜進行顯影曝光,再用Quantity One 4.62 軟件分析條帶的灰度。
1.2.7 生物信息學分析 通過生物信息在線預測網站Starbase(http://starbase.sysu.edu.cn)預測miR-579-3p的潛在靶基因。
1.2.8 雙熒光素酶報告基因檢測實驗驗證miR-579-3p 與DEFA3 的結合 首先構建野生型(DEFA3 WT)和突變型(DEFA3 MUT)的DEFA 3'UTR 載體。操作時需要把純化的質粒克隆至psiCHECK2 載體,成功構建熒光載體psiCHECK2-DEFA3 WT 和psiCHECK2-DEFA3 MUT。選用培養48 h 的293T 細胞,用2倍量的脂質體法將熒光載體質粒與miR-NC、miR-579-3p、anti-miR-NC、anti-miR-579-3p 共轉染至該細胞。最后按照雙熒光素酶報告基因檢測試劑盒操作手冊要求操作,結果分析中,熒光活性的變化以海腎熒光素酶活性與螢光蟲熒光素酶活性的比值表示。
1.3 統計學分析 使用醫學統計專用軟件PEMS3.2 進行所有數據的統計分析,醫學繪圖軟件Graph-Pad Prism 7 對數據進行相關圖片繪制。計量資料用表示,多組間數據比較采用單因素方差分析SNK-q檢驗,兩組比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 膿毒血癥小鼠模型的炎癥因子表達 ELISA實驗檢測小鼠血清中炎癥因子TNF-α、IL-8 和IL-6的含量,流式細胞術檢測肺血管內皮細胞的焦亡。結果如表1所示,與對照組相比,模型組小鼠血清中TNF-α、IL-8、IL-6的含量均明顯上調,內皮細胞焦亡率明顯升高(P<0.05)。
表1 膿毒血癥小鼠模型中炎癥因子的表達(,n=20)Tab.1 Expressions of inflammatory factors in sepsis mouse model(,n=20)
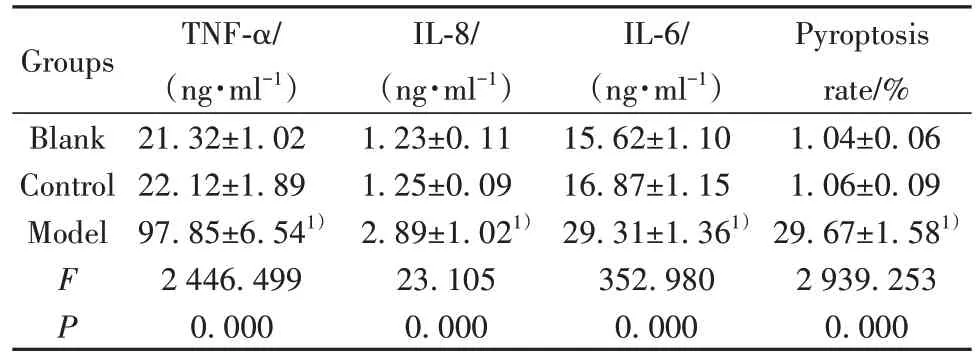
表1 膿毒血癥小鼠模型中炎癥因子的表達(,n=20)Tab.1 Expressions of inflammatory factors in sepsis mouse model(,n=20)
Note:Compared with control group,1)P<0.05.
2.2 miR-579-3p、DEFA3 在膿毒血癥小鼠血漿中的表達 結果如圖1 和表2 所示,與對照組相比,模型組小鼠血漿中miR-579-3p 的mRNA 表達顯著升高,DEFA3蛋白表達顯著升高(P<0.05)。

圖1 DEFA3的蛋白表達Fig.1 Protein expression of DEFA3
表2 膿毒血癥小鼠血漿中miR-579-3p、DEFA3 的表達(,n=20)Tab.2 Expressions of miR-579-3p and DEFA3 in plasma of sepsis mice(,n=20)
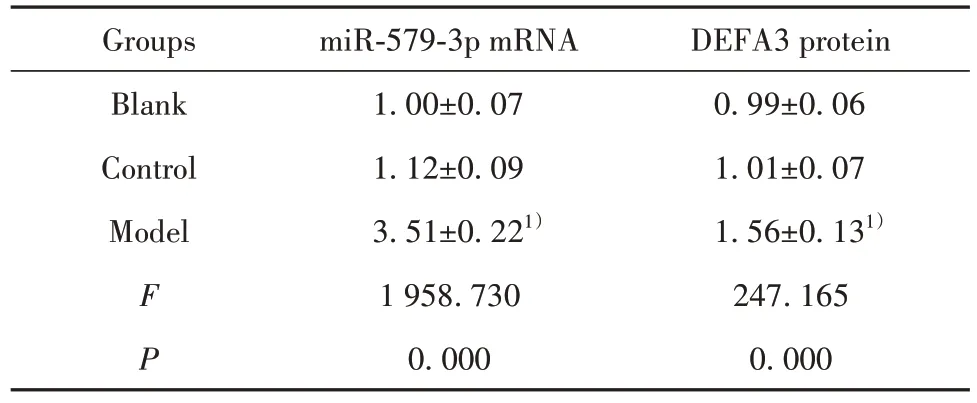
表2 膿毒血癥小鼠血漿中miR-579-3p、DEFA3 的表達(,n=20)Tab.2 Expressions of miR-579-3p and DEFA3 in plasma of sepsis mice(,n=20)
Note:Compared with control group,1)P<0.05.
2.3 過表達miR-579-3p 的轉基因膿毒血癥小鼠血清炎癥因子表達和內皮細胞焦亡 結果如表3 所示,與模型組相比,miR-579-3p 組小鼠血清中miR-579-3p mRNA 表達顯著升高,TNF-α、IL-8、IL-6 的含量均明顯降低,內皮細胞焦亡率明顯降低(P<0.05)。
表3 過表達miR-579-3p的轉基因膿毒血癥小鼠血清炎癥因子表達和內皮細胞焦亡(,n=20)Tab.3 Overexpression of serum inflammatory factors and endothelial pyroptosis in transgenic sepsis mice with miR-579-3p(,n=20)
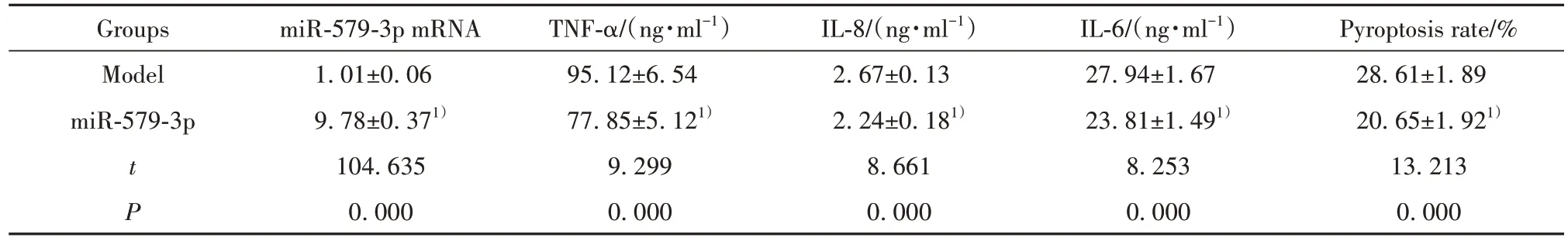
表3 過表達miR-579-3p的轉基因膿毒血癥小鼠血清炎癥因子表達和內皮細胞焦亡(,n=20)Tab.3 Overexpression of serum inflammatory factors and endothelial pyroptosis in transgenic sepsis mice with miR-579-3p(,n=20)
Note:Compared with model group,1)P<0.05.
2.4 敲減DEFA3的轉基因膿毒血癥小鼠血清炎癥因子表達和內皮細胞焦亡 結果如圖2 和表4 所示,與模型組相比,si-DEFA3 組小鼠血漿中DEFA3蛋白表達顯著降低,血清中TNF-α、IL-8、IL-6的含量均明顯降低,內皮細胞焦亡率明顯降低(P<0.05)。
表4 敲減DEFA3的轉基因膿毒血癥小鼠血清炎癥因子表達和內皮細胞焦亡(,n=20)Tab.4 Reduced serum inflammatory factors and endothelial pyroptosis in DEFA3 transgenic sepsis mice(,n=20)
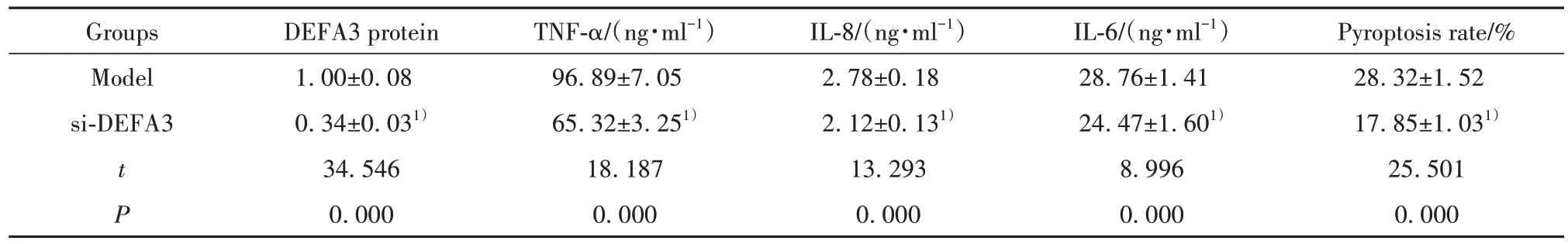
表4 敲減DEFA3的轉基因膿毒血癥小鼠血清炎癥因子表達和內皮細胞焦亡(,n=20)Tab.4 Reduced serum inflammatory factors and endothelial pyroptosis in DEFA3 transgenic sepsis mice(,n=20)
Note:Compared with model group,1)P<0.05.

圖2 敲減DEFA3 的轉基因膿毒血癥小鼠的DEFA3 蛋白表達Fig.2 Protein expression of DEFA3 in DEFA3 transgenic sepsis mice
2.5 miR-579-3p 靶向DEFA3 通過在線預測網站Starbase(http://starbase.sysu.edu.cn)預測到miR-579-3p與DEFA3之間存在靶向結合位點(圖3)。與miR-NC 組相比,miR-579-3p 組DEFA3 WT 的293T細胞熒光活性顯著降低,與anti-miR-NC 組相比,anti-miR-579-3p 組DEFA3 WT 的293T 細胞熒光活性顯著升高。見表5。
表5 miR-579-3p結合DEFA3(,n=20)Tab.5 miR-579-3p binding to DEFA3(,n=20)
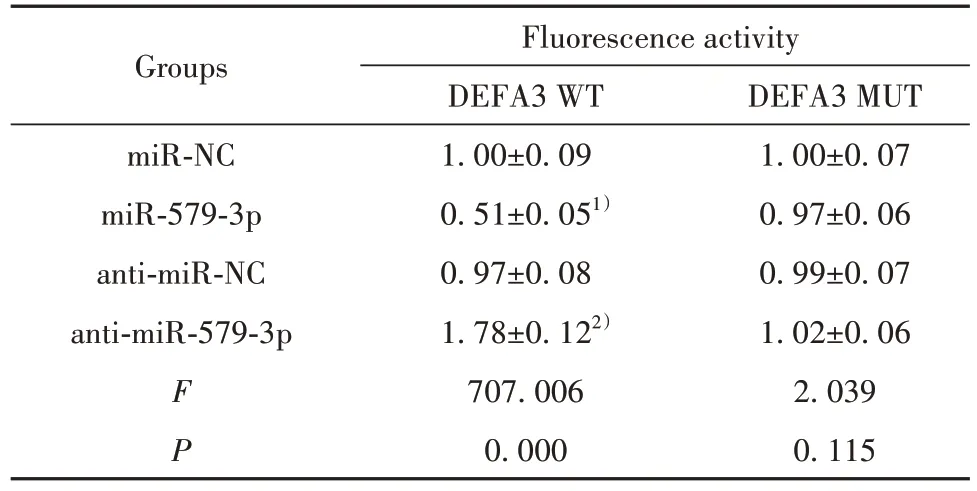
表5 miR-579-3p結合DEFA3(,n=20)Tab.5 miR-579-3p binding to DEFA3(,n=20)
Note:Compared with miR-NC group,1)P<0.05;compared with antimiR-NC group,2)P<0.05.
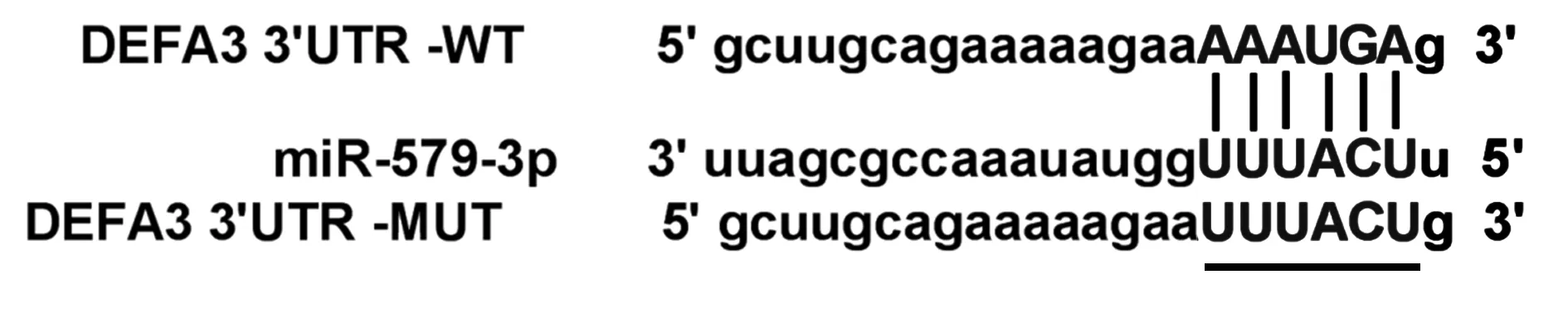
圖3 miR-579-3p直接調控DEFA3表達Fig.3 miR-579-3p directly regulates expression of DEFA3
3 討論
膿毒血癥的初始階段涉及促炎細胞因子的過度分泌,這會導致嚴重的機體損傷[9]。microRNA 在膿毒血癥過程中可以調節炎癥細胞因子的產生,也可調節膿毒血癥中的血管屏障和內皮功能[10]。EI 等[11]研究發現,在膿毒血癥小鼠中miR-579 的表達異常升高,并且在脂多糖誘導的耐受細胞中表達也發生明顯升高,miR-579 可靶向TNF-α,這說明該miRNA 在膿毒血癥中具有積極的治療作用。楊培雄等[12]發現,TNF-α 在膿毒血癥老年患者血清中表達異常升高,并且與患者病情的嚴重程度呈正相關。猜測miR-579-3p 在膿毒血癥中具有積極的治療作用。為了驗證此猜測,本研究建立了膿毒血癥小鼠模型和過表達miR-579-3p 的轉基因膿毒血癥小鼠模型,檢測其中miR-579-3p 表達,發現miR-579-3p 在膿毒血癥模型小鼠血漿中表達異常升高,而在過表達miR-579-3p 轉基因膿毒血癥小鼠血漿中的表達水平更高,這說明miR-579-3p 在膿毒血癥小鼠中的表達異常升高;在膿毒血癥小鼠血清中炎癥因子TNF-α、IL-8、IL-6的表達水平均升高,內皮細胞的焦亡率也發生明顯升高,而在過表達miR-579-3p的轉基因膿毒血癥小鼠中TNF-α、IL-8、IL-6 的表達降低,內皮細胞的焦亡率也顯著降低,這說明miR-579-3p 在膿毒血癥小鼠中具有積極治療作用。進一步通過生物信息學和雙熒光素酶報告基因檢測實驗,發現miR-579-3p可靶向調控DEFA3。
膿毒血癥期間各種體液(血液、支氣管肺泡灌洗液和痰液)中HNP1-3 的水平大大增加,并且編碼HNP1-3 基因的DEFA1/DEFA3 存在大量變異,明顯影響膿毒血癥患者的臨床表型,且DEFA1/DEFA3基因升高的中國漢族患者更容易發生嚴重的膿毒血癥[13-14]。CHEN等[15]在研究中報道,具有較高表達DEFA1/DEFA3基因的小鼠比具有較低表達DEFA1/DEFA3 的小鼠或野生型小鼠具有更嚴重的敗血癥相關的器官損傷和高病死率。從機制上講,嗜中性粒細胞肽1 通過嘌呤受體(P2X7)介導的典型半胱氨酸天冬氨酸酶1活化以炎癥小體依賴性方式誘導內皮細胞焦亡。CHEN等[14]研究發現,DEFA1/DEFA3是參與嚴重膿毒血癥宿主免疫應答的重要基因組分。DEFA1/DEFA3 表達升高與嚴重膿毒血癥風險顯著相關。本研究檢測了膿毒血癥模型小鼠、敲減DEFA1/DEFA3 轉基因膿毒血癥小鼠血漿中DEFA3基因的表達,發現DEFA3在膿毒血癥小鼠中表達異常升高,而在敲減DEFA1/DEFA3 轉基因膿毒血癥小鼠中表達降低,并且敲減DEFA1/DEFA3 后,小鼠血清中炎癥因子TNF-α、IL-8、IL-6的表達降低,內皮細胞焦亡率顯著降低,這說明敲減DEFA1/DEFA3基因對膿毒血癥患者的治療具有重要指導價值。miR-579-3p 和DEFA3 在膿毒血癥小鼠模型中的表達均為異常上調,但是二者在膿毒血癥中發揮的作用卻不同。miR-579-3p 發揮抑制膿毒血癥患者的炎癥反應,而DEFA3則發生相反的作用。
綜上所述,miR-579-3p 在膿毒血癥小鼠中具有抗炎、抗焦亡的作用,其機制與靶向DEFA3 基因相關,本研究為膿毒血癥的治療提供新方向。

