雷公藤多苷致大鼠精子畸形初步研究*
陳小均 賈玉森 張志杰 張延江 張偉濤
(北京中醫藥大學東方醫院,北京 100078)
男性不育為男科臨床常見疾病,畸形精子癥為男性不育的常見類型。精子形態是影響受孕的重要參數,并對精子活力產生影響,與精子DNA的完整性有關,還可以影響到精卵結合[1-2]。畸形精子癥的病因復雜,影響因素較多,發病機理不清[3],亟待研究解釋其發病機制。在精子形態方面,實驗動物和人類差別較大。雷公藤(Tripterygiumwilfordii)多苷模型為男性不育癥常用模型[4],大鼠為研究男性不育癥常用實驗動物,但針對大鼠的精子形態分析的報道較少。因此本研究對實驗中的雷公藤多苷模型大鼠精子形態變化進行觀察,描述該模型大鼠精子異常形態,以期對畸形精子癥的研究提供參考。
1 材料和方法
1.1 材料
SPF級雄性SD大鼠30只,體質量200~250 g(6周齡),購自北京維通利華實驗動物技術有限公司,實驗動物生產許可證號: SCXK(京)2016-0011。雷公藤多苷片,規格10 mg,購自遠大醫藥黃石飛云制藥有限公司。精子形態染色Diff-Quick試劑,購自深圳華康生物醫學工程有限公司。實驗已通過北京中醫藥大學東方醫院福利倫理委員會審查,編號:201813。
1.2 實驗方法
SD大鼠適應性飼喂1周后,隨機分為三組,4周組、8周組和對照組,每組10只。對照組正常飼喂, 予生理鹽水劑量為10 mL/kg灌胃,1次/d;4周組和8周組劑量為30 mg/kg,新鮮配制雷公藤多苷混懸液灌胃,1次/d,分別持續4周及8周。大鼠自由進食、飲水,隔日更換籠中的木屑墊料以保持清潔。環境溫度:20~25 ℃,相對濕度:40%~70%,晝夜光照:12 h/12 h。實驗自開始之日起,大鼠每周稱體質量1 次,觀察記錄體形、毛色、步態、覓食、活動情況、有無死亡及其可能的原因。在給藥4周及8周后,分別取4周組和8周組共10只大鼠進行形態學檢測。
1.3 大鼠精子形態分析
大鼠末次給藥24 h后處死,迅速剪開腹腔,仔細完整地分離睪丸、附睪及輸精管,用眼科剪沿附睪縱軸剪一刀使其分為大致均勻的兩半,然后沿橫軸剪兩刀使附睪分為大致均勻的6段,將剪碎的附睪組織移入預置常溫孵育緩沖液1 mL 的試管中,然后用1 mL 孵育緩沖液沖洗培養皿,沖洗液移入裝附睪的試管中。分離輸精管,于輸精管與附睪尾結合部、輸精管與前列腺結合部剪切離斷輸精管。用胰島素注射針抽取孵育緩沖液1 mL,沿輸精管一側斷端將針頭插入輸精管管腔內,輕推注射器,可見另一側斷端流出1~2 滴乳白或灰白色液體,內含大量精子,將所得液體滴入裝附睪的試管中并置于37 ℃恒溫孵育箱中孵育30 min,進行精子形態學分析。
根據試劑盒說明書進行快速染色法(Diff-Quik),檢測精子形態。步驟簡述如下:在玻片上標記樣本信息,取10 μL精液加在玻片邊緣,推片,空氣干燥;放入固定液中15 s,瀝干;染色(快速染色液1、10 s和快速染色液2、5 s),流水沖洗10~15次,空氣干燥玻片;用10×100 亮視野油鏡檢查染色后的涂片,進行精子形態分析。
1.4 統計方法
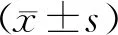
2 結果
2.1 大鼠正常精子形態
在光鏡下,大鼠的精子形態與人的精子不同,大鼠精子頭部彎曲、呈鐮刀型、表面光滑、頂體和頂體后區分界欠清晰、頭頸部連接于腹側、頸部細長、中段粗細一致、主段較長、逐漸變細及無成角彎折(圖1)。
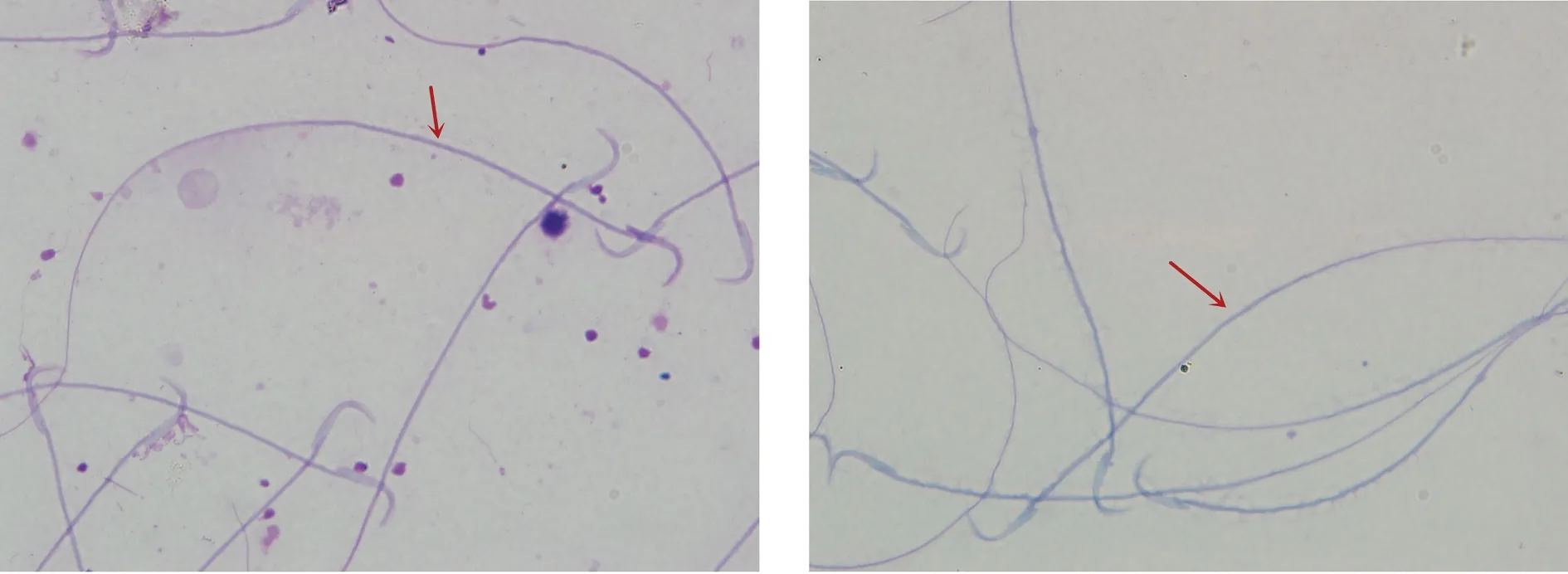
圖1 大鼠正常形態精子(×100)
2.2 大鼠異常形態描述
無鉤、頭部折疊、小頭、無尾、頸部斷裂、無頭、尾部卷曲及斷尾,其中無頭及無尾畸形為常見類型(圖2)。
圖2 大鼠異常精子形態(×100)
2.3 三組大鼠精子形態異常率比較
三組大鼠精子形態異常率比較結果,F=83.00,P=0.00<0.01,差異極顯著。進一步多重比較發現,空白組大鼠精子異常率很低,大多數精子形態均正常;雷公藤多苷灌胃4周后,大鼠精子畸形率升高,與空白組比較,P=0.00<0.01,差異極顯著;8周后畸形率進一步升高,與空白組及4周組比較,P=0.00<0.001,差異極顯著。

表1 大鼠精子形態異常率比較
3 討論
在對不育癥實驗研究的文獻中,少有對畸形精子的專門實驗研究報告[5],多見于對少弱精、生精障礙[6]、男性不育的病因學[7]等的實驗研究。其中最常用的模型是雷公藤多苷模型和奧硝唑模型。藥理學研究發現,奧硝唑對附睪中精子的作用,主要是干擾精子成熟和運動所必需的糖酵解酶,使精子獲取能量過程受阻,從而降低精子的活率與活力[8-9],而雷公藤多苷既作用于大鼠睪丸曲細精管中各級生精細胞, 又作用于附睪中的精子[10],其作用于精子發生的整個過程,影響生精功能和精子發育形態,長期給藥損傷可加重且長時間無法恢復[11]。故而在對精子形態的實驗研究中采用雷公藤多苷造模更為合適。
雷公藤多苷的生殖毒理研究表明,其生殖毒性呈時間和劑量依賴性,10~30 mg均可導致生殖細胞損傷,但低劑量需要的時間相對較長。對精子形態的影響方面,文獻報道不一,25 mg和30 mg均有報道[5]。本研究采用30 mg的偏大劑量造模,觀察精子形態變化。在大鼠精子染色方面,文獻中有選擇HE染色法[12-13]、伊紅染色法[14-16]、伊紅/苯胺黑染色法[17-18]、瑞-吉氏染色法[19]等,其中使用最多的是伊紅染色及伊紅/苯胺黑染色。人精子形態染色常用的染色方法有改良巴氏染色法、瑞吉氏染色法、Shorr 染色法和Diff-Quik 染色法。石亮等[20]對上述4種染色法比較發現,上述4種染色方法檢測形態正常精子率、頭部畸形精子率和頂體完整精子率,差異均不顯著(P>0.05)。但根據盛慧強等[21]報道,Diff-Quik 染色法可將精子頂體區染為淡紫色、核區為紫藍色和中段及主段為淡紅色,為一種簡單且快速的染色方法,與經典的改良巴氏染色法在精子形態評估中無顯著差異。因此,本研究采用Diff-Quik 染色法對大鼠精子染色,并發現大鼠的精子形態與人的精子差別較大,總結如下:(1)大鼠精子形態正常率很高,異常率低,而人精子形態異常率高,正常率低;(2)大鼠精子頭部形狀不同于人精子的橢圓形,為彎曲狀、呈鐮刀型,表面光滑,頂體和頂體后區分界不是很清,大鼠精子頭部明顯小于人精子頭部;(3)在光鏡下,大鼠精子頸部為非對稱性插入于頭部,頭頸部連接于腹側,頸部細長,中段粗細一致;(4)大鼠精子主段明顯比人精子長,無成角彎折。上述大鼠精子形態描述和楊燕平等[22]在電鏡下觀察到的大鼠精子形態類似。研究發現Diff-Quik 染色大鼠精子,圖片背景相對干凈,大鼠精子密度較高,直接涂片染色,易出現精子重疊,影響觀察,建議稀釋后染色;大鼠精子頭頂體和頂體后區分界不清,可能為大鼠精子頭部較小有關;大鼠精子較長,光鏡下閱片,每個視野中完整的精子數偏少,影響讀片速度;應用此染色方法,染色后保存時間較短,需要盡快完成讀片,隨著時間延長,存在褪色,影響讀片。
在大鼠精子異常形態類型方面,郭健敏等[11]研究雷公藤多苷對雄性SD大鼠生殖系統損傷,發現精子畸形主要有斷頭、圓頭、折疊和頭部不定型;柳建明等[23]用奧硝唑灌胃大鼠造模弱精子癥大鼠,發現精子表現為無鉤、胖頭、斷頭、雙尾、尾部折疊及斷尾等畸形;熊芬等[24]報道奧硝唑高劑量組還可見大片頭部缺失或頂體不完整的精子;孫華明等[25]觀察低功率微波對大鼠精子的影響,發現大鼠精子表現為不定形、胖頭、香蕉頭、無勾、雙頭(多頭)、雙尾(多尾)和尾折疊的形態異常;Khalil等[26]證明,暴露于“四溴二苯醚”的大鼠可出現無尾、無頭、尾部彎曲、短尾、主段變細、細胞質殘留等異常形態。本研究發現的雷公藤多苷造模大鼠精子形態異常類型和上述文獻報道類似,與人的精子異常類型相似,但未觀察到雙頭、雙尾、細胞質殘留等異常類型,而這些文獻中對大鼠精子形態異常類型多為文字描述,罕見有詳細圖示。
大鼠精子異常率方面,吳國琳等[27]用雷公藤多苷劑量為25 mg/kg灌胃,30 d后比較大鼠精子形態異常率結果如下:正常組(6.73±2.28)%,模型組(25.63±7.35)%。張才田等[28]用雷公藤多苷劑量為16 mg/kg灌胃,發現2周后精子畸形率上升(1.2±1) vs (11±1),P<0.05;4周和6周后畸形率升高更顯著,P<0.001,證實雷公藤多苷對大鼠精子具有抑制作用。本研究采用30 mg/kg雷公藤多苷灌胃,4周后精子形態異常率明顯升高,8周后可見到更為明顯的異常率,和徐穎等[29]報道的雷公藤多苷的生殖毒性表現為時間依賴性一致。
綜上,畸形精子癥為不育癥的常見類型,但目前無畸形精子癥的實驗動物模型報道,并且罕有描述大鼠精子異常形態類型的圖片,不利于畸形精子癥的研究。本研究采用雷公藤多苷30 mg/kg灌胃大鼠,研究其對大鼠精子形態的影響,發現其可使大鼠精子出現頭部、中段及主段的各種畸形,這和人的精子異常類型相似,且精子畸形率較空白組明顯增加。雖采用奧硝唑灌胃造模大鼠后,發現亦能造成大鼠精子畸形率增高[23],但采用奧硝唑灌胃后,精子畸形率無明顯變化[30],而雷公藤多苷和奧硝唑誘導的大鼠動物模型的病理機制存在著顯著差異[31]。在大鼠精子形態染色方面,研究發現Diff-Quik 染色法對大鼠精子染色效果良好,可以作為一種實用的大鼠精子染色方法。大鼠精子和人精子差別較大,本研究對大鼠精子的異常類型進行了描述及圖片展示,對大鼠精子和人精子的區別進行了詳細描述,為相關研究提供參照及依據。因此,雷公藤多苷灌胃大鼠,可成功建立畸形精子癥大鼠模型,且精子畸形類型和人的精子畸形類似。本研究所建立的大鼠模型較為穩定,并且可選擇時間及劑量更為靈活,可以作為畸形精子癥動物模型。
僅采用雷公藤多苷單一劑量,并且只在光學顯微鏡下觀察,未進行多劑量研究及電鏡下大鼠精子形態分析,存在不足。在接下來的研究中,將進行雷公藤多苷多劑量研究,找到最適的雷公藤多苷畸形精子癥大鼠模型的劑量及成模時間,以便于相關實驗研究。

