LncRNA-H9靶向miR-45-5p通過JAK2/STAT3調(diào)節(jié)大鼠腦血管平滑肌細胞增殖和遷移
龔翠蘭 楊仁義 傅馨瑩 周德生



〔摘要〕 目的 探討LncRNA-H19靶向miR-145-5p通過JAK2/STAT3信號通路調(diào)節(jié)TNF-α誘導大鼠腦血管平滑肌細胞(vascular smooth muscle cell, VSMC)增殖和遷移。方法 培養(yǎng)VSMC,對照組的細胞正常培養(yǎng),TNF-α組的細胞用100 ng/mL TNF-α處理;將si-NC、si-H19、miR-NC、miR-145-5p mimics轉(zhuǎn)染至TNF-α誘導的VSMC,分別記為TNF-α+si-NC組、TNF-α+si-H19組、TNF-α+miR-NC組、TNF-α+miR-145-5p組;將si-H19和anti-miR-NC、si-H19和anti-miR-145-5p共轉(zhuǎn)染至TNF-α誘導的VSMC,記為TNF-α+si-H19+anti-miR-NC組、TNF-α+si-H19+anti-miR-145-5p組。RT-qPCR法檢測LncRNA-H19和miR-145-5p表達水平;MTT法檢測細胞增殖能力;Transwell法檢測細胞遷移能力;熒光素酶報告實驗檢測LncRNA-H19和miR-145-5p的靶向關(guān)系;Western blot法檢測細胞周期蛋白D1(Cyclin D1)、p21、基質(zhì)金屬蛋白酶2(matrix metallo proteinase 2, MMP-2)、基質(zhì)金屬蛋白酶9(matrix metallo proteinase 9, MMP-9)、磷酸化JAK2(phosphorylated JAK2, p-JAK2)、磷酸化STAT3(phosphorylated STAT3,p-STAT3)蛋白表達水平。結(jié)果 與對照組比較,LncRNA-H19在TNF-α組中的表達水平顯著升高,miR-145-5p在TNF-α組中的表達水平顯著降低(P<0.01)。與TNF-α+si-NC組比較,TNF-α+si-H19組H19表達水平顯著降低,OD值、Cyclin D1、細胞遷移數(shù)、MMP-2及MMP-9蛋白表達水平顯著降低,P21蛋白表達水平顯著升高(P<0.01)。與TNF-α+miR-NC組比較,TNF-α+miR-145-5p組miR-145-5p表達水平顯著降低,OD值、Cyclin D1、細胞遷移數(shù)、MMP-2及MMP-9蛋白表達水平顯著降低,P21蛋白表達水平顯著升高(P<0.01)。與TNF-α+si-H19+anti-miR-NC組比較,TNF-α+si-H19+anti-miR-145-5p組OD值、Cyclin D1、細胞遷移數(shù)、MMP-2及MMP-9蛋白表達水平顯著升高,P21蛋白表達水平顯著降低(P<0.05)。與TNF-α+si-NC組比較,TNF-α+si-H19組p-JAK2、p-STAT3蛋白表達水平顯著降低(P<0.05);與TNF-α+si-H19+anti-miR-NC組比較,TNF-α+si-H19+anti-miR-145-5p組p-JAK2、p-STAT3蛋白表達水平顯著升高(P<0.05)。結(jié)論 干擾LncRNA-H19表達、上調(diào)miR-145-5p表達可抑制TNF-α組的VSMC增殖和遷移,其與阻斷JAK2/STAT3信號通路的磷酸化有關(guān)。
〔關(guān)鍵詞〕 LncRNA-H19;miR-145-5p;JAK2/STAT3信號通路;TNF-α;血管平滑肌細胞;增殖;遷移
〔中圖分類號〕R285.5? ? ? ?〔文獻標志碼〕A? ? ? ? 〔文章編號〕doi:10.3969/j.issn.1674-070X.2022.03.005
〔Abstract〕 Objective To investigate the LncRNA-H19 targeting miR-145-5p through JAK2/STAT3 signaling pathway to regulate TNF-α-induced rat cerebral vascular smooth muscle cell (VSMC) proliferation and migration. Methods Culture VSMC, cells in the control group were cultured normally, cells in the TNF-α group were treated with 100 ng/mL TNF-α; si-NC, si-H19, miR-NC, miR-145-5p mimics were transfected into TNF-α-induced VSMC, which were marked as TNF-α+si-NC group, TNF-α+si-H19 group, TNF-α+miR-NC group, TNF-α+miR-145-5p group; si-H19 and anti-miR-NC, si-H19 and anti-miR-145-5p were co-transfected into TNF-α-induced VSMC, and denoted as TNF-α+si-H19+anti-miR-NC group, TNF-α+si-H19+anti-miR-145-5p group. RT-qPCR was used to detect the expression levels of LncRNA-H19 and miR-145-5p; MTT was used to detect cell proliferation; Transwell was used to detect cell migration; luciferase reporter assay was used to detect the targeting relationship between LncRNA-H19 and miR-145-5p; Western blot was used to detect Cyclin D1, p21, matrix metallo proteinase 2 (MMP-2), matrix metallo proteinase 9 (MMP-9), phosphorylated JAK2 (p-JAK2), phosphorylated STAT3 (p-STAT3) protein expression levels. Results Compared with the control group, the expression level of LncRNA-H19 was significantly increased while miR-145-5p was significantly decreased in TNF-α group (P<0.01). Compared with the TNF-α+si-NC group, the H19 expression level in the TNF-α+si-H19 group was significantly reduced, and the OD value, Cyclin D1, cell migration number, MMP-2 and MMP-9 protein expression levels were significantly reduced, and the P21 protein expression level was significantly increased (P<0.01). Compared with the TNF-α+miR-NC group, the expression level of miR-145-5p in the TNF-α+miR-145-5p group was significantly decreased, while levels of OD value, Cyclin D1, cell migration number, MMP-2, MMP-9 protein were significantly decreased, and the expression level of P21 protein increased significantly (P<0.01). Compared with TNF-α+si-H19+anti-miR-NC group, the expression levels of OD value, Cyclin D1, cell migration number, MMP-2, MMP-9 protein were increased significantly in TNF-α+si-H19+anti-miR-145-5p group, and the expression level of P21 protein decreased significantly (P<0.05). Compared with the TNF-α+si-NC group, the p-JAK2 and p-STAT3 protein expression in the TNF-α+si-H19 group were significantly reduced (P<0.05); compared with TNF-α+si-H19+anti-miR-NC group, p-JAK2 and p-STAT3 protein expression in TNF-α+si-H19+anti-miR-145-5p group were significantly increased (P<0.05). Conclusion Interfering the expression of LncRNA-H19 and up-regulating the expression of miR-145-5p can inhibit the VSMC proliferation and migration of TNF-α group, which is related to blocking the phosphorylation of JAK2/STAT3 signaling pathway.
〔Keywords〕 LncRNA-H19; miR-145-5p; JAK2/STAT3 signaling pathway; TNF-α; vascular smooth muscle cell; prolif?eration; migration
血管平滑肌細胞(vascular smooth muscle cell, VSMC)是構(gòu)成血管壁組織結(jié)構(gòu)及維持血管張力的主要細胞,具有表型重塑的特征,其生物學行為的改變(如各種原因引起的增殖、凋亡等)可引起高血壓、動脈粥樣硬化和血管再狹窄等血管重塑性疾病[1-3]。長鏈非編碼RNA(long non-coding RNA, LncRNA)是長度大于200個核苷酸的非編碼RNA,無蛋白質(zhì)編碼功能,生物學性能發(fā)揮作用可調(diào)節(jié)細胞的增殖和凋亡[4-5]。microRNA(miRNA)是一類長度約19~24 nt的非編碼單鏈RNA,通過堿基互補配對的方式與靶基因的3’-UTR區(qū)部分或完全互補,剪切靶基因的轉(zhuǎn)錄產(chǎn)物或者抑制轉(zhuǎn)錄產(chǎn)物的翻譯,從而起到轉(zhuǎn)錄后調(diào)控靶基因表達的作用[6-7],其中miRNA-145在VSMCs中特異性高表達,可特異性抑制kruppel樣因子4(kruppel like factor 4, KLF4),對VSMCs表型變化及分化具有重要作用[8],JAK2-STAT3信號通路是參與細胞增殖、遷移、代謝、血管再生的重要信號途徑,多種因子及藥物可通過激活此通路促進血管內(nèi)皮細胞新生,改善缺血[9-10]。本實驗主要探討LncRNA-H19靶向miR-145-5p通過JAK2/STAT3信號通路調(diào)節(jié)TNF-α誘導大鼠腦VSMC增殖和遷移。
1 材料與方法
1.1? 實驗動物
10~12周齡雄性SPF級SD大鼠40只,體質(zhì)量250~280 g,購自湖南斯萊克景達實驗動物有限公司,動物許可證號:SCXK(湘)2019-0004,合格證號:4307272011011151067,飼養(yǎng)于湖南中醫(yī)藥大學第一附屬醫(yī)院實驗動物中心(晝夜交替12 h,溫度21~26 ℃,濕度40%~50%),實驗經(jīng)湖南中醫(yī)藥大學第一附屬醫(yī)院動物實驗倫理委員會批準(20201010-8)。
1.2? 材料、試劑與主要儀器
TNF-α試劑盒(上海生博生物醫(yī)藥科技有限公司,批號:430904);胎牛血清(批號:SN201909)、DMEM培養(yǎng)基(批號:200101)均購自美國Sigma公司;四甲基偶氮唑鹽比色法(methyl thiazolyl tetrazolium, MTT)試劑盒(上海拜力生物科技有限公司,批號:PH0533);RNA提取試劑盒(批號:SD1412)、反轉(zhuǎn)錄試劑盒(批號:AKA1709)、熒光定量試劑盒(批號:AK1301)均購自TaKaRa Bio公司;MMP-9(批號:ab48392)、P21(批號:ab91527)、Cyclin D1(批號:ab186738)均購自北京百奧萊博科技有限公司;RIPA蛋白裂解液(批號:J150003)、二辛可寧酸(bicinchoninic acid, BCA)試劑盒(批號:GUC0066)均購自賽默飛世爾科技(中國)有限公司;Transwell小室(美國BD公司,批號:6225968);雙熒光素酶報告基因檢測試劑盒(上海善然生物科技有限公司,批號:20160831);Power PacTM Basic基礎(chǔ)電泳儀(電源)(型號:1645050)、化學凝膠成像分析儀(型號:Chemi DocTM XRS+)、熒光定量PCR儀(型號:CFX96TM)均購自美國 Bio-Rad公司;臺式高速冷凍型微量離心機(型號:D3024R,中國DragonLab公司)。
1.3? 大鼠腦VSMC培養(yǎng)
取3~4只雄性SD大鼠,麻醉后處死,迅速取出整腦,在解剖顯微鏡下分離大腦基底動脈,將其反復剪碎后置于細胞培養(yǎng)瓶中,加入含20%胎牛血清和1%青鏈霉素的DMEM培養(yǎng)液,在37 ℃、5% CO2培養(yǎng)箱中培養(yǎng),待組織塊與瓶底黏附后將培養(yǎng)瓶輕輕翻轉(zhuǎn)平放,繼續(xù)培養(yǎng)3 d可見細胞爬出,換液后繼續(xù)培養(yǎng)10 d時觀察到組織塊周圍細胞相互融合且融合度達80%左右,進行傳代,取培養(yǎng)3代后細胞用于實驗。
1.4? 細胞處理與分組
培養(yǎng)大鼠腦VSMC,對照組的細胞正常培養(yǎng),TNF-α組的細胞用100 ng/mL TNF-α處理;將si-NC、si-H19、miR-NC、miR-145-5p mimics轉(zhuǎn)染至TNF-α誘導的大鼠腦VSMC,分別記為TNF-α+si-NC組、TNF-α+si-H19組、TNF-α+miR-NC組、TNF-α+miR-145-5p組;將si-H19和anti-miR-NC、si-H19和anti-miR-145-5p共轉(zhuǎn)染至TNF-α誘導的大鼠腦VSMC,記為TNF-α+si-H19+anti-miR-NC組、TNF-α+si-H19+anti-miR-145-5p組。
1.5? RT-qPCR法檢測LncRNA-H19和miR-145-5p表達水平
細胞培養(yǎng)48 h后,提取總RNA,用反轉(zhuǎn)錄試劑盒將RNA反轉(zhuǎn)錄成cDNA,按照熒光定量試劑盒說明進行實驗,每個樣品設(shè)3個重復,循環(huán)條件為95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40個循環(huán);60 ℃延長5 min。LncRNA-H19和miR-145-5p分別以GAPDH和U6為內(nèi)參。采用2-△△Ct法計算相對表達量。所需引物序列見表1。
1.6? MTT法檢測細胞增殖能力
在各組細胞培養(yǎng)至48 h時,每孔分別加入5 mg/mL的MTT溶液20 μL,于培養(yǎng)箱中繼續(xù)孵育4 h后棄去上清液,每孔加入150 μL二甲基亞砜,振蕩反應(yīng)10 min使沉淀溶解,用酶標儀于波長490 nm處檢測OD值。細胞存活率=實驗組OD值/對照組OD值×100%。
1.7? Transwell法檢測細胞遷移能力
調(diào)整各組細胞濃度為5×104個/mL,Transwell上室加入100 μL細胞懸液,下室加入500 μL含10% FBS培養(yǎng)基。培養(yǎng)24 h后,4%多聚甲醛固定30 min,0.1%結(jié)晶紫染色15 min。倒置顯微鏡觀察,隨機選取5個視野,拍照并計數(shù)。
1.8? Western blot法檢測蛋白表達水平
根據(jù)蛋白提取試劑盒提取各組細胞總蛋白,檢測蛋白濃度后進行變性處理,取30 μg蛋白樣品進行SDS-PAGE反應(yīng),轉(zhuǎn)膜,封閉,分別加入一抗(稀釋比例MMP-9為1∶1000,P21為1∶3000,Cyclin D1為1∶2000),4 ℃孵育24 h,TBST洗滌,分別加入二抗(山羊抗兔1∶10 000),室溫孵育1 h,暗室內(nèi)曝光顯影,應(yīng)用ImageJ軟件分析各條帶灰度值。
1.9? 熒光素酶報告實驗檢測LncRNA-H19和miR-145-5p的靶向調(diào)控關(guān)系
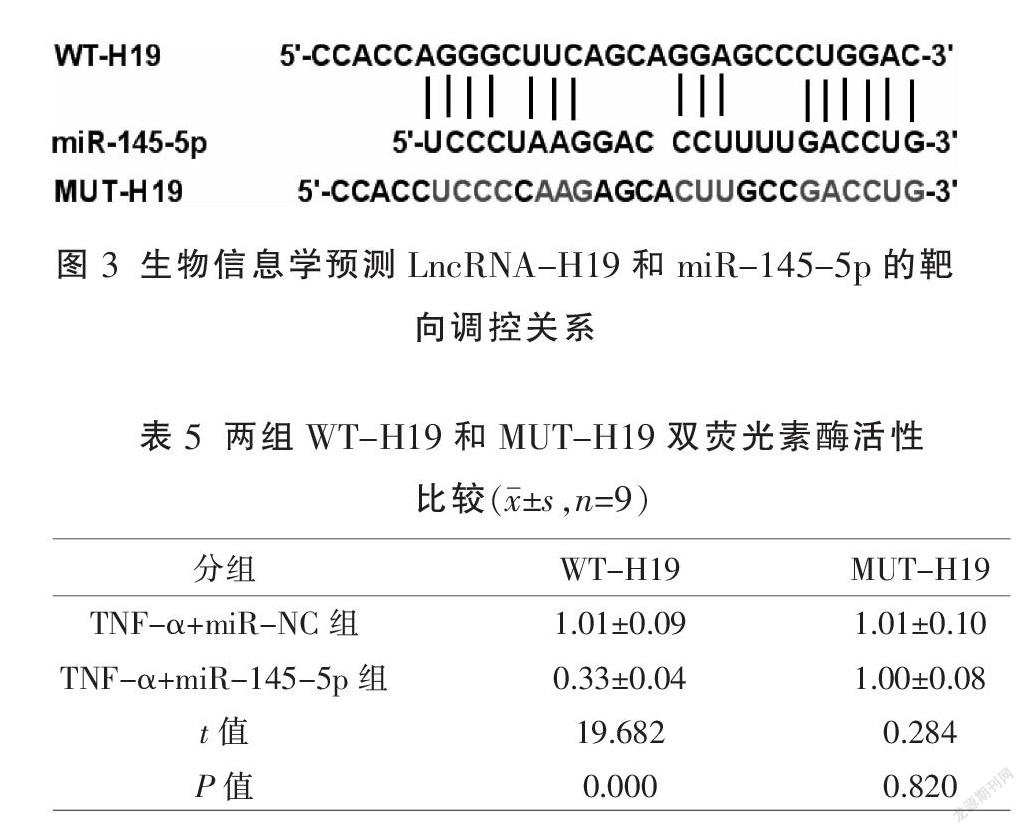
采用生物信息學預(yù)測出LncRNA-H19和miR-145-5p的靶向關(guān)系,含有結(jié)合位點的LncRNA-H19野生型(WT)或突變型(MUT)片段被克隆到pGL3熒光素酶載體中,分別命名為WT-H19或MUT-H19,將WT-H19或MUT-H19與miR-NC或miR-145-5p mimic一起轉(zhuǎn)染,48 h后,使用雙重熒光素酶報告基因檢測系統(tǒng)進行熒光素酶活性檢測。
1.10? 統(tǒng)計學分析
采用SPSS 22.0統(tǒng)計軟件分析實驗數(shù)據(jù),計量資料以“x±s”表示,各組數(shù)據(jù)若滿足正態(tài)分布和方差齊時,組間比較采用方差分析,方差不齊則用秩和檢驗,同組比較采用成組t檢驗。以P<0.05為差異具有統(tǒng)計學意義。
2 結(jié)果
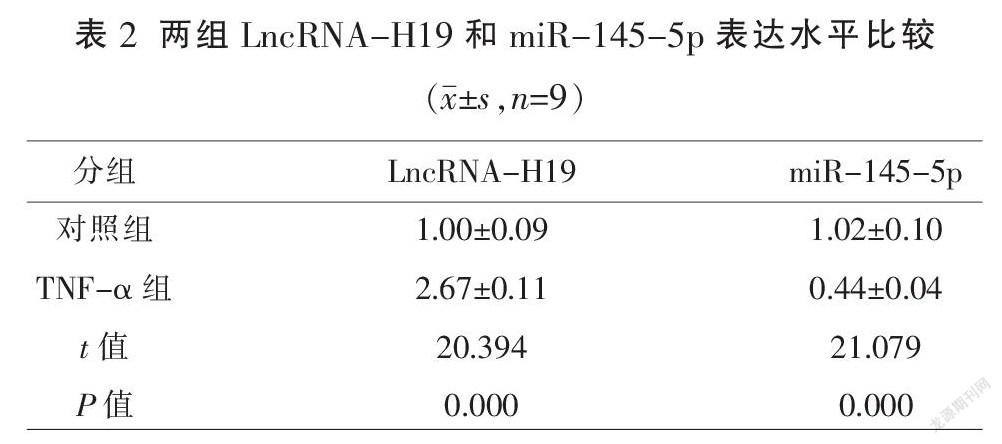
2.1? LncRNA-H19和miR-145-5p在TNF-α誘導VSMC中的表達水平比較
與對照組比較,LncRNA-H19在TNF-α組中的表達水平顯著升高,miR-145-5p在TNF-α組中的表達水平顯著降低(P<0.01)。見表2。
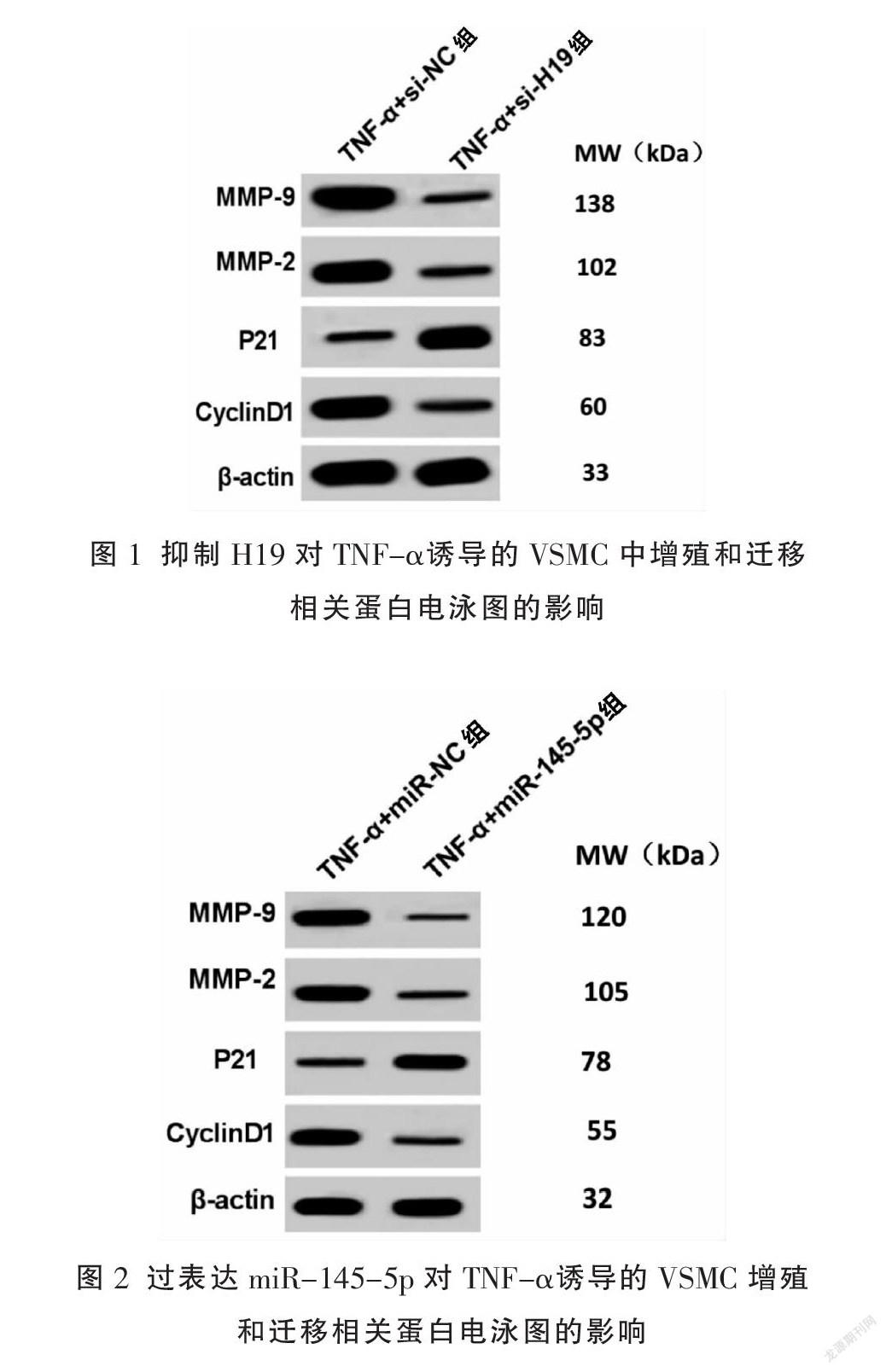
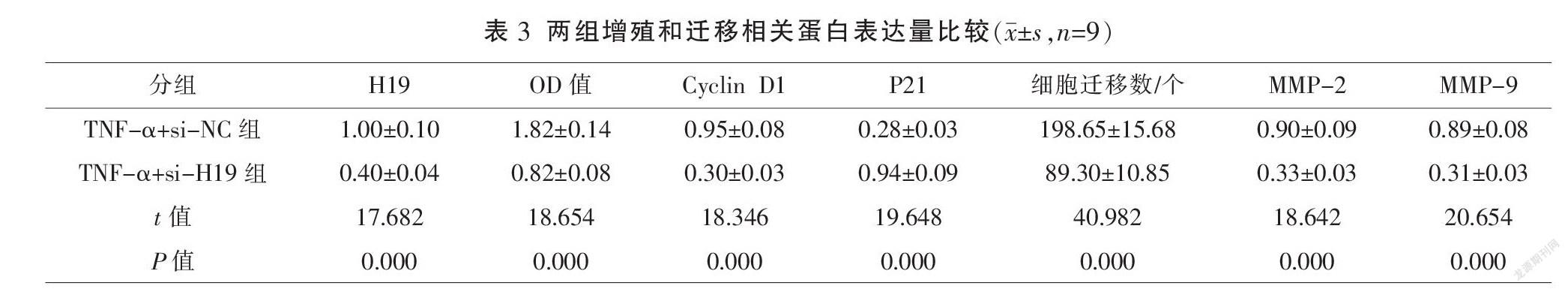
2.2? 抑制H19對TNF-α誘導VSMC中的增殖和遷移相關(guān)蛋白的影響
與TNF-α+si-NC組比較,TNF-α+si-H19組H19表達水平顯著降低,OD值、Cyclin D1、細胞遷移數(shù)、MMP-2及MMP-9蛋白表達水平顯著降低,P21蛋白表達水平顯著升高(P<0.01)。見圖1、表3。
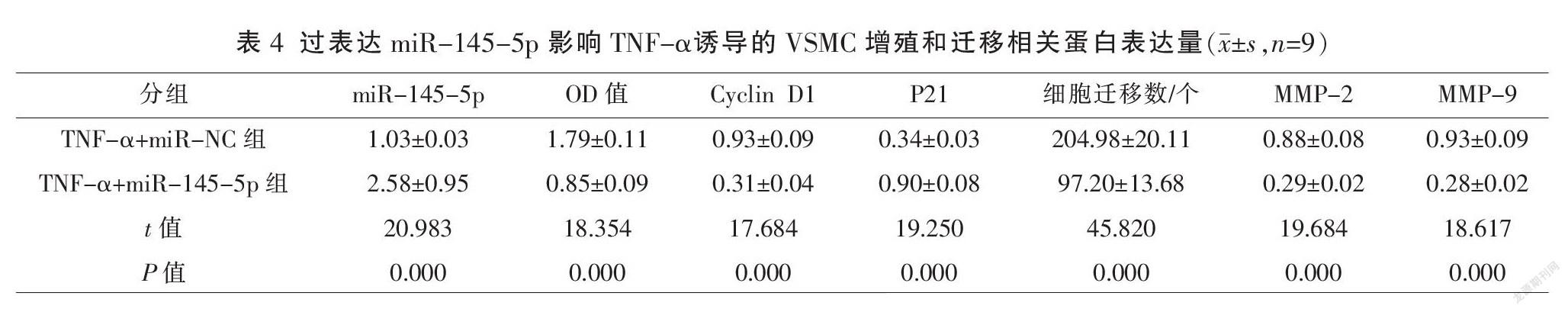
2.3? 過表達miR-145-5p對TNF-α誘導VSMC中的增殖和遷移的影響
與TNF-α+miR-NC組比較,TNF-α+miR-145-5p組miR-145-5p表達水平顯著降低,OD值、Cyclin D1、細胞遷移數(shù)、MMP-2及MMP-9蛋白表達水平顯著降低,P21蛋白表達水平顯著升高(P<0.01)。見圖2、表4。
2.4? LncRNA-H19和miR-145-5p的靶向調(diào)控關(guān)系
通過生物信息學預(yù)測出LncRNA-H19和miR-145-5p的靶向關(guān)系,含有結(jié)合位點的WT或突變型MUT片段被克隆到pGL3熒光素酶載體中,分別稱為WT-H19或MUT-H19,見圖3。雙熒光素酶報告實驗結(jié)果顯示,TNF-α+miR-145-5p組與TNF-α+miR-NC組比較,WT-H19熒光素酶活性顯著性增高(P<0.01),MUT-H19熒光素酶活性差異無統(tǒng)計學意義(P>0.05)。見表5。
2.5? miR-145-5p表達對TNF-α誘導VSMC增殖和遷移相關(guān)蛋白的影響
與TNF-α+si-H19+anti-miR-NC組比較,TNF-α+si-H19+anti-miR-145-5p組OD值、Cyclin D1、細胞遷移數(shù)、MMP-2及MMP-9蛋白表達水平顯著升高,P21蛋白表達水平顯著降低(P<0.05)。見圖4、表6。
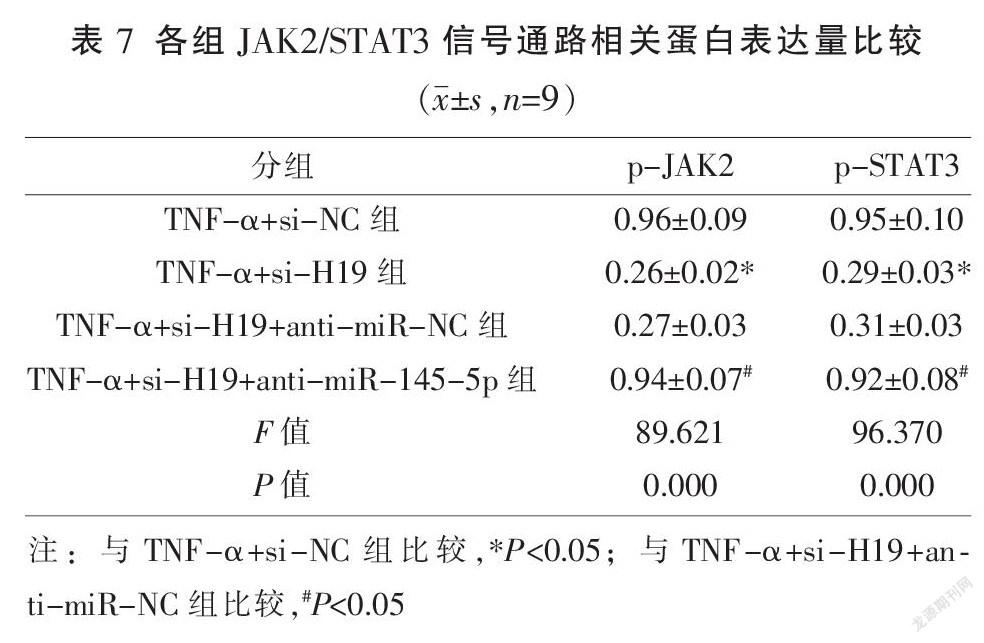
2.6? 各組JAK2/STAT3信號通路相關(guān)蛋白表達
與TNF-α+si-NC組比較,TNF-α+si-H19組p-JAK2、p-STAT3蛋白表達顯著降低(P<0.05);與TNF-α+si-H19+anti-miR-NC組比較,TNF-α+si-H19+anti-miR-145-5p組p-JAK2及p-STAT3蛋白表達顯著升高(P<0.05)。見圖5、表7。
3 討論
平滑肌即無紋肌的通稱,是被視為較橫紋肌原始的一種肌肉。平滑肌除作為無脊椎動物的軀體肌而有廣泛分布外,在脊椎動物除心肌之外,大部分內(nèi)臟肌也是由平滑肌組成的。對于正常人,VSMC凋亡調(diào)控著動脈血管壁的細胞數(shù)量和血管穩(wěn)態(tài),在動脈粥樣硬化發(fā)生發(fā)展過程中,VSMC遷移、增殖與細胞凋亡并存。在臨床上,VSMC的結(jié)構(gòu)一旦有所改變,就會引發(fā)高血壓等較為嚴重的病癥出現(xiàn)[11-12]。
LncRNA-H19位于細胞核內(nèi)或胞質(zhì)中,H19是最早被發(fā)現(xiàn)的有功能的LncRNA之一,它的序列高度保守,可通過多種模式參與調(diào)控生物學過程和疾病的發(fā)生發(fā)展,由于H19最早被證實在肺癌、卵巢癌、乳腺癌等多種癌癥中表達上調(diào),加速腫瘤細胞的增殖和侵襲,與腫瘤轉(zhuǎn)移及預(yù)后密切相關(guān),因此先前關(guān)于H19的研究大多集中在腫瘤領(lǐng)域。李峰等[13]報道:在MC3T3-E1細胞中LncRNA-H19被抑制后,H19表達量顯著下降并激活miR-185-5p表達,驗證了LncRNA-H19和 miR-185-5p有較強結(jié)合性,調(diào)控網(wǎng)絡(luò)可能存在于成骨細胞的增殖分化過程中,H19通過ceRNA機制發(fā)揮作用,且LncRNA-H19可以有效降低miR-185-5p抑制MC3T3-E1細胞增殖和分化。
LncRNA-H19在血管重塑中發(fā)揮著重要作用[14]。近年來已有H19在心腦血管疾病中的研究報道:Viereck等[15]指出H19基因療法可預(yù)防和逆轉(zhuǎn)實驗性壓力超負荷引起的心力衰竭,H19充當抗心肌肥大的LncRNA代表,LncRNA-miRNA網(wǎng)絡(luò)在調(diào)節(jié)細胞功能,包括代謝過程中起著重要作用,H19還可以通過競爭性結(jié)合let-7a促進VSMC增殖,導致血管負性重塑[16];miR-145是健康大鼠頸動脈平滑肌細胞中表達最豐富的miRNA,在VSMC的分化和增殖過程中扮演著重要角色,其上調(diào)會促進平滑肌細胞分化,而在細胞增殖時表達下降[17];miR-143/145團簇是通過協(xié)同調(diào)控一個包括kruppel樣因子5(kruppel like factor 5, KLF5)、KLF4、心肌素的轉(zhuǎn)錄網(wǎng)絡(luò),建立的調(diào)節(jié)血管平滑肌可塑性的調(diào)節(jié)因子,驅(qū)動增殖性VSMC表型變化,從而導致巨噬細胞樣特征的發(fā)展和VSMC攝取氧化低密度脂蛋白[18]。MiR-145進一步牽涉到促進血管平滑肌肌動蛋白和鈣橋蛋白等血管平滑肌收縮標志物的變化[19],Lin等[20]發(fā)現(xiàn)LncRNA是通過直接靶向miR-145調(diào)控VEGF-A的表達促進卵巢癌的腫瘤生長與血管生成;研究[21]證實miRNA、hsa-mir-496、hsa-mir-151a、hsa-mir-296-3p、hsa-mir-148a、hsa-mir-365b-5p、hsamiR-3687、hsa-mir-454、hsa-mir-155-5p和hsa-mir-145-5p差異調(diào)節(jié)參與細胞黏附、血管生成、細胞周期、JAK-STAT信號傳導的基因、MAPK信號傳導、一氧化氮信號傳導、VEGF信號傳導和傷口愈合途徑。李文婷等[22]研究指出miR-145靶向MMP-9表達抑制大鼠腦動脈VSMC增殖和遷移;另有研究[23]闡述IL-10通過JAK2/STAT3信號通路抑制VSMC凋亡;顏思陽等[24]研究發(fā)現(xiàn)活血榮絡(luò)方可抑制miR-17 miRNA的表達,上調(diào)STAT3 mRNA的表達,提示活血榮絡(luò)方可能通過調(diào)節(jié)STAT3-miR-17調(diào)控下游相關(guān)通路發(fā)揮作用。
基于以上,筆者推測LncRNA-H19靶向miR-145-
5p可能通過JAK2/STAT3信號通路調(diào)節(jié)TNF-α誘導的大鼠腦VSMC增殖和遷移,故以研究報道較少的LncRNA-H19和miR-145-5p兩個指標作為切入點進行探討,針對它們之間可能存在的靶向關(guān)系進行科學論證,本實驗發(fā)現(xiàn)抑制LncRNA-H19和過表達miR-145-5p均可導致TNF-α組中增殖和遷移相關(guān)蛋白Cyclin D1、MMP-2、MMP-9表達顯著降低,說明LncRNA-H19過表達可以促進平滑肌細胞周期的進程,它的上調(diào)可顯著促進Cyclin D1的表達;熒光素酶報告檢測系統(tǒng)經(jīng)常用于RNA結(jié)合靶點的驗證,本實驗中,與TNF-α+miR-NC組比較,TNF-α+miR-145-5p組WT-H19熒光素酶活性增高,證實miR-145-5p已被H19靶向和調(diào)節(jié),上調(diào)LncRNA-H19可以顯著抑制miR-145-5p的表達,在VSMC中LncRNA-H19與miR-145-5p之間彼此抑制對方的表達,存在潛在的相互調(diào)控關(guān)系,故表明LncRNA-H19促進VSMC增殖、遷移及細胞活力的作用受miR-145-5p影響;在抑制miR-145-5p的同時過表達LncRNA-H19可見TNF-α組中p-JAK2、p-STAT3蛋白表達顯著升高,反向驗證了LncRNA-H19靶向miR-145-5p調(diào)節(jié)TNF-α誘導的大鼠腦VSMC增殖和遷移是通過JAK2/STAT3信號通路發(fā)揮作用的,且該過程可能受細胞外拮抗劑、膜受體、細胞質(zhì)微環(huán)境和轉(zhuǎn)錄水平等多個層次的調(diào)控,但具體機制尚不明確且缺乏研究報道。
綜上所述,干擾LncRNA-H19表達、上調(diào)miR-145-5p表達可抑制TNF-α誘導大鼠腦VSMC增殖和遷移,其作用機制可能與阻斷JAK2/STAT3信號通路的磷酸化有關(guān),具體作用靶點和調(diào)控機制有待更深入的探討,或可為相關(guān)疾病的診治與研究提供新指標和新思路。
參考文獻
[1] ISLAM T. Impact of statins on vascular smooth muscle cells and relevance to atherosclerosis[J]. The Journal of Physiology, 2020, 598(12): 2295-2296.
[2] MOKHASHI N, CHOI R Y, CICALESE S, et al. Transduction efficiency of adenovirus vectors in endothelial cells and vascular smooth muscle cells[J]. Journal of Cardiovascular Pharmacology, 2020, 75(6): 603-607.
[3] OSMAN I, WANG L, HU G Q, et al. GFAP (glial fibrillary acidic protein)-positive progenitor cells contribute to the development of vascular smooth muscle cells and endothelial cells-brief report[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2020, 40(5): 1231-1238.
[4] LI J, CAO L T, LIU H H, et al. Long non coding RNA H19: An emerging therapeutic target in fibrosing diseases[J]. Autoimmunity, 2020, 53(1): 1-7.
[5] WANG Y F, DU L T, YANG X M, et al. A nomogram combining long non-coding RNA expression profiles and clinical factors predicts survival in patients with bladder cancer[J]. Aging, 2020, 12(3): 2857-2879.
[6] LIU H, YAN F. Gene regulation network modeling and mechanism analysis based on microRNA-disease related data[J]. Systems Medicine, 2021, 1:52-62.
[7] 張? 華,李曉波.microRNAs與腦血管疾病研究進展[J].實用老年醫(yī)學,2020,34(6):526-529.
[8] CHENG Y H, LIU X J, YANG J, et al. microRNA-145, a novel smooth muscle cell phenotypic marker and modulator, controls vascular neointimal lesion formation[J]. Circulation Research, 2009, 105(2): 158-166.
[9] KABIRI M, HEMMATPOUR A, ZARE F, et al. Paroxetine modulates immune responses by activating a JAK2/STAT3 signaling pathway[J]. Journal of Biochemical and Molecular Toxicology, 2020, 34(5): e22464.
[10] CHEN K, ZHAO Z W, WANG G, et al. Interleukin-5 promotes ATP-binding cassette transporter A1 expression through miR-211/JAK2/STAT3 pathways in THP-1-dervied macrophages[J]. Acta Biochimica et Biophysica Sinica, 2020, 52(8): 832-841.
[11] WANG X, BHULLAR K S, FAN H B, et al. Regulatory effects of a pea-derived peptide leu-arg-trp (LRW) on dysfunction of rat aortic vascular smooth muscle cells against angiotensin II stimulation[J]. Journal of Agricultural and Food Chemistry, 2020, 68(13): 3947-3953.
[12] CHOU E L, CARDENAS C L, CONRAD M F, et al. Vascular smooth muscle cells release protease nexin-1 in cell models of atherosclerosis and human carotid tissue[J]. Journal of Vascular Surgery, 2020, 72(1): e262-e263.
[13] 李? 峰,劉翠中,伍? 媛.LncRNA-H19通過抑制miR-185-5p的表達促進成骨細胞的增殖[J].湖南師范大學學報(醫(yī)學版),2021, 18(4):13-17.
[15] VIERECK J, BüHRKE A, FOINQUINOS A, et al. Targeting
muscle-enriched long non-coding RNA H19 reverses pathological cardiac hypertrophy[J]. European Heart Journal, 2020, 41(36): 3462-3474.
[16] 孫偉峰. LncRNA H19通過靶向調(diào)控CyclinD1促進血管重塑的機制研究[D].沈陽:中國醫(yī)科大學,2019.
[17] NAZARI-JAHANTIGH M, WEI Y Y, NOELS H, et al. microRNA-155 promotes atherosclerosis by repressing Bcl6 in macrophages[J]. The Journal of Clinical Investigation, 2012, 122(11): 4190-4202.
[18] 向? 龍. miRNA-145促進胚胎干細胞向血管平滑肌細胞誘導分化的實驗研究[D].遵義:遵義醫(yī)科大學,2020.
[19] HUANG R S, HU G Q, LIN B, et al. microRNA-155 silencing enhances inflammatory response and lipid uptake in oxidized low-density lipoprotein-stimulated human THP-1 macrophages[J]. Journal of Investigative Medicine: the Official Publication of the American Federation for Clinical Research, 2010, 58(8): 961-967.
[20] LIN X J, YANG F, QI X R, et al. LncRNA DANCR promotes tumor growth and angiogenesis in ovarian cancer through direct targeting of miR-145[J]. Molecular Carcinogenesis, 2019, 58(12): 2286-2296.
[21] KASIVISWANATHAN D, CHINNASAMY PERUMAL R, BHUVANESWARI S, et al. Interactome of miRNAs and transcriptome of human umbilical cord endothelial cells exposed to short-term simulated microgravity[J]. Nature Partner Journals Microgravity, 2020, 6:18.
[22] 李文婷,鄒? 偉,曹? 琳,等. miR-145靶向抑制MMP-9表達對大鼠腦動脈血管平滑肌細胞增殖和遷移的影響[J].山東醫(yī)藥,2017,
57(26): 25-28.
[23] MA L, ZHENG H B, ZHANG T. IL-10 suppress vascular smooth
muscle cell apoptosis via JAK2/STAT3 signaling pathway and its mechanism of action in atherosclerosis[J]. Minerva Endocrinologica, 2019, 44(4): 402-405.
[24] 顏思陽,楊仁義,劉利娟,等.基于“STAT3/miR-17”反饋環(huán)探討活血榮絡(luò)方對腦缺血再灌注損傷模型大鼠的保護作用機制[J].湖南中醫(yī)藥大學學報,2021,41(4):489-497.

