復方葶藶子湯改善COPD相關性肺動脈高壓大鼠的肺血管重塑的機制研究
劉敏 王啟芝 劉雨 柏正平


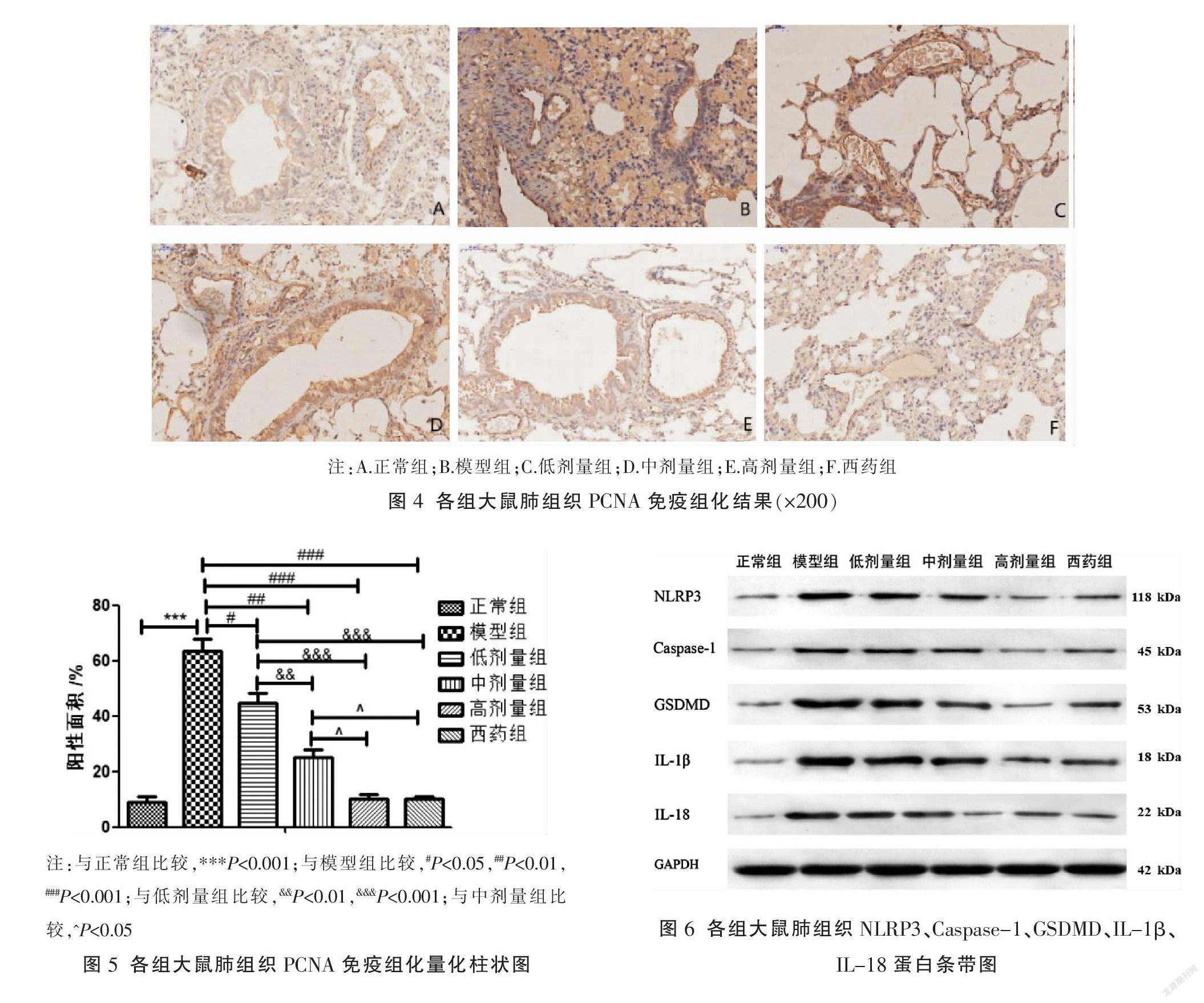

〔摘要〕 目的 探討復方葶藶子湯對慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)相關性肺動脈高壓(pulmonary arterial hypertension, PAH)大鼠肺血管重塑的影響及機制。方法 將90只SD大鼠隨機分為正常組、模型組、低劑量組、中劑量組、高劑量組和西藥組。正常組大鼠正常喂養,其余組大鼠均采用煙熏加氣管滴注脂多糖構建COPD-PAH大鼠模型。低劑量組、中劑量組、高劑量組予復方葶藶子湯(生藥量分別為2.56、5.13、10.26 g/kg),西藥組予辛伐他汀2.5 mg/kg,模型組予以等量0.9%生理鹽水,給與相應藥液(10 mL/kg),在實驗第60天開始,每天灌胃1次,連續14 d。HE染色觀察肺組織病理變化,Masson染色觀察肺小動脈膠原沉積,免疫組化觀察肺組織增殖指標增殖細胞核抗原(proliferating cell nuclear antigen, PCNA)的變化,Western blot檢測細胞焦亡通路NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平。結果 與正常組相比,模型組出現典型的COPD-PAH病理變化,肺小動脈膠原沉積面積、PCNA表達及肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均增加(P<0.05);與模型組相比,中劑量組、高劑量組和西藥組肺組織病理變化明顯改善,肺小動脈膠原沉積面積、PCNA表達及肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均減少(P<0.05);與低劑量組相比,中劑量組、高劑量組和西藥組肺組織病理變化明顯改善,肺小動脈膠原沉積面積、PCNA表達均及肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均減少(P<0.05);與中劑量組相比,高劑量組肺組織病理變化明顯改善,肺小動脈膠原沉積面積、PCNA表達及肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均減少(P<0.05)。結論 復方葶藶子湯可通過抑制NLRP3炎癥小體介導的細胞焦亡,改善COPD-PAH大鼠的肺血管重塑,且隨著復方葶藶子湯劑量的增加,COPD-PAH大鼠的肺血管重塑改善效果越明顯。
〔關鍵詞〕 復方葶藶子湯;NLRP3;細胞焦亡;肺血管重塑;慢性阻塞性肺疾病相關性肺動脈高壓
〔中圖分類號〕R285.5? ? ? ?〔文獻標志碼〕A? ? ? ? 〔文章編號〕doi:10.3969/j.issn.1674-070X.2022.03.006
〔Abstract〕 Objective To investigate the effects and mechanisms of Compound Tinglizi Decoction on pulmonary vascular remodeling in rats with chronic obstructive pulmonary disease (COPD)-pulmonary arterial hypertension (PAH). Methods Ninety SD rats were randomly divided into normal group, model group, low-dose group, middle-dose group, high-dose group and western medicine group. The rats in the normal group were fed normally, and the rats in the other groups were all used to construct the COPD-PAH rat model by smoke plus tracheal drip of lipopolysaccharide. The low-dose group, middle-dose group, and high-dose group were given Compound Tinglizi Decoction (the crude drug doses were 2.56, 5.13, and 10.26 g/kg, respectively), the western medicinegroup was given simvastatin 2.5 mg/kg, and the model group was given the same amount of 0.9% physiological saline administered, with the corresponding drug solution (10 mL/kg), and from the 60th day of the experiment, the rats were given intragastrical once a day for 14 consecutive days. Histopathological changes in the lungs of rats in each group were observed by HE staining. Collagen deposition in small pulmonary arteries was observed by Masson staining. Changes in proliferation indicators proliferating cell nuclear antigen (PCNA) in lung tissue were observed by immunohistochemistry. Protein levels of NLRP3, Caspase-1, GSDMD, IL-1β, IL-18 in pyroapoptotic pathways were measured by Western blot. Results Compared with the normal group, the model group had typical pathological changes of COPD-PAH, and the collagen deposition area of pulmonary arterioles, the expression of PCNA and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β and IL-18 in the lung tissue were increased (P<0.05). Compared with the model group, the pathological changes of lung tissue in the middle-dose group, high-dose group and western medicine group were significantly improved, the collagen deposition area of pulmonary arterioles, the expression of PCNA, and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β, and IL-18 in lung tissue were reduced (P<0.05). Compared with the low-dose group, the pathological changes of lung tissue in the middle-dose group, high-dose group and western medicine group were significantly improved, the collagen deposition area of pulmonary arterioles, the expression of PCNA and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β, IL-18 were reduced (P<0.05). Compared with the middle-dose group, the pathological changes of lung tissue in the high-dose group were significantly improved, and the collagen deposition area of pulmonary arterioles, the expression of PCNA and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β and IL-18 in the lung tissue were all decreased (P<0.05). Conclusion Compound Tinglizi Decoction can improve pulmonary vascular remodeling in rats with COPD-PAH through inhibiting NLRP3 inflammatory vesicle-mediated pyroptosis, and with the increase of the dose of Compound Tinglizi Decoction, the improvement effect of pulmonary vascular remodeling in COPD-PAH rats is more obvious.
〔Keywords〕 Compound Tinglizi Decoction; NLRP3; pyroptosis; pulmonary vascular remodeling; chronic obstructive pulmonary disease-associated pulmonary hypertension
肺動脈高壓(pulmonary arterial hypertension, PAH)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的一種常見和重要的并發癥[1],肺血管重塑是PAH的重要標志[2]。研究認為,慢性炎癥在COPD的氣道重塑、氣流阻塞和PAH過程中起著重要作用[3]。激活的Caspase-1可以誘發一種炎癥形式的程序性細胞壞死,即細胞焦亡,其特征是大量促炎癥因子釋放和炎癥級聯反應[4]。NLRP3炎癥小體是目前研究最深入的一種炎癥小體,它可通過活化Caspase-1介導細胞焦亡[5]。且研究證實,NLRP3炎癥小體參與了COPD及PAH氣道和血管的慢性炎癥[6-7]。因此,推測NLRP3炎癥小體介導的細胞焦亡可能參與了COPD-PAH的肺血管重塑。
目前,許多中藥復方用于治療COPD,如豐白散[8]、參芪補肺散[9]、桑梅止咳顆粒[10]等,均具有一定療效。研究發現,活血化瘀中藥有效成分通過抑制NLRP3炎癥小體通路參與多種疾病治療[11-13]。本課題組長期從事采用中藥復方治療呼吸系統疾病的臨床工作,如本課題前期研究發現,麻葶舒喘湯可通過緩解哮喘氣道黏液高分泌癥狀,有效治療哮喘[14]。本課題柏正平教授根據多年臨床經驗及COPD-PAH中醫病機原理,根據“飲瘀同治”的治則創立了復方葶藶子湯。研究顯示復方葶藶子湯可明顯改善COPD-PAH患者臨床癥狀及減少急性發病次數,動物實驗證實可降低PAH,改善肺血管重塑[15-17]。由此,推測復方葶藶子湯可能通過抑制NLRP3炎癥小體介導的細胞焦亡改善COPD-PAH肺血管重塑。
本次研究通過構建COPD-PAH大鼠模型,觀察COPD-PAH大鼠肺組織中細胞焦亡的情況,探究復方葶藶子湯改善COPD-PAH肺血管重塑的作用機制,現將實驗方法及結果報道如下。
1 材料
1.1? 動物
清潔級健康雄性SD大鼠90只,鼠齡10~12周,體質量(200±20) g,由湖南斯萊克景達實驗動物有限公司提供,許可證號:SYXK(湘)2019-0017。實驗地點:湖南中醫藥研究所,本實驗經湖南中醫藥大學動物倫理委員會批準(備案編號:2020-0092),符合實驗動物福利與倫理原則。
1.2? 藥物制備
復方葶藶子湯組成:葶藶子15 g,黃芩10 g,桃仁10 g,紅花10 g,水蛭6 g,川芎15 g,茯苓15 g,桂枝15 g,白術15 g,矮地茶15 g,甘草6 g。中藥材購自湖南省中醫藥研究院附屬醫院中藥房,經湖南省中醫藥研究院附屬醫院藥劑科田其學教授鑒定為道地藥材。按生藥量加入10倍水,煎煮1 h保存藥液;藥渣再加入8倍量水,煎煮1 h,過濾去沉淀,合并濾液蒸干,制備成浸膏干粉,臨用前用蒸餾水配成所需濃度。
1.3? 主要試劑和儀器
辛伐他汀(上海信誼萬象藥業股份有限公司,批號:H19980174);黃果樹牌香煙(貴州中煙工業有限責任公司,批號:6901028102353);Masson染色試劑盒(美國Wellbio公司,批號:WB00231A);增殖細胞核抗原(proliferating cell nuclear antigen,PCNA,批號:ab92552)、IgG(批號:pv9000)、NLRP3(批號:ab263899)、GSDMD(批號ab219800)、IL-1β(批號:ab205924)、IL-18(批號:ab191860)均購自美國Abcam公司;Caspase-1(批號:22915-1-AP)、β-actin(批號:60008-1-Ig)均購自美國Proteintech公司;總 RNA 提取 TRIZOL 試劑盒(美國Thermo公司,批號:15596026)。化學發光成像系統(廣州勤翔光電科技有限公司,型號:Chemiscope6100);顯微鏡(型號:BA210T)、光學顯微鏡(型號:BA410T)均購自德國Motic公司。
2 方法
2.1? 分組
將90只SD大鼠隨機分為正常組、模型組、低劑量組、中劑量組、高劑量組和西藥組,每組15只。
2.2? 模型制備與干預
除正常組外,其余組別均參照舒家澤等[18]采用煙熏加氣管滴注脂多糖方法建立COPD-PAH大鼠模型,通過肺功能檢測、超聲心動圖及肺組織病理切片判定建模是否成功。肺功能殘氣量、吸氣阻力、右心室平均壓及右心室肥厚指數增加,肺組織病理切片可觀察到炎癥細胞浸潤,氣管壁和肺細小血管壁平滑肌增厚等,則表明建模成功[18]。于第1、30天大鼠麻醉后氣管內滴脂多糖;然后將大鼠放入自制熏煙箱內經大鼠口鼻吸入,第2~29天、第31~59天香煙煙熏,1 h/次,2次/d。參考人和動物體表面積折算的等效劑量比率表,大鼠的等效劑量相當于人的6.3 倍。每只動物每千克體質量給藥量按臨床人(70 kg)的等效量為中劑量,0.5倍等效量為低劑量,2倍等效量為高劑量,故低劑量組、中劑量組、高劑量組生藥量分別為2.56、5.13、10.26 g/kg,西藥組辛伐他汀予2.5 mg/kg,在實驗第60天開始,每天灌胃1次,給與相應藥液(10 mL/kg),正常組不予以任何處理,模型組予以等量0.9%生理鹽水,連續14 d。各組于末次給藥后禁食8 h,次日處死大鼠,取血及肺組織進行相關指標檢測。
2.3? 標本制備
用10%水合氯醛(0.4 mL/100 g)麻醉大鼠,處死后,取右肺,浸入10%中性福爾馬林固定液中固定,石蠟包埋,切片行HE染色、Masson染色、免疫組化檢測,余肺組織迅速放入液氮罐中速凍用于Western blot檢測。
2.4? 指標檢測
2.4.1? HE染色觀察肺組織病理變化? 先將肺組織切片脫蠟至水,然后按照HE染色試劑盒說明書操作,在顯微鏡下觀察拍照。選擇視野主要觀察非毛細血管、細支氣管、肺泡等結構的形態,有無炎性細胞浸潤等。
2.4.2? Masson染色觀察肺小動脈膠原沉積? 先將肺組織切片脫蠟至水,然后按照Masson染色試劑盒使用說明書依次加染液操作(蘇木素染細胞核-麗春紅染色-磷鉬酸處理-苯胺藍染色),然后用1%冰醋酸處理1 min,脫水、封片、顯微鏡下觀察拍照。染色結果判讀:肌纖維呈紅色,膠原纖維呈綠色或藍色,用ImageJ軟件對染色結果進行分析。
2.4.3? 免疫組化檢測肺組織PCNA的表達? 肺組織切片脫蠟至水,然后進行滅活,暴露抗原結合位點,蒸餾水沖洗3次。滴加稀釋好的一抗(PCNA,1∶100),4 ℃過夜。PBS沖洗5 min×3次。滴加50~100 μL二抗,37 ℃,孵育30 min,PBS沖洗5 min×3次。滴加DAB顯色,復染、脫水、透明、中性樹膠封片。陽性染色為黃色或棕黃色或褐色,用ImageJ軟件對染色結果進行分析。
2.4.4? Western blot檢測肺組織NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白的表達 提取各組肺組織蛋白,根據BCA法蛋白含量檢測試劑盒說明書測定蛋白濃度。10%、15%分離膠,4.8%的濃縮膠,每個泳道加入10 μL蛋白樣品,SDS-PAGE恒壓電泳、轉膜,脫脂牛奶封閉,不同稀釋比例的一抗(NLRP3為1∶1000;Caspase-1為1∶1000;GSDMD為1∶1000;IL-1β為1∶1000;IL-18為1∶2000),4 ℃,孵育過夜;稀釋好的二抗與膜共同室溫孵育90 min。ECL顯色曝光,用ImageJ分析目標條帶的灰度值。
2.5? 統計學方法
采用SPSS 16.0軟件分析數據。計量資料采用“x±s”描述,計量資料符合正態分布且方差齊時,兩組間的比較采用t檢驗,兩組以上的比較采用方差分析。P<0.05表示差異具有統計學意義。
3 結果
3.1? 各組肺組織病理變化
正常組的肺組織內氣道、肺泡壁及周圍血管壁結構基本正常,血管壁光滑,管腔通暢,僅有少數炎性細胞浸潤。模型組可見氣道結構完整性遭到破壞,血管壁增厚,管腔縮小,肺泡內大量炎性細胞彌散性浸潤。采用藥物處理后,隨著復方葶藶子湯藥物濃度的增加,大鼠肺組織中血管壁變薄,炎性浸潤減少。西藥組采用辛伐他汀處理后,大鼠肺組織出現了與中劑量組、高劑量組肺組織相似的病理變化,即血管壁變薄,炎性浸潤減少。見圖1。
3.2? 各組肺組織中肺小動脈膠原沉積面積的比較
與正常組相比,模型組陽性面積顯著增加(P<0.05)。與模型組相比,低劑量組、中劑量組和高劑量組陽性面積均減少,除低劑量組與模型組陽性面積差異無統計學意義外(P>0.05),其余兩組與模型組組間差異具有統計學意義(P<0.05);西藥組陽性面積較模型組減少(P<0.05)。與低劑量組相比,中劑量組、高劑量組及西藥組陽性面積均減少(P<0.05)。與中劑量組相比,高劑量組陽性面積減少,但差異無統計學意義(P>0.05)。見圖2-3。
3.3? 各組肺組織PCNA表達水平的比較
與正常組相比,模型組PCNA表達明顯增多(P<0.05)。與模型組相比,低劑量組、中劑量組、高劑量組及西藥組PCNA表達均減少(P<0.05)。與低劑量組相比,中劑量組、高劑量組及西藥組PCNA表達均減少(P<0.05)。與中劑量組相比,高劑量組和西藥組PCNA表達均減少(P<0.05)。見圖4-5。
3.4? 各組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平的比較
與正常組相比,模型組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均升高(P<0.05)。與模型組相比,低劑量組、中劑量組、高劑量組及西藥組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均下降,除低劑量組中Caspase-1、IL-1β、IL-18和中劑量組中Caspase-1下降與模型組相比,差異無統計學意義外(P>0.05),其余組間差異均具有統計學意義(P<0.05)。與低劑量組相比,中劑量組、高劑量組及西藥組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均下降,其中,高劑量組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白下降與低劑量組相比,差異均有統計學意義(P<0.05)。與中劑量組相比,高劑量組和西藥組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均下降,其中高劑量組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白下降與中劑量組相比,差異均有統計學意義(P<0.05)。與高劑量組相比,西藥組肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均上升(P<0.05)。見圖6-7。
4 討論
COPD會出現血管結構(血管重塑)的改變,這種改變可能會發展并導致PAH,這種并發癥可能會在50%以上的晚期患者中出現[19]。PAH的發生,增加了疾病的惡化頻率,縮短了患者的生存期[20-21]。因此,探究COPD-PAH中肺血管重塑的機制,有利于尋找有效的治療靶點,為臨床患者帶去福音。
本研究結果首次證實NLRP3炎癥小體介導細胞焦亡參與COPD-PAH的血管重塑。最新研究發現,依賴于Cspase-1激活的細胞焦亡存在于PAH大鼠模型和缺氧的人類肺動脈平滑肌細胞中,且該研究指出,抑制Caspase-1的激活,可改善PAH[22]。NLRP3/Caspase-1/GSDMD信號通路是細胞焦亡關鍵機制之一[23]。NLRP3炎癥小體與COPD、PAH的發生發展密切相關[6-7]。在本研究中,HE染色、Masson染色和免疫組化的結果充分證實COPD-PAH大鼠肺血管出現了血管重塑的病理表現。Western blot的結果顯示,相比正常組,COPD-PAH大鼠肺組織中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的表達顯著上調。綜上所述,NLRP3炎癥小體介導細胞焦亡存在于COPD-PAH大鼠中,與肺血管重塑密切相關。
痰飲、血瘀貫穿COPD-PAH疾病始終且影響預后。臨床上,以“飲瘀同治”為治法的復方葶藶子湯可有效緩解和改善COPD-PAH患者癥狀[16-17]。復方葶藶子湯中葶藶子瀉肺逐水、止咳平喘,為君藥;黃芩清肺化痰,水蛭活血化瘀,矮地茶化痰止咳,共助君藥宣通肺部壅滯,為臣藥;桃仁、紅花、川芎活血逐瘀,茯苓、桂枝、白術溫脾化飲,以絕生痰之源,為佐藥;甘草健脾和中,調和諸藥,為使藥。諸藥合用,共奏瀉肺逐瘀、溫肺化痰、止咳平喘之效。
本研究結果顯示,與模型組相比,中藥組大鼠的肺血管重塑病理表現明顯改善,肺組織中PCNA、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的表達均下調;且本研究通過設置低、中、高劑量組,明確復方葶藶子湯改善COPD-PAH的肺血管重塑是否存在劑量依賴,結果表明,隨著復方葶藶子湯藥物濃度的增加,肺血管重塑病理表現改善越明顯,肺組織中PCNA、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18下調越多。此外,本研究設置了西藥組,采用辛伐他汀處理。文獻研究已表明,辛伐他汀治療COPD-PAH能有效改善肺功能,降低血清炎性因子,提高血管內皮功能等[24-25]。本研究結果顯示,中、高劑量組改善COPD-PAH的血管重塑效果與西藥組辛伐他汀改善效果相當;Masson染色結果顯示,西藥組陽性面積和中劑量組相當,而高劑量組陽性面積少于西藥組;肺組織中PCNA免疫組化結果顯示,西藥組PCNA表達水平和高劑量組相當;Western blot結果顯示,高劑量組的肺組織中PCNA、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的表達較西藥組均顯著下調。本研究結果提示,復方葶藶子湯高劑量組治療COPD-PAH療效與西藥組辛伐他汀療效相似。
綜上所述,本研究首次表明,復方葶藶子湯通過抑制NLRP3炎癥小體介導細胞焦亡能改善COPD-PAH的血管重塑,為臨床上復方葶藶子湯能有效治療COPD-PAH患者提供機制支持。
參考文獻
[1] BLANCO I, TURA-CEIDE O, PEINADO V I, et al. Updated perspectives on pulmonary hypertension in COPD[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2020,15:1315-1324.
[2] CAO N, TANG X, GAO R, et al. Galectin-3 participates in PASMC migration and proliferation by interacting with TGF-β1[J]. Life Sciences, 2021,274:119347.
[3] RONG B, LIU Y, LI M, et al. Correlation of serum levels of HIF-1α and IL-19 with the disease progression of COPD: a retrospective study[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2018, 13:3791-3803.
[4] XIE Y, HUANG Y, LING X, et al. Chemerin/CMKLR1 axis promotes inflammation and pyroptosis by activating NLRP3 inflammasome in diabetic cardiomyopathy rat[J]. Frontiers in physiology, 2020,11:381.
[5] WALI J A, MASTERS S L, THOMAS H E. Linking metabolic abnormalities to apoptotic pathways in Beta cells in type 2 diabetes [J]. Cells, 2013, 2(2): 266-83.
[6] COLARUSSO C, TERLIZZI M, MOLINO A, et al. Role of the inflammasome in chronic obstructive pulmonary disease (COPD) [J]. Oncotarget, 2017, 8(47):81813.
[7] ZENG M, SANG W, CHEN S, et al. Inhibition of ER stress by 4-PBA protects MCT-induced pulmonary arterial hypertension via reducing NLRP3 inflammasome activation[J]. International Journal of Clinical and Experimental Pathology, 2017,10(4):4162-4172.
[8] 李竹英,王? 婷,田春燕.參芪補肺方對慢性阻塞性肺疾病穩定期大鼠Nrf2和γ-GCS表達的影響[J].湖南中醫藥大學學報,2018, 255(12):36-40.
[9] 潘三改,蘇南湘,王? 哲,等.豐白散對COPD模型大鼠γ-谷氨酰半胱氨酸合成酶及超氧化物歧化酶的影響[J].湖南中醫藥大學學報,2009(6):36-39.
[10] 孫? 寧,于文曉,袁? 芳.基于網絡藥理學和分子對接技術探討桑梅止咳顆粒治療COPD的作用機制[J].湖南中醫藥大學學報,2021,41(12):1905-1913.
[11] WU X, ZHANG F, XIONG X, et al. Tetramethylpyrazine reduces inflammation in liver fibrosis and inhibits inflammatory cytokine expression in hepatic stellate cells by modulating NLRP3 inflammasome pathway[J]. IUBMB Life, 2015,67(4): 312-321.
[12] 劉富群,高? 崎,王丹丹,等.銀杏酮酯(GBE50)抑制NLRP3炎癥小體活性改善大鼠抑郁樣行為[J].中藥藥理與臨床,2017(5):54-58.
[13] 蔡? 琳,易小波,袁利邦,等.丹參酮ⅡA通過NLRP3炎癥體信號通路對小膠質細胞糖氧剝奪/再灌注損傷的保護作用[J].四川大學學報(醫學版),2016,47(5):660-664.
[14] 劉? 敏,張才圣,柏正平.麻葶舒喘湯對哮喘小鼠氣道黏液高分泌的影響及機制研究[J].湖南中醫藥大學學報,2020,40(12):1449-1455.
[15] 柏正平,鄭? 兵,卜獻春,等.復方葶藶子膠囊對肺動脈高壓和心肌收縮力影響的實驗研究[J].湖南中醫雜志,2000,16(1):57-58.
[16] 柏正平,卜獻春,喻正科,譚光波,曾松林.復方葶藶子膠囊治療肺心病心衰45例療效觀察[J].湖南中醫藥導報,2002,8(3):5-97.
[17] 柏正平,卜獻春,譚光波,等.復方葶藶子膠囊治療肺心病心衰療效評價及機理探討[J].中國中醫藥信息雜志,2003,10(10):20-23.
[18] 舒家澤,盧文菊,李德富,等.應用煙草煙霧口鼻暴露聯合脂多糖方法建造慢性阻塞性肺疾病及相關肺動脈高壓小鼠模型[J].中華結核和呼吸雜志,2015,38(12):907-911.
[19] THABUT G, DAURIAT G, STERN JB, et al. Pulmonary hemod?
ynamics in advanced COPD candidates for lung volume reduction surgery or lung transplantation[J]. Chest, 2005,127(5):1531-1536.
[20] OSWALD-MAMMOSSER M, WEITZENBLUM E, QUOIX E, et al. Prognostic factors in COPD patients receiving long-term oxygen therapy. Importance of pulmonary artery pressure[J]. Chest, 1995,107(5):1193-8.
[21] KESSLER R, FALLER M, FOURGAUT G, et al. Predictive factors of hospitalization for acute exacerbation in a series of 64 patients with chronic obstructive pulmonary disease[J]. American Journal of Respiratory & Critical Care Medicine, 1999, 159(1):158-64.
[22] ZHANG M, XIN W, YU Y, et al. Programmed death-ligand 1 triggers PASMCs pyroptosis and pulmonary vascular fibrosis in pulmonary hypertension[J]. Journal of Molecular and Cellular Cardiology, 2020, 138: 23-33.
[23] JIANG S, ZHANG H, LI X, et al. Vitamin D/VDR attenuate cisplatin-induced AKI by down-regulating NLRP3/Caspase-1/GSDMD pyroptosis pathway[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2021, 206: 105789.
[24] 胡志偉,朱建俊,陸洪國,等.辛伐他汀治療慢性阻塞性肺疾病并發肺動脈高壓的臨床觀察[J].浙江實用醫學,2019,24(6):4.
[25] 唐? 晨.辛伐他汀治療對慢性阻塞性肺疾病合并肺動脈高壓患者心肺功能及炎性細胞因子的影響[J].現代中西醫結合雜志,2017(8):851-853.

