不同氮磷比對球形棕囊藻釋放含硫化合物及DMSP降解途徑的影響?
涂俊杰,高配配,劉春穎,李培峰??,楊桂朋
(1.中國海洋大學化學化工學院,海洋化學理論與工程技術教育部重實驗室,山東 青島 266100;2.青島海洋科學與技術試點國家實驗室 海洋生態與環境科學功能實驗室,山東 青島 266237)
二甲基硫(Dimethylsulfide,DMS)是從海洋釋放到大氣中最重要的揮發性生源含硫有機物[1-3]。浮游植物產生的DMS釋放到大氣中,被氧化成為二氧化硫和甲基磺酸鹽,形成硫酸鹽氣溶膠,增加云凝結核數量,進而影響云層對太陽光的反照率,對氣候變化起負反饋作用,在全球氣候變化中扮演了重要角色。同時,硫酸鹽氣溶膠對酸雨、酸霧的形成具有重要貢獻[4]。二甲巰基丙酸內鹽(Dimethylsulfoniopropionate,DMSP)是DMS的主要前體物質[5],海洋中浮游微藻、大型藻類和鹽生植物都是DMSP的重要來源,但DMSP含量具有明顯的種間或株間差異性[6-7]。在高鹽缺氮條件下DMSP可作為藻類維持自身滲透壓平衡的調節劑,在低溫下DMSP具有抗冷凍作用,用于維持生物酶活性,與藻類生理脅迫有直接關系[8-10]。丙烯酸(Acrylic acid,AA)是DMSP的降解產物之一,DMSP可以通過裂解酶催化產生等摩爾的DMS和AA,還可以通過去甲基化途徑產生甲基硫醇鹽(3-methiolpropionate,MMPA),MMPA再轉化為甲硫醇和AA[11]。DMS/AA代表DSMP酶裂解途徑占兩種降解途徑的比例,DMS/(DMSP+AA)代表DMS生產百分比,AA/(DMSP+AA)代表總DMSP的降解率。AA可作為細菌的主要碳源[12],但在AA濃度較高時又可抑制細菌生長[13]。Yang等[14]發現夏季南極沿海棕囊藻暴發現場的AA濃度為0.001~0.510 μmol·L-1,與藻細胞密度呈現顯著的相關性。Gibson等[15]在南極浮游植物藻華期間測定表層海水AA濃度可以達到1.2 μmol·L-1。AA降解去除主要通過兩種途徑:微生物降解[16]和光化學氧化[17]。海洋環境中物理和化學因素,如溫度、鹽度、光照、微量元素和營養鹽等,都會對藻類生成DMSP、DMS和AA產生影響[18-21],但目前沒有一致的定論。
球形棕囊藻(Phaeocystisglobosa)隸屬于定鞭藻門,是一種具有獨特形態和生態學特征廣泛分布于全球海洋的赤潮藻。該藻種是DMS和DMSP的高產藻種[22-25]。特別是在大規模球形棕囊藻藻華暴發的后期,會釋放高濃度的DMS和DMSP到環境中[22]。目前,對海洋中DMS分布與海-氣通量的研究較多[26-27],而對球形棕囊藻藻華發生現場的DMS與DMSP通量研究較少。齊雨藻等[23]研究發現渤海海域球形棕囊藻藻華暴發現場DMSP濃度可達到354~471 nmol·L-1,DMS濃度在34~60 nmol·L-1之間,遠高于非藻華發生期間的DMS濃度(1.3~3.4 nmol·L-1)[28],藻華發生期間的DMS濃度可達到非藻華期間的10~100倍[29]。Noordkamp等[30]發現球形棕囊藻體內的AA濃度高達1.3~6.5 μmol·L-1,原因在于高濃度的AA吸附在粘液層上從而影響其擴散。到目前為止,有關球形棕囊藻釋放生源硫化物的影響因素報道甚少。
在藻類的硫酸鹽同化還原釋放含硫化合物的過程中,營養鹽對藻類的光合作用有重要的影響。目前,對海洋大型藻類的研究較多[31-35],而對浮游微藻研究較少。Li等[31]研究發現高氮高磷促進了滸苔對海水中溶解無機碳(DIC)的吸收同時導致海水pH的升高,對DIC吸收量達0.70 mmol·L-1,pH提升量為1.43。林慶瑩等[32]研究發現氮磷加富會促進瓦氏馬尾藻光合固碳能力,降低海水中DIC的濃度,提升海水pH。本論文以球形棕囊藻為研究對象,探究營養鹽對典型赤潮藻光合作用、生長狀況、釋放生源硫化物以及DMSP降解途徑的影響,從而為完善海洋硫循環的研究提供參考數據。
1 材料與方法
1.1 實驗方案
球形棕囊藻藻種取自于中國海洋大學海洋污染與生態化學實驗室。培養所用海水采自于中國東海(鹽度為32),經0.45 μm醋酸纖維濾膜過濾,裝入2 L的錐形瓶中,并在121 ℃下高壓滅菌(高壓滅菌鍋,LDZX-50KBS,上海申安醫療器械廠)20 min,靜置冷卻至室溫后充分搖動以恢復溶解氣體含量。按照f/2配方[36]加入相應的營養物質,放置于光照培養箱(GXZ-380B,寧波江南儀器廠)中靜置培養。光暗比為12 h∶12 h,溫度為20 ℃,光照強度為6 000 Lux。為防止微藻沉淀以及保持藻液中的溶解氣體含量,每天充分搖晃培養瓶3~6次。進行預培養后取生長狀況良好的處于指數生長期的200 mL藻液以1∶10的比例接入預先配好的培養基中。培養基中氮磷比的設置以Redfield比值為基礎,設置硝氮濃度為883 μmol·L-1,調整培養液中的磷酸鹽濃度,使得氮磷比分別為4∶1、16∶1、40∶1和80∶1。
取樣分析:連續培養20 d,隔天定時(上午9:00)取樣,每組實驗設三個平行樣[37-38]。測定培養液的pH值、DIC濃度、球形棕囊藻細胞密度以及DMS、DMSP和AA的含量。
1.2 測定方法
pH的測定 利用Fisher-AR15 pH計和Ross-8102 pH電極對藻液pH(NBS標度)進行測定,儀器的精度為:±0.002,并根據溫度進行校正。
DIC的測定 采用溶解無機碳分析儀(AS-C2型,美國Apollo科技公司)進行測定,再根據美國Scripps海洋研究所生產的CRMs標準海水進行標定,精密度為0.1%。
藻細胞密度的測定 取5 mL藻液搖勻,用Lugol試劑對藻細胞固定、染色,然后用光學顯微鏡(CX31,日本Olympus公司)進行計數,每個樣品做三個平行樣,取其平均值換算為相應的藻細胞密度(藻細胞密度=藻細胞數目×104cells·mL-1)[39]。
DMS的測定 用無菌注射器取2 mL藻液于潔凈干燥的10 mL血清瓶中加蓋密封。用高純氮氣對樣品進行吹掃,定時3 min,樣品中的DMS被吹出后經Nafion干燥管進行干燥,然后于浸沒在液氮冷阱中的捕集管中富集。吹掃結束后,把捕集管取出迅速放入熱水浴(溫度>80℃)中進行加熱解析,使得載氣將捕集管中的DMS氣體攜帶進入氣相色譜儀(GC-6850,美國安捷倫公司),經FPD檢測器進行檢測[40]。此方法的檢出限為0.4 nmol·L-1,精密度為5%[41]。
DMSP的測定 DMSP在pH>13的強堿條件下按1∶1的比例完全裂解為DMS和AA,所以可通過測定DMS的濃度間接測定藻液中的DMSP的濃度[42]。取2 mL的藻液,經玻璃纖維濾膜(Whatman GF/F,0.7 μm)減壓過濾(壓力<5 kPa),過濾后的濾膜用于顆粒態DMSP(DMSPp)的測定,濾液用于溶解態DMSP(DMSPd)的測定。將濾膜置于42 mL的棕色瓶中,向瓶內加入2 mL 10 mol·L-1的NaOH溶液,加高純水至無頂空,并置于冰箱冷藏保存24 h以上;在含有濾液的棕色瓶中加入40 μL 50%的濃硫酸冷藏保存24 h后,向瓶中加入2 mL 10 mol·L-1的NaOH溶液,加高純水至無頂空,冷藏保存24 h后,此時DMSP完全堿解為DMS,然后根據測定DMS的方法間接測定藻液中的DMSPp和DMSPd。
AA的測定 將藻液經孔徑為0.2 μm的聚醚砜濾器過濾,密封冷藏保存。用高效液相色譜儀(L-2000,日本日立公司)測定[43],流動相為0.35%的磷酸溶液和甲醇,采用流速為0.5 mL·min-1的微量進樣針,通過柱溫為40 ℃的Agilent SB-Aq-C18柱,用檢測波長為210 nm的紫外檢測器進行檢測。此方法的檢出限為4 nmol·L-1,精密度為1.3%~1.6%[44]。
1.3 統計分析
采用SPSS 16.0軟件中無重復雙因素方差分析法對不同氮磷比條件下的藻細胞密度、DMSP、DMS和AA含量進行顯著性差異分析。
2 結果與討論
2.1 不同氮磷比培養液對球形棕囊藻光合作用的影響
通過分析穩定期前(0~8 d)球形棕囊藻培養液的DIC和pH變化,探討不同氮磷比對球形棕囊藻光合作用的影響。DIC和pH相鄰兩次取樣的差值記為ΔDIC和ΔpH。培養體系初始DIC是2 100 μmol·kg-1,pH是8.10。除80∶1組外,各組ΔDIC均呈現先上升后下降的趨勢(見圖1)。而各組在2~8 d內ΔpH總體呈現上升的趨勢(見圖2)。各組單位時間DIC吸收量由大到小依次為:80∶1(147 μmol·kg-1·d-1)>16∶1(60 μmol·kg-1·d-1)>40∶1(57 μmol·kg-1·d-1)>4∶1(54 μmol·kg-1·d-1),而單位時間pH提升量由大到小依次為:4∶1(0.13 d-1)>40∶1/80∶1(0.08 d-1)>16∶1(0.06 d-1)。不同培養組之間,隨氮磷比增加單位時間DIC吸收量呈現不同程度的增加(1.11倍;1.06倍;2.72倍);而單位時間pH提升量呈現不同程度的減少(53.8%;38.5%;38.5%)。氮和磷作為重要的營養成分,對藻類的生理生化過程起著重要作用。適當增加營養鹽的濃度可以促進藻類對DIC的吸收,提升海水的pH,這與國內外的研究報道是一致的。已有大量研究發現,氮磷濃度增加對石莼[34-35]、龍須菜、孔石莼、海帶[45]以及滸苔[46]等的生長和光合固碳能力具有促進作用,而氮加富的促進能力強于磷,會提高藻類的最大光合作用速率,從而增強其對DIC的吸收能力。

圖1 不同氮磷比條件下球形棕囊藻的ΔDIC變化
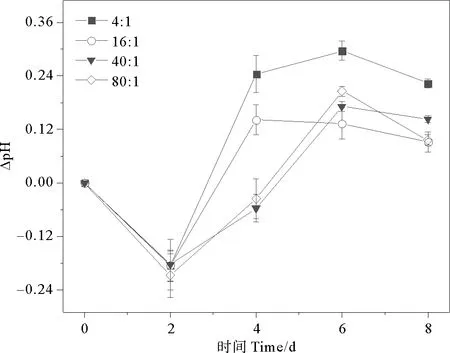
圖2 不同氮磷比條件下球形棕囊藻的ΔpH變化
2.2 不同氮磷比對球形棕囊藻生長狀況的影響
在氮磷比為4∶1、16∶1、40∶1和80∶1條件下,球形棕囊藻的細胞密度總體變化范圍為(60~285)×104cells·mL-1。各組藻細胞密度平均值分別為(138±48、201±74、187±72和156±55)×104cells·mL-1。隨培養時間的增加,藻細胞密度呈現出先升高后降低的變化趨勢(見圖3)。四組氮磷比之間存在有明顯差異(P<0.05)。當氮磷比為16∶1和40∶1時,細胞密度達到峰值的時間相對延長,分別為第10和16天,其峰值分別為285×104和264×104cells·mL-1,大于其余兩組。當氮磷比為4∶1和80∶1時,藻細胞密度峰值相對較低,這可能是由于氮和磷濃度過低降低藻細胞的光合作用能力,阻礙藻細胞內谷氨酸、半胱氨酸絡合形成螯合物的過程[47],從而影響藻類生長。當氮磷比為40∶1時,藻細胞密度在衰亡期降低幅度較大,這與朱蓉等[37]的研究結果一致,在超過最適宜的氮磷比(16∶1)后,過量吸收氮不利于藻細胞的生長[48]。
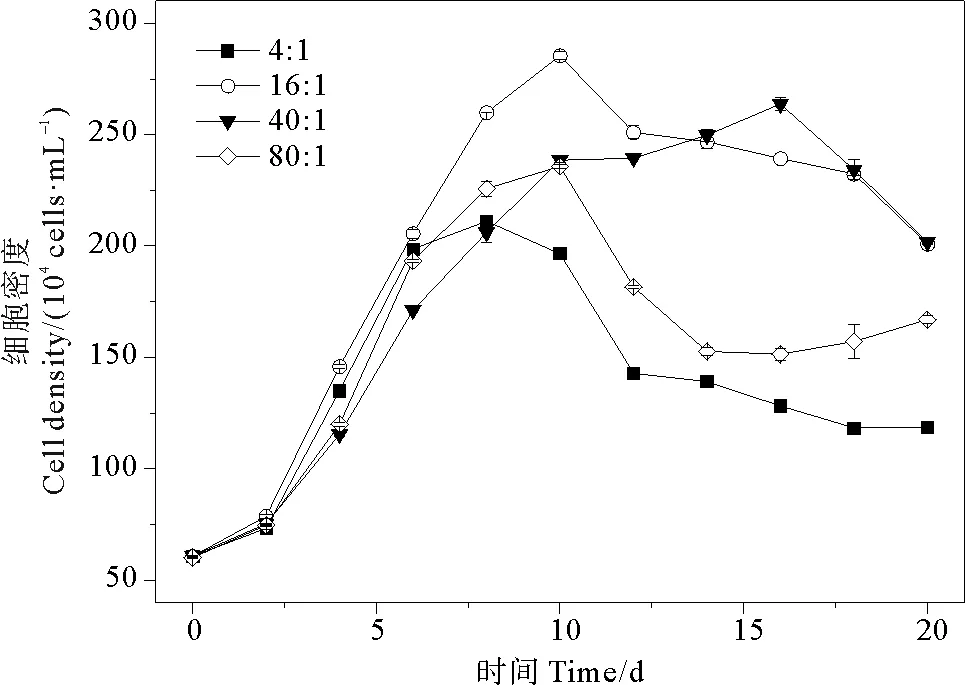
圖3 不同氮磷比條件下球形棕囊藻的細胞密度變化
2.3 不同氮磷比對球形棕囊藻釋放生源硫化物的影響
2.3.1 DMSPd 培養液中單位細胞DMSPd濃度的變化范圍為0.034~0.543 fmol·cell-1。氮磷比為4∶1、16∶1、40∶1和80∶1條件下DMSPd的平均值分別為(0.235±0.133)、(0.165±0.158)、(0.128±0.150)和(0.148±0.101)fmol·cell-1,組間無明顯差異(P>0.05)。DMSPd濃度變化的趨勢為先穩定在較低值,后迅速增加至峰值,再降低至較低值,生長后期再升高(見圖4)。DMSPd濃度的峰值出現在指數生長期或穩定期。DMSPd濃度增加的原因可能是在指數生長期細胞活性強,光合作用產生的DMSPd釋放到水體中;在生長后期細胞破裂,釋放出儲存在胞內的DMSP。不同氮磷比條件下,球形棕囊藻的單位細胞DMSPd濃度達到峰值的時間不同。當氮磷比為4∶1、16∶1、40∶1和80∶1時,分別在第8、8、6和12天達到最大值,最大值分別為0.480、0.421、0.543和0.348 fmol·cell-1。藻細胞培養液中的DMSPd主要由于細胞內的DMSP的自然滲透或細胞衰老分解而得到,所以DMSPd的變化主要取決于細胞內DMSP的生產能力[49]。
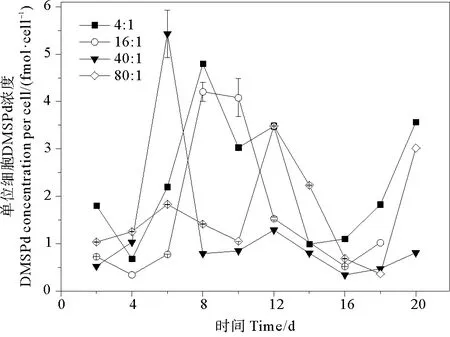
圖4 不同氮磷比條件下球形棕囊藻單位細胞DMSPd濃度的變化
2.3.2 DMSPp 培養液中單位細胞DMSPp的變化范圍為0.393~2.741 fmol·cell-1。氮磷比為4∶1、16∶1、40∶1和80∶1條件下DMSPd的平均值分別為(1.515±0.559)、(1.515±0.680)、(1.347±0.516)、(1.367±0.596)fmol·cell-1,組間無明顯差異(P>0.05)。相比于DMSPd,DMSPp與球形棕囊藻細胞密度變化趨勢更相近,都是先升高后降低,生長期后期小幅升高(見圖5)。DMSPp濃度的峰值出現在指數生長期后期或穩定期。當氮磷比為16∶1時,DMSPp在第12天出現峰值2.741 fmol·cell-1,明顯高于其他氮磷比條件下DMSPp的最大值。這說明磷和氮需要滿足一定比例才會促進細胞產生DMSPp,在本研究中當氮磷比為16∶1時會最大程度產生DMSPp。在DMSPp合成過程中,球形棕囊藻細胞生長對磷需求較高,磷直接參與光合作用的各個環節,包括光能吸收與碳同化、卡爾文循環以及對一些酶的活性調節等[50]。
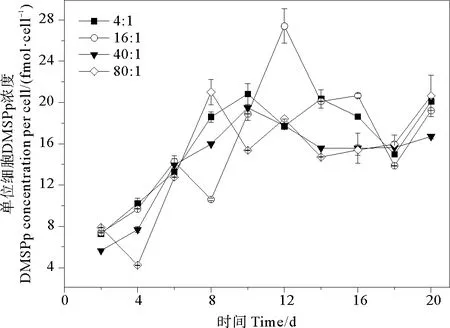
圖5 不同氮磷比條件下球形棕囊藻單位細胞DMSPp濃度的變化
2.3.3 DMS 培養液中單位細胞DMS濃度的變化范圍為0~0.038 fmol·cell-1。氮磷比為4∶1、16∶1、40∶1和80∶1條件下DMS的平均值分別為(0.016±0.013)、(0.013±0.015)、(0.018±0.017)、(0.013±0.012)fmol·cell-1,組間無明顯差異(P>0.05)。在生長早期單位細胞釋放的DMS很少,在指數生長期后期迅速增加,穩定期或衰亡期前期達到峰值后又迅速減少(見圖6)。不同氮磷比條件下,DMS的最大值均出現在穩定期(第14天),最大值分別為0.034、0.038、0.038和0.033 fmol·cell-1。氮磷比16∶1組和40∶1組的DMS濃度峰值較高,而這兩組的藻細胞密度也比另外兩組高,說明球形棕囊藻DMS釋放與藻類生長狀況有關。DMS釋放量在不同生長時期內的變化趨勢同時會受到DMSP濃度和DMSP裂解酶活性的影響,而DMSP裂解酶活性與藻細胞密度存在高度的相關性[51]。在穩定期和衰亡期前期,藻細胞密度達到峰值,細胞死亡破裂釋放DMSP裂解酶裂解DMSP,使其轉化為DMS從而導致DMS釋放量增加[52]。
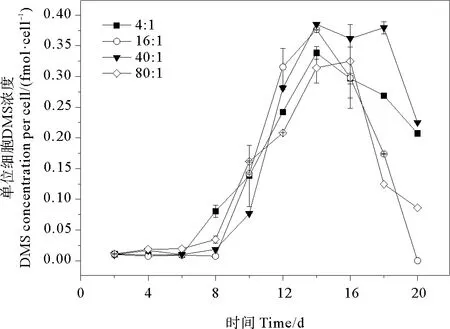
圖6 不同氮磷比條件下球形棕囊藻單位細胞DMS變化
2.3.4 AA 培養液中單位細胞AA濃度的變化范圍為0.150~2.949 fmol·cell-1。氮磷比為4∶1、16∶1、40∶1和80∶1條件下AA的平均值分別為(1.053±0.567)、(1.840±0.842)、(1.771±0.247)、(1.368±0.842)fmol·cell-1,組間存在有明顯差異(P<0.05)。AA呈現出先升高再降低又升高,衰亡期再降低的趨勢(見圖7)。通常情況下,藻類釋放AA的濃度在生長后期達到最大值[19]。Yang等[16]調查發現球形棕囊藻藻華初期水體內含AA,但進入衰亡期后迅速降低至檢出限以下。Davidson等[53]研究發現細菌會侵入衰亡期的微藻,僅在指數生長期的水體內檢出AA。然而Noordkamp等[12]在無菌環境下培養球形棕囊藻,發現在衰亡期AA產生速率增加,藻細胞內AA濃度高于培養液,表明球形棕囊藻在衰亡期沒有檢出AA是由于細菌消耗而不是沒有產生。球形棕囊藻單位細胞釋放的AA對不同氮磷比變化較為敏感。本研究中當氮磷比為4∶1、16∶1時釋放的AA含量均在穩定期達到最大值,原因在于藻細胞破裂釋放DMSP裂解酶,引起DMSP大量裂解,導致AA濃度增加。另外,細胞內AA會被吸附在藻細胞內部的粘液層,當細胞破裂AA釋放到培養液中,AA濃度隨之增加。當氮磷比為16∶1時,AA釋放量在第12天達到最大值2.949 fmol·cell-1,與Gibson等[17]測定的夏季南極洲球形棕囊藻AA含量(9.76 fmol·cell-1)為同一數量級。當氮磷比為4∶1和16∶1時,AA釋放量整體上隨著氮磷比的升高而升高。當氮磷比為40∶1時,AA在整個生長周期內波動較小。而當氮磷比為80∶1時,AA濃度比16∶1和40∶1組小。這是由于磷濃度過低,影響了微藻的光合作用[12],從而抑制了AA的產生。由氮磷比和球形棕囊藻單位細胞AA濃度的關系可看出,當氮磷比小于16∶1時,兩者成正比關系;當氮磷比大于16∶1時,兩者不存在線性關系。
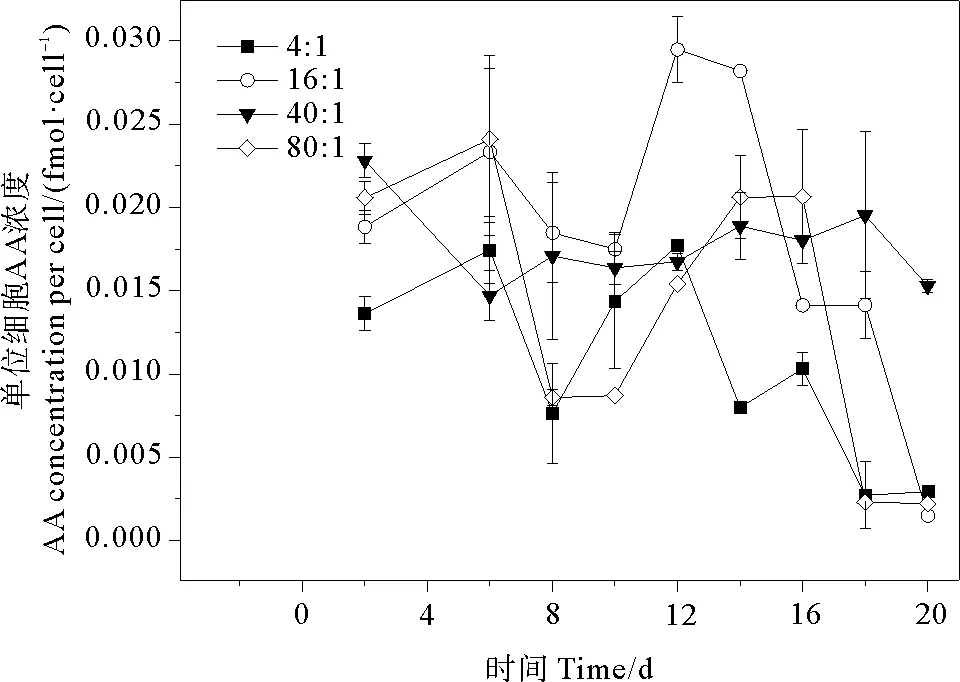
圖7 不同氮磷比條件下球形棕囊藻的單位細胞AA變化
2.4 不同氮磷比對球形棕囊藻DMSP降解途徑的影響
2.4.1 DMS/AA 由DMSP兩種降解途徑可知,DMS/AA表示為DMSP酶裂解途徑占兩種降解途徑中的比例。DMS/AA的總體變化范圍為0.51%~26.53%。氮磷比為4∶1、16∶1、40∶1和80∶1條件下AA/(DMSP+AA)比值分別為0.82%~26.53%、0.51%~20.46%、1.01%~21.25%、0.80%~21.10%,平均值分別為(9.97±7.94)%、(8.21±7.21)%、(9.66±7.82)%、(10.58±7.77)%。球形棕囊藻的DMS/AA在指數生長期呈現上升趨勢,穩定期達到峰值,在衰亡期下降,與藻類生長曲線相似(見圖8)。當氮磷比為4∶1和16∶1時,DMS/AA比值的最大值出現在第16天,分別為26.53%和20.46%。當氮磷比為40∶1和80∶1時,DMS/AA比值的最大值較另外兩組提前(第14天),且出現兩個峰值。在整個生長周期中,DMSP降解途徑各不相同,指數生長期前期DMS/AA較小,DMSP的去甲基化途徑為主要途徑。隨著藻細胞密度增加,DMSP酶裂解途徑也增加。在穩定期和衰亡期前期,細胞死亡破裂釋放裂解酶,DMSP酶裂解途徑達到最大但仍不是主要的降解途徑,此時DMS/AA達到峰值。Liu等[54]研究發現,海洋原甲藻、大洋橋石藻和亞心形扁藻的DMS/AA比值在整個生長期中均小于25%,表明DMS的酶裂解途徑不是DMSP的主要降解途徑。
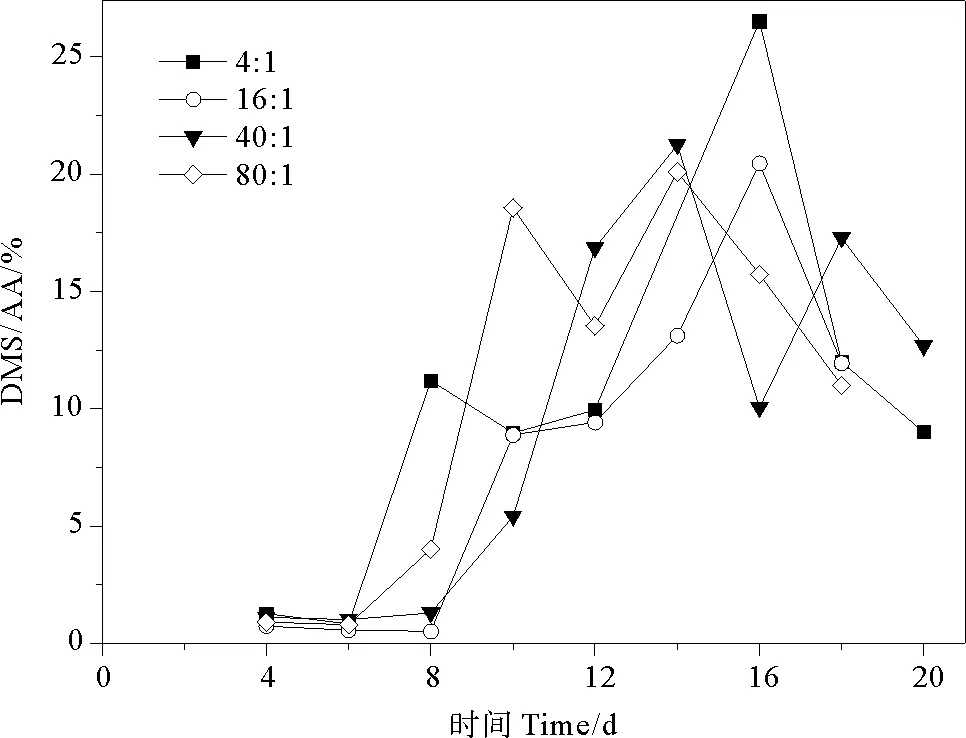
圖8 不同氮磷比條件下球形棕囊藻的DMS/AA變化
2.4.2 DMS/(DMSP+AA) DMS代表DMSP通過酶裂解方式的含量,(DMSP+AA)代表DMSP已裂解和未裂解含量的總和,因而DMS/(DMSP+AA)表示為酶裂解途徑產生DMS所占百分比。DMS/(DMSP+AA)的總體變化范圍為0.25%~11.89%。氮磷比為4∶1、16∶1、40∶1和80∶1條件下AA/(DMSP+AA)比值分別為0.36%~8.13%、0.25%~8.95%、0.34%~11.16%、0.41%~11.89%,平均值分別為(3.43±2.96)%、(4.10±3.57)%、(5.14±4.24)%、(5.05±4.67)%。球形棕囊藻的DMS/(DMSP+AA)在指數生長期前期穩定在低值后期迅速上升,穩定期達到峰值,在衰亡期下降,與DMS變化曲線相似(見圖9)。當氮磷比為40∶1和80∶1時,第8~14天DMS/(DMSP+AA)比值迅速增加至峰值(0.60%~11.16%、0.99%~11.89%),其他兩組變化相似但幅度較小。由于受到DMSP濃度和DMSP裂解酶活性的影響,DMS產生所占百分比在不同生長時期內的變化與藻細胞密度密切相關[51]。Tan等[55]研究夏季長江口及鄰近海域時發現,該地區DMS/(DMSP+AA)的平均比值小于20%,說明DMS產生過程是DMSP降解的次要途徑,與本研究結果一致。
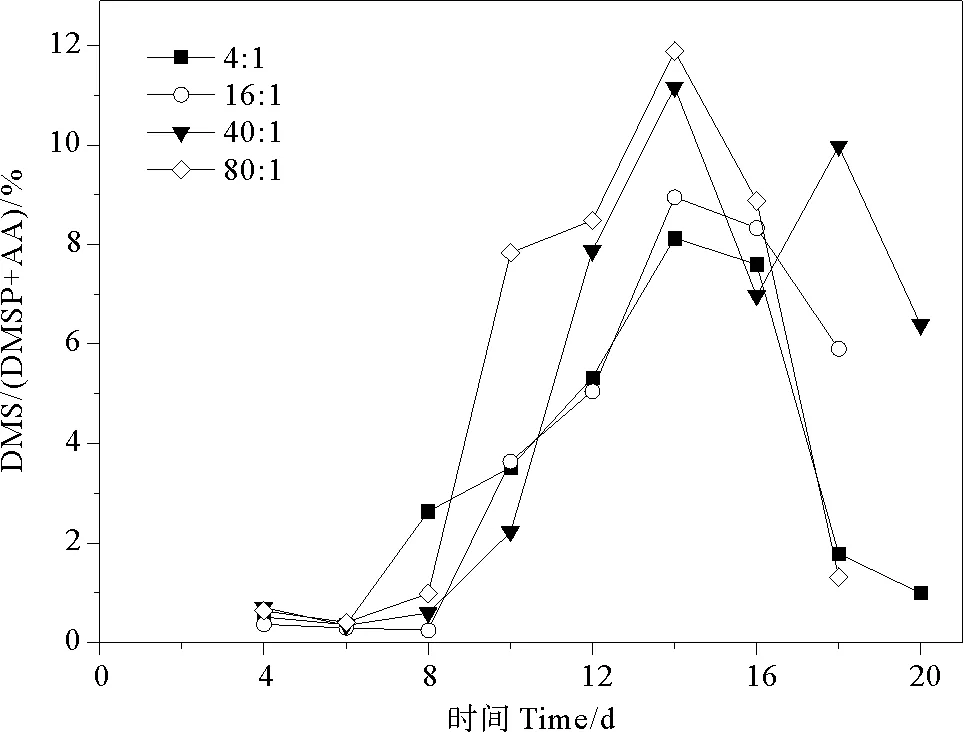
圖9 不同氮磷比條件下球形棕囊藻的DMS/(DMSP+AA)變化
2.4.3 AA/(DMSP+AA) AA代表DMSP通過兩種降解途徑的含量,AA/(DMSP+AA)表示為DMSP表觀降解百分比。AA/(DMSP+AA)的總體變化范圍為6.02%~70.04%。氮磷比為4∶1、16∶1、40∶1和80∶1條件下AA/(DMSP+AA)比值分別為11.03%~53.50%、6.02%~68.19%、33.87%~69.34%、8.10%~70.04%,平均值分別為(32.22±13.95)%、(45.71±16.91)%、(51.15±11.00)%、(42.86±22.73)%。球形棕囊藻的AA/(DMSP+AA)在指數生長期前期先下降,再升高至穩定期達到峰值,后在衰亡期下降(見圖10)。當氮磷比為16∶1和40∶1時,DMSP降解百分數較高。當氮磷比為16∶1和40∶1時,AA/(DMSP+AA)比值的最大值出現在第14和16天,分別為68.19%和69.34%。當氮磷比為4∶1和80∶1時,AA/(DMSP+AA)的最大值較另外兩組提前(第12天),且峰值較小(53.50%和62.64%)。不同氮磷比可能對酶的活性和含量以及初始DMSP濃度產生影響,從而導致DMSP表觀降解百分比的不同。Liu等[56]研究冬季黃渤海海域時發現,該區域AA/(DMSP-AA)平均比值為53.98%,與氮磷比為40∶1組結果接近。
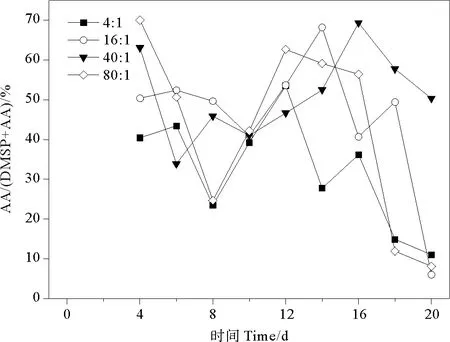
圖10 不同氮磷比條件下球形棕囊藻的AA/(DMSP+AA)變化
3 結語
不同氮磷比對球形棕囊藻光合作用、生長狀況、釋放生源硫化物以及DMSP降解途徑會產生影響。氮磷比為80∶1時,培養液中單位時間DIC吸收量最大(147 μmol·kg-1·d-1);而氮磷比為4∶1時,單位時間pH提升量最大(0.13 d-1)。氮磷比為16∶1和40∶1時,最大藻細胞密度較高(285×104和264×104cells·mL-1),且穩定生長期相對延長。氮磷比為40∶1時,培養液中單位細胞DMSPd和DMS濃度達到峰值(0.543和0.038 fmol·cell-1);氮磷比為16∶1時,DMSPp、DMS和AA濃度達到峰值(2.741、0.038和2.949 fmol·cell-1)。氮磷比為4∶1時,DMS/AA達到峰值26.53%,DMSP酶裂解途徑占比最大。氮磷比為80∶1時,DMS/(DMSP+AA)達到峰值11.89%,DMS生產百分比最大。氮磷比為40∶1時,AA/(DMSP+AA)達到峰值69.34%,總DMSP降解率最大。總體而言,16∶1是球形棕囊藻釋放含硫化合物的最佳氮磷比值,不同氮磷比條件會影響DMSP降解途徑。

