JAK2/STAT3信號通路活化參與DEN誘導的小鼠原位肝癌
李文君,裴少非,鄒其虎,何 旎,婁嘉豪,曾廣智
(云南民族大學 民族醫藥學院,民族藥資源化學國家民委-教育部重點實驗室,云南 昆明 650500)
肝細胞癌(HCC)是常見的消化道惡性腫瘤之一,在全球癌癥致死原因上男性排名第2,女性排名第6.過去的30年中,中國貢獻了超過一半的全球肝癌的新病例和死亡患者[1].了解肝癌的發病過程,建立與人類肝癌發生機制相似的動物模型意義重大,且能為肝癌的預防和治療提供重要的依據和策略[2-3].目前原位肝癌動物模型主要采用化學誘導法,因其操作簡單、成癌率高以及對肝臟專一等原因應用較為廣泛,其中又以二乙基亞硝胺(DEN)為化學誘導劑最為常見.DEN誘導原位肝癌效果較好,誘變經歷了肝臟的中毒性炎癥-纖維化-硬化-癌變過程,與人類發病十分相似,被廣泛用于構建原位肝癌實驗動物模型[3-6].DEN誘導發生肝癌與劑量及給藥時間關系密切,可通過多次給藥SD大鼠或C57BL/6小鼠而造成動物肝癌模型.在此過程中大劑量給DEN能縮短造模時間,但容易造成中途動物死亡率增加;小劑量給藥雖然降低了死亡率,但造模時間過長且成瘤率降低,所以適合的給藥劑量是造成動物原位肝癌模型的重要因素.
JAK2/STAT3信號通路是一條與細胞的生長、分化、凋亡、免疫調節等功能密切相關的信號途徑,在多種生理及病理過程中扮演了重要角色[7-10].JAK2與STAT3蛋白正常情況下都定位于細胞質中,信號通路接受到外界應激信號后,JAK2蛋白被激活,進而激活STAT3蛋白,使其轉位進入細胞核內與特定的DNA序列結合,從而調控下游基因轉錄,引起多種生物學效應[11].研究發現,JAK2/STAT3信號通路的持續性激活與腫瘤的發生發展密切相關,JAK2和STAT3蛋白在多種癌細胞中異常表達,該通路的異常活化能加速腫瘤細胞的增殖和惡性轉移,促進腫瘤組織內新生血管生成,并抑制癌細胞凋亡[12].為了建立適用于本實驗室的動物肝癌模型,文中采用DEN誘導C57BL/6小鼠,通過優化給藥劑量,在20周內造成了小鼠原位肝癌,并通過免疫組化技術探討了JAK2/STAT3通路在DEN誘導的小鼠原位肝癌過程中的變化情況,為我們后續關于JAK2/STAT3通路抑制劑對小鼠原位肝癌的治療作用研究打下了基礎.
1 材料與方法
1.1 實驗動物及分組
C57BL/6小鼠44只,年齡6~7周,體重(18±1)g,由湖南斯萊克景達實驗動物有限公司提供(許可證號:SCXK(湘)2019-0004).將小鼠4只一籠,隨機分為給藥組(32只)和對照組(12只),飼養于恒溫(22~23)℃、12 h明/12 h暗的SPF級動物房,飼料為北京科澳協力飼料有限公司生產,自由飲食,所有實驗程序均符合云南民族大學動物實驗倫理委員會的要求許可.
1.2 主要儀器及試劑
微孔板檢測器SpectraMax i3x型(Molecular Devices,美國);萊卡病理切片系統(Leica,德國);倒置顯微鏡DMi8型(Leica,德國);4 ℃ 冰箱(美菱,中國);低溫高速離心機5424R型(Eppendorff,德國);純水機(Millipore,美國).二乙基亞硝胺(TCI,日本);丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)微板法測試盒(南京建成);蘇木素伊紅(HE)染色試劑盒(索萊寶);JAK2和STAT3一抗(Proteintech,美國);小鼠/兔聚合物法檢測系統通用試劑盒、DAB顯色試劑盒(中杉金橋).
1.3 實驗方法
小鼠適應性飼養 7 d 后,給藥組腹腔注射 50 mg/kg 的DEN對照組注射等量生理鹽水,2次/周(即1次/84 h)連續4周,4周后1次/周連續給藥16周,共計20周.期間密切觀察實驗動物精神狀態、飲食狀況、被毛變化,同時記錄動物體重數據.
1.4 樣本收集及病理檢測
分別在第2、4、6、8、10、12、14、16、18和20周處死給藥組小鼠2只和對照組小鼠1只,收集樣本.眼眶靜脈叢采血,室溫靜置 2 h,1 500 r/min 離心 20 min,吸取上清用于生化指標檢測.小鼠頸椎脫臼處死,解剖觀察肝臟大體形態并拍照,之后取小鼠肝臟于10%中性甲醛中固定,用于組織病理學檢查.組織固定后、脫水、常規石蠟包埋 4 μm 連續切片、HE染色、鏡下觀察肝臟病理改變.各組小鼠血清中ALT和AST采用微板法檢測,實驗步驟按照試劑盒說明書操作.
1.5 免疫組化法檢測肝組織中JAK2和STAT3的表達
石蠟包埋的肝臟組織切片進行脫蠟,水化,高溫高壓法抗原修復 2 min,過氧化氫去除內源性過氧化物酶,10%山羊血清封閉 1 h,JAK2及STAT3一抗(分別1∶2 000、1∶100稀釋)4 ℃ 孵育過夜,二抗室溫 20 min 孵育,DAB顯色 5 min,蘇木素染核 3 min,脫水,中性樹脂封片,顯微鏡拍照分析.
2 結果
2.1 小鼠生理狀態觀察
44只小鼠在20周實驗過程中,對照組無死亡,給藥組死亡8只,死亡時間主要發生在第12周后(第12周死亡1只,第15~16周每周1只,第17周2只,第18~20周每周1只).DEN給藥過程中給藥組小鼠隨著造模時間的增加出現不同程度的食欲和飲水下降,與對照組相比精神狀態差、對外部刺激不敏感、反應遲鈍、毛發雜亂無光澤且脫毛、體重增長緩慢,后期出現體重下降等現象,而對照組生長良好、無死亡情況、精神狀態佳、毛發光澤,體重增長較快.
2.2 小鼠體重及血清生化指標變化
DEN給藥前小鼠體重在(18±1)g,從第4周開始,與對照組小鼠相比較,給藥組小鼠體重增長緩慢且始終低于對照組,指標如圖1所示.從第11周開始,給藥組小鼠體重逐漸下降,在第12周到第16周下降較多.給藥組小鼠的ALT和AST酶活性相比于對照組顯著升高,從第10周開始升高明顯,最高高于對照組20倍,表明給藥組小鼠肝臟受到嚴重損傷,從10周起具有統計學意義(*P,<0.05;**,P<0.01;***,P<0.001;****,P<0.000 1).
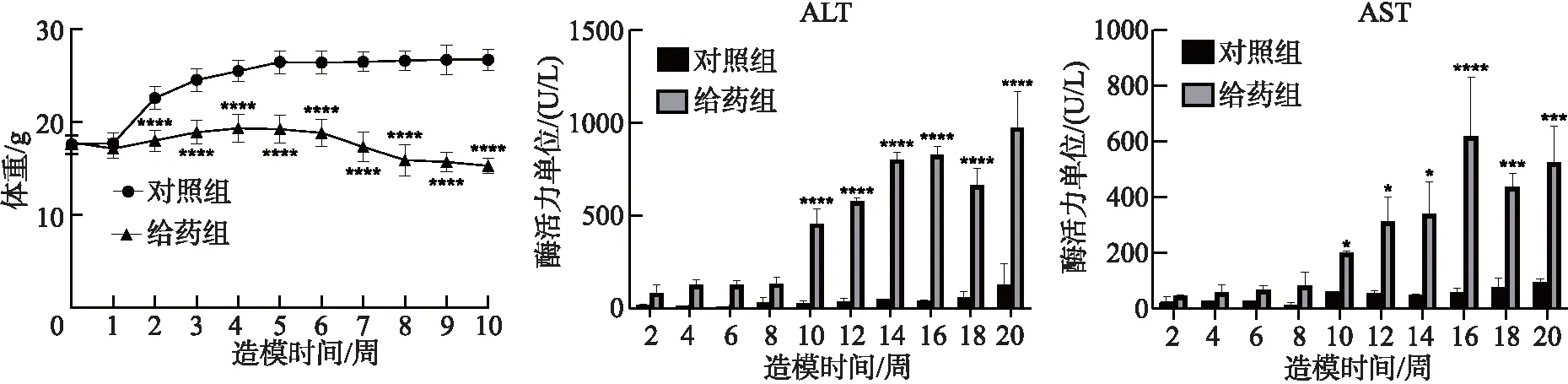
圖1 對照組和給藥組小鼠20內周體重變化情況及小鼠血清ALT和AST活力變化圖
2.3 小鼠肝臟形態及病理組織學變化
肉眼觀察可見:對照組小鼠給藥期間肝臟形態正常,顏色鮮紅,質地柔軟表面光滑無異常.給藥組小鼠2~4周肝組織形狀、顏色、質地正常,與對照組相比未見明顯異常表現;6~8周肝組織表面比較光滑(磨砂狀),顏色變為暗紅,質地較軟;10~12周肝組織表面逐漸變粗糙,出現粟粒狀小結節改變,質地變硬;14~16周肝組織邊緣有小凸起物,表面粗糙且有少量出血點,顏色變為棕黃色,質地略硬,出現少量的透亮結節,結節呈顆粒狀(目測直徑小于 1 mm);18~20周肝組織表面凹凸不平,較粗糙,有血斑和大小不等的多個白色結節結節大約 2 mm,質地硬,切面可見出血壞死.
病理切片觀察可見:對照組小鼠2~20周肝組織中細胞結構正常,細胞核明顯,肝小葉結構清晰,肝索由中央靜脈向四周整齊排列,肝血竇間隙正常,肝小葉及匯管區無炎性細胞浸潤,未見水腫或腫脹的肝細胞,未見壞死的肝細胞,無明顯纖維組織增生或纖維化.給藥組小鼠肝組織2~4周形態結構正常,與對照組相比差異不大.而第6周后給藥組小鼠肝組織出現明顯病變,其肝組織病理改變大概經歷3個階段:(1)肝細胞損傷期,6~10周,局部肝細胞壞死及炎細胞浸潤,肝細胞腫大,并逐漸出現纖維組織增生,但肝小葉結構仍完整;(2)肝細胞增生硬化期:12~16周,肝細胞排列紊亂,細胞核都擠向細胞一側.膽管和門管區有明顯的纖維組織增生,肝小葉包繞著肝細胞結節,形成典型的假小葉,中央靜脈缺失或偏離原來位置,肝索結構變亂,并出現大量壞死的肝細胞和空泡狀的變化;(3)肝細胞成癌期:18~20周,肝細胞結構異常,有明顯不典型增生,肝癌細胞呈多形性,胞核增大,胞質少,排列成條索狀或巢狀,并向周圍正常肝細胞浸潤生長,部分區域可見出血壞死及炎細胞浸潤,組織學類型為肝細胞癌(見圖2).

圖2 小鼠肝臟HE染色結果圖(放大倍數200×)
2.4 JAK2蛋白和STAT3蛋白在肝組織中的表達的相關性
JAK2蛋白定位于細胞質內.免疫組化染色結果顯示,對照組小鼠組織內JAK2蛋白表達較弱,細胞質著色淺(棕色),20周內幾乎無明顯變化;而DEN給藥組小鼠從第6周起,胞質內JAK2著色逐漸變深,表明隨著DEN給藥時間的延長,小鼠肝臟中JAK2蛋白表達水平逐漸增高,呈現明顯的時間-效應關系.JAK2/STAT3信號通路的激活會導致STAT3蛋白的磷酸化并轉位進入細胞核,STAT3免疫組化染色會出現明顯的細胞核陽性染色結果.結果顯示,對照組小鼠肝臟組織內STAT3蛋白表達在20周內無明顯變化,而給藥組小鼠從第10周起開始出現表達增加并呈現明顯轉位入核,且隨著DEN給藥時間的延長,STAT3蛋白入核效應增強,第20周時STAT3蛋白陽性表達的細胞核數量最明顯(見圖3).

圖3 免疫組化檢測JAK2和STAT3蛋白在肝細胞中的表達情況(放大倍數200×)(藍色標記的是細胞核,棕色標記的是目的蛋白)
3 討論
C57BL/6小鼠與人類的遺傳物質具有較高相似度,是研究多種人類疾病的理想實驗動物.考慮到小鼠成本較低、體重小、后期給藥量少,因此我們選用C57BL/6小鼠作為DEN誘導原位肝癌研究的模型動物[13].合適的給藥劑量對造模時間及成癌率都至關重要,文獻報道,DEN腹腔注射造成小鼠原位肝癌的給藥劑量在20~90 mg/kg 不等,成瘤時間在16~42周不等[14-16],考慮到劑量過大造容易成動物中途死亡等因素,采用劑量為 50 mg/kg 的DEN腹腔注射C57BL/6小鼠,在第16周時小鼠出現癌前病變,第20周時形成肝癌.從病理切片觀察可見,應用 50 mg/kg 的DEN對C57BL/6小鼠進行肝癌誘導,小鼠肝臟經歷了肝炎、肝纖維化、肝硬化階段進而形成肝癌,其癌變過程與人類肝癌發生過程一致.期間給藥組小鼠共死亡8只,死亡率25%,在可接受范圍內.考慮到DEN作為一種N-亞硝基類物質,是遺傳毒性致癌物,其毒性較大,后期若用于作為抗肝癌藥物的活性評價模型時,給藥劑量可以根據實驗需求作微量調整.
ALT和AST存在于機體多種細胞中,其中肝細胞含量最多.當肝細胞受損時,ALT和AST被大量釋放入血,導致血清中水平升高,故血清AST和ALT含量或酶活性變化對肝細胞損傷程度有一定的參考價值[17].小鼠血清轉氨酶活性測定結果表明,與對照組相比,DEN給藥小鼠ALT和AST酶活性從第10周起呈現明顯升高(P<0.05),表明隨著給藥時間的延長,DEN導致小鼠肝細胞出現越來越嚴重的損害,與文獻報道一致[18].JAK2是Janus激酶家族成員,參與JAK2-STAT3信號通路,介導多種細胞因子和生長因子的信號傳導,在細胞增殖、分化等活動中起重要作用.正常細胞中JAK2/STAT3通路信號轉導快速且短暫,但在受損和病變的細胞中該通路會呈持續過度的激活狀態[19].小鼠肝臟組織中JAK2和STAT3蛋白的免疫組化研究結果表明,DEN給藥造成了小鼠肝臟中JAK2和STAT3蛋白表達量的顯著增高,且隨著給藥時間的增加表達量也逐漸增多,且STAT3出現明顯的核轉位表達,表明隨著肝細胞的病變,JAK2/STAT3信號通路逐漸被激活,參與并促進了小鼠肝臟炎癥和腫瘤的發生.由于JAK2/STAT3信號在DEN誘導小鼠肝癌中的重要作用,其信號的異常表達有助于將其作為生物標志物對肝細胞癌的病程及進展進行判斷.本研究為DEN誘導的小鼠原位肝癌模型研究提供了理論支持,也能為后續關于JAK2/STAT3信號通路抑制劑對小鼠原位肝癌的治療作用研究提供指導.

