PSMA-CAR慢病毒顆粒包裝濃縮及感染CIK細胞的研究*
王丙萍,段金凱,高鳳英,高艷偉,高維實
010017 呼和浩特,內蒙古自治區人民醫院 腫瘤研究所(王丙萍),腹部腫瘤外科(高艷偉、高維實);010070 呼和浩特,內蒙古建筑職業技術學院 公共課教學部(段金凱);010010 呼和浩特,內蒙古醫科大學 臨床醫學院(高鳳英)
惡性腫瘤無論是在發生時還是在發展時都與宿主的免疫狀態密切相關,而抗腫瘤免疫主要為細胞免疫。近年來,利用基因改造技術表達腫瘤特異性嵌合抗原受體(chimeric antigen receptor,CAR)的T細胞治療技術在腫瘤治療方面的研究進展迅猛,其在體內、體外和臨床試驗中均顯示出良好的靶向性、殺傷性和持久性,為解決過繼性細胞免疫治療的局限提供了新的有效方案,并且展示了巨大的發展前景和應用潛力[1]。CAR技術不僅僅只是修飾T細胞,它還可以修飾CIK細胞、NK細胞以及γδT細胞等[2-4]。
前列腺癌是危害老年男性健康的常見癌癥之一。前列腺特異性膜抗原(prostate specific membrane antigen,PSMA)是一種比前列腺特異性抗原更具敏感性和特異性的前列腺癌標記物[5],目前已經被公認為是前列腺癌基因治療中最具有意義的抗原及靶點。
病毒載體可以有效地將目的基因整合進靶細胞基因組,并且穩定表達,被認為是最有希望的基因治療載體且較為常用[6]。相較于其它病毒載體,慢病毒載體具有致癌風險低、隨機整合基因風險低、生產成本相對較低[7-8]以及高效轉導非分裂細胞等特點,是安全有效且靈活制備CAR相關細胞的最佳選擇[9]。為了臨床實驗或后期基因功能研究,獲得高滴度的病毒以及高的感染效率是十分必要的。因此,本研究通過比較不同條件下PSMA-CAR慢病毒顆粒感染CIK細胞的效率,探討PSMA-CAR慢病毒顆粒的最佳濃縮方法以及提升感染CIK細胞效率的方法。
1 材料與方法
1.1 實驗材料
人胚腎細胞株HEK-293FT細胞購自中國科學院上海細胞所;慢病毒載體 PSMA-CAR為前期實驗構建保存;空載體 PCDH-CAR(SBI,日本);包裝質粒 PsAX2、OG(華西病理重點實驗室惠贈)。質粒小提試劑盒(OMEGA,美國);聚乙烯亞胺(Polyethylenimine,PEI)(Ploysciences,美國);DMEM高糖培養基、胎牛血清(fetal bovine serum, FBS)、胰酶、opti-MEM 培養液(Gibco,美國);超濾管Millipore 100 kDa(Merck,德國);聚凝胺(Polybrene;Solarbio,中國);熒光標記單克隆抗體CD3-FITC、CD8-FITC、CD56-PE(BD,美國)。
1.2 實驗儀器
二氧化碳培養箱及生物安全柜(Thermo,美國);倒置熒光顯微鏡(Leica,德國);FACSCalibur流式細胞儀(BD,美國);高速離心機(Eppendorf,德國);超速離心機(Beckman,美國);超凈工作臺(蘇州泰安空氣技術有限責任公司,中國)。
1.3 實驗方法
1.3.1 慢病毒包裝 將HEK-293FT細胞以1~2×106個/孔的密度接種于10 mm培養皿中,培養液為10%FBS+DMEM高糖,37℃、5% CO2培養箱中培養過夜。病毒包裝前用新鮮預熱的DMEM高糖培養基換液,繼續培養2 h。以空載體PCDH-CAR(空載體)作為陽性對照,PSMA-CAR慢病毒載體的用量為20 μg,慢病毒包裝質粒PsAX2和OG的用量為各10 μg。將2 mg/mL的PEI溶液于60 ℃水浴5 min,溶解后放至室溫,將三種質粒和PEI溶液(質粒總量∶PEI的比例為1∶9)分別加入到opti-MEM培養液中,每管溶液總量為1.5 mL,輕輕混勻,在室溫下放置5 min;將含有PEI的opti-MEM培養液緩慢加入到含質粒的培養液中,輕輕混勻,室溫放置20 min,將混合液輕柔逐滴加入到10 mm培養皿中,輕輕混勻,于37 ℃、5%CO2培養箱中培養6 h后更換為含10%FBS的DMEM高糖培養液,培養24 h后用倒置熒光顯微鏡觀察熒光情況,并用流式細胞儀檢測轉染效率。
1.3.2 慢病毒顆粒的濃縮 收集48 h及72 h的HEK-293FT轉染細胞的上清培養液,4 ℃、3 000 rpm,低速離心10 min,將上清用0.45 μM濾膜進一步去除細胞碎片。此后分3種方法濃縮病毒顆粒:1)超速離心法:將過濾后的培養液分裝在無菌干燥的超速離心管中,放置于超速離心機中4 ℃、30 000 rpm,離心3 h。離心完成后棄培養液,加入300 μL的培養液,在4 ℃下溶解沉淀物6 h,每小時輕輕震蕩離心管數次,100 μL/管分裝并凍存于-80 ℃;2)超濾管濃縮法:將過濾后的培養液分裝在無菌干燥的超濾管中,每管13 mL,于4 ℃,5 000 g離心35 min,將濾膜上方剩余液體分裝100 μL/管,凍存于-80 ℃;3)PEG-8000濃縮法:將過濾后的培養液30 mL加入5×PEG-8000+NaCl母液7.5 mL,放于4 ℃,每20~30 min混合一次,5~6次后,于4 ℃過夜。次日4 ℃,4 000 g離心20 min,棄上清,加入300 μL DPBS溶解病毒,100 μL/管分裝并凍存于-80 ℃。
1.3.3 CIK細胞的培養 健康人靜脈采血15 mL,生理鹽水稀釋1倍,淋巴細胞分離液與血液體積比為1∶2.5的比例分離外周血單個核細胞(peripheral blood mononuclear cell,PBMC)。培養基為GT-551,調整細胞濃度為2×106個/mL,第0天加入干擾素-γ 1 000 U/mL,37 ℃,5%CO2培養箱中培養。第1 d加入100 U/mL的IL-1α,50 μg/mL的CD3單抗,300 U/mL的IL-2。此后每隔2 d加入培養基及300 U/mL的IL-2,調整細胞濃度。FITC-CD3和PE-CD56抗體染色,流式細胞儀鑒定CIK細胞。
1.3.4 慢病毒感染CIK細胞 將培養5~7 d生長狀態良好的CIK細胞接種于12孔板,密度為2×106個/孔,加入濃縮的病毒300 μL/孔,4 ng/mL的聚凝胺。此后分為兩種方法:1)直接放入37 ℃,5% CO2培養箱中培養;2)室溫(26 ℃)、150 g低速離心4 h后再于37 ℃,5% CO2培養箱中培養。感染48 h后通過熒光顯微鏡觀察并通過流式細胞儀檢測感染效率。
1.3.5 流式細胞檢測 1)包裝效率檢測:轉染24 h后,0.25%胰蛋白酶消化轉染后的HEK-293FT細胞。以PCDH-CAR載體轉染后的HEK-293FT細胞為陽性對照,檢測PSMA-CAR載體轉染后的HEK-293FT細胞,陽性細胞發綠色熒光;2)CIK細胞鑒定:CIK細胞培養3~4 d后聚集成團,出現集落;取出部分用DPBS洗滌,移液器將細胞吹散后用熒光標記單克隆抗體染色(CD3-FITC,CD56-PE;CD56-PE,CD8-FITC),洗滌細胞去除游離的熒光抗體后,上機檢測;3)CIK細胞感染效率檢測:慢病毒顆粒感染CIK細胞48 h后,取出部分細胞洗滌,移液器吹散后,用流式細胞儀的熒光素異硫氰酸鹽(fluorescein isothiocyanate,FIT)C通道檢測綠色熒光蛋白(green fluorescent protein,GFP),從而檢測出CIK細胞感染效率。
1.4 統計學方法
應用SPSS 19.0進行數據統計分析,采用單因素方差分析,在P<0.05時被認為差異具有統計學意義。
2 結 果
2.1 PSMA-CAR慢病毒載體的包裝結果
轉染24 h后,可明顯觀察到細胞發綠色熒光(圖1),這說明目的質粒轉染成功,目的基因正常表達。通過流式細胞儀檢測GFP的表達情況(圖2),測定PSMA-CAR慢病毒表達載體轉染效率為67.71%±4.47%,對照組空載體的轉染效率為77.74%±4.98%(F=6.729,P=0.060),兩組之間的差異無統計學意義。

圖1 HEK-293FT細胞包裝慢病毒載體的明場圖和熒光圖
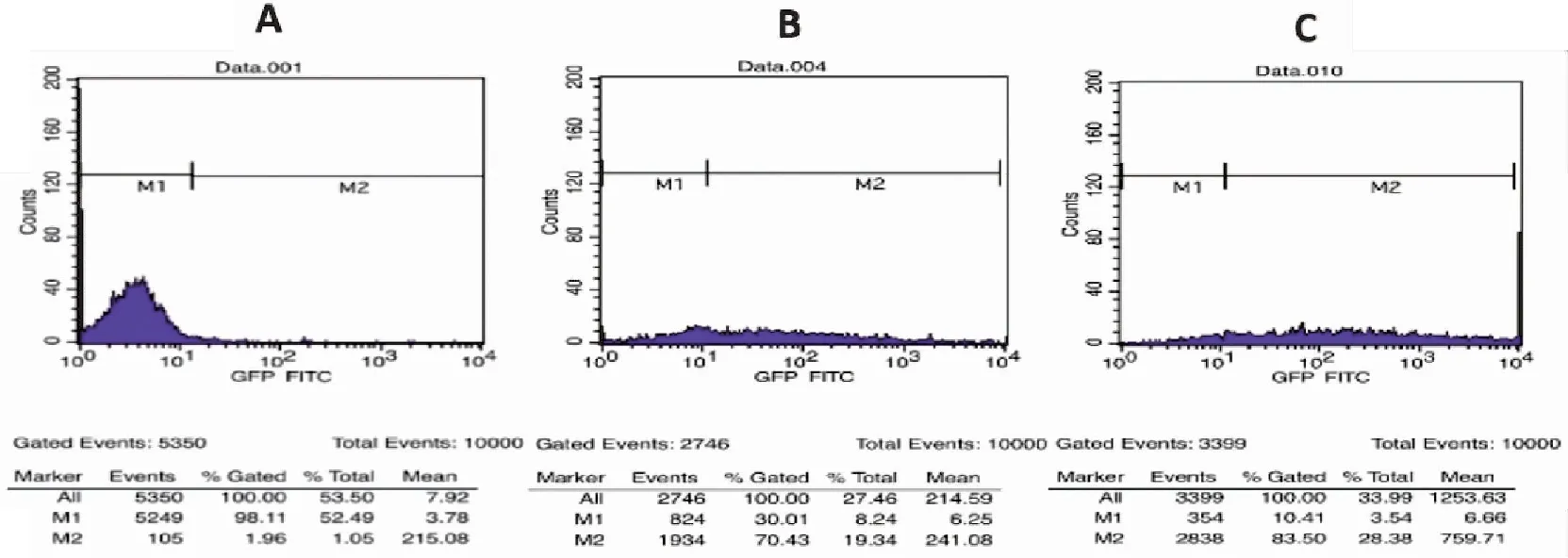
圖2 慢病毒包裝效率檢測流式細胞圖
2.2 CIK細胞的培養結果
健康人外周血分離PBMC后,經細胞因子誘導為CIK細胞,第0 d為散落的顆粒狀細胞,3~4 d后聚集成團,出現CIK細胞集落(圖3)。培養5~7 d,經流式細胞儀鑒定(圖4),CD3+細胞為85.28%±17.67%,CD3+CD56+細胞為22.02%±2.68%,CD8+CD56+細胞為23.09%±6.85%,確定為CIK細胞后,進行下一步的慢病毒感染實驗。

圖3 CIK細胞培養
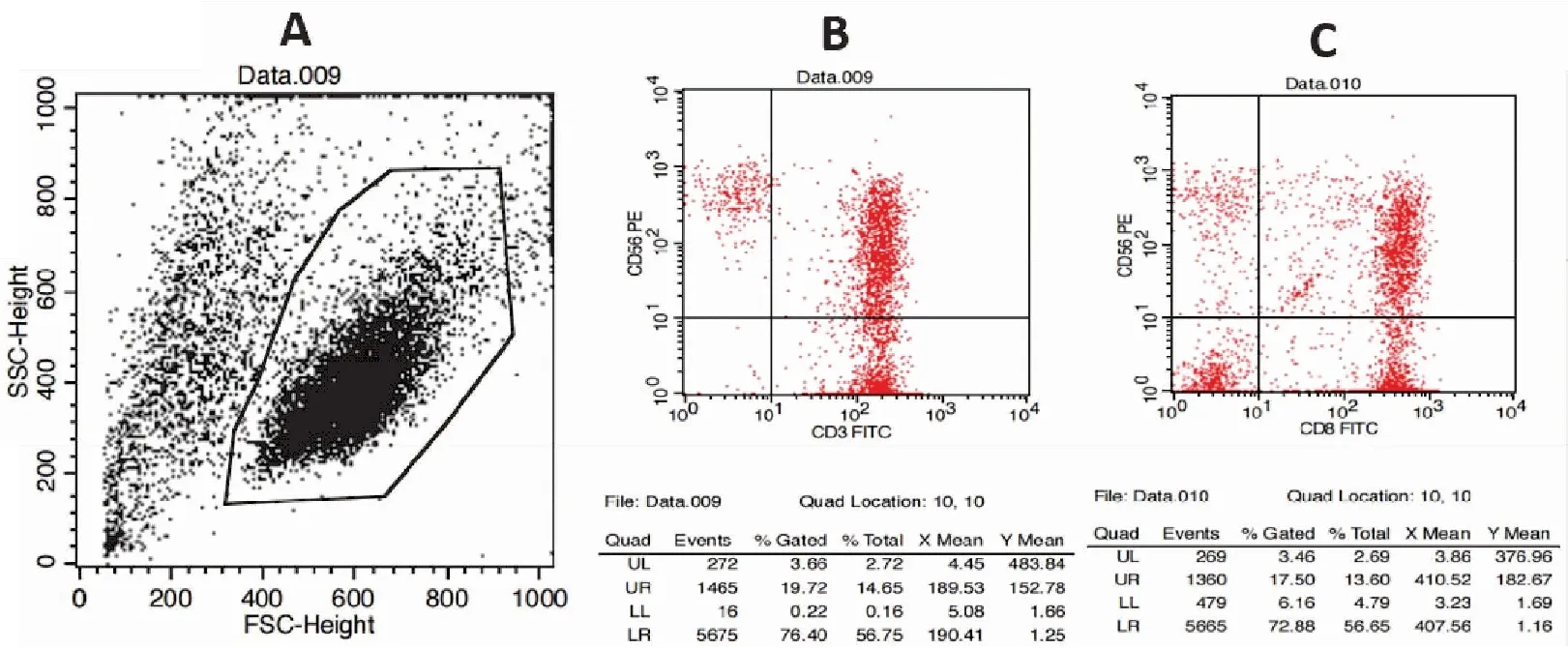
圖4 CIK細胞鑒定
2.3 慢病毒感染CIK細胞不同感染方法的比較
用超速離心法獲得的PSMA-CAR慢病毒濃縮顆粒感染CIK細胞,倒置熒光顯微鏡下觀察結果顯示:無論從CIK細胞的綠色熒光亮度上還是從感染效率上,室溫+長時間低速離心步驟的加入都明顯提高了慢病毒感染CIK細胞的效率(圖5)。流式細胞儀的檢測結果顯示(圖6):未加入離心步驟時,感染效率為2.73%±0.75%,加入離心步驟后,感染效率可達32.04%±1.66%,差異有統計學意義(F=766.84,P<0.01)。
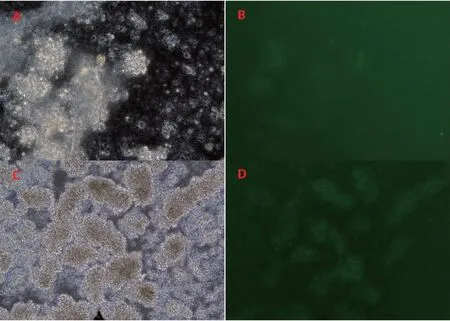
圖5 不同方法感染CIK細胞的明場圖和熒光圖

圖6 不同方法感染CIK細胞的流式細胞比較
2.4 不同方法濃縮的慢病毒顆粒感染CIK細胞的比較
本研究應用了3種方法對慢病毒顆粒進行濃縮,用濃縮后的慢病毒顆粒感染CIK細胞,結果表明(圖7、8),獲得的慢病毒濃縮顆粒的感染CIK細胞效率3種方法分別為超濾管濃縮法6.98%±0.77%,超速離心法32.04%±1.66%,PEG-8000濃縮法53.47%±4.72%(F=189.70,P<0.01),3種方法之間的差異有統計學意義。

圖7 不同濃縮方法獲得的慢病毒顆粒感染CIK細胞的明場圖和熒光圖
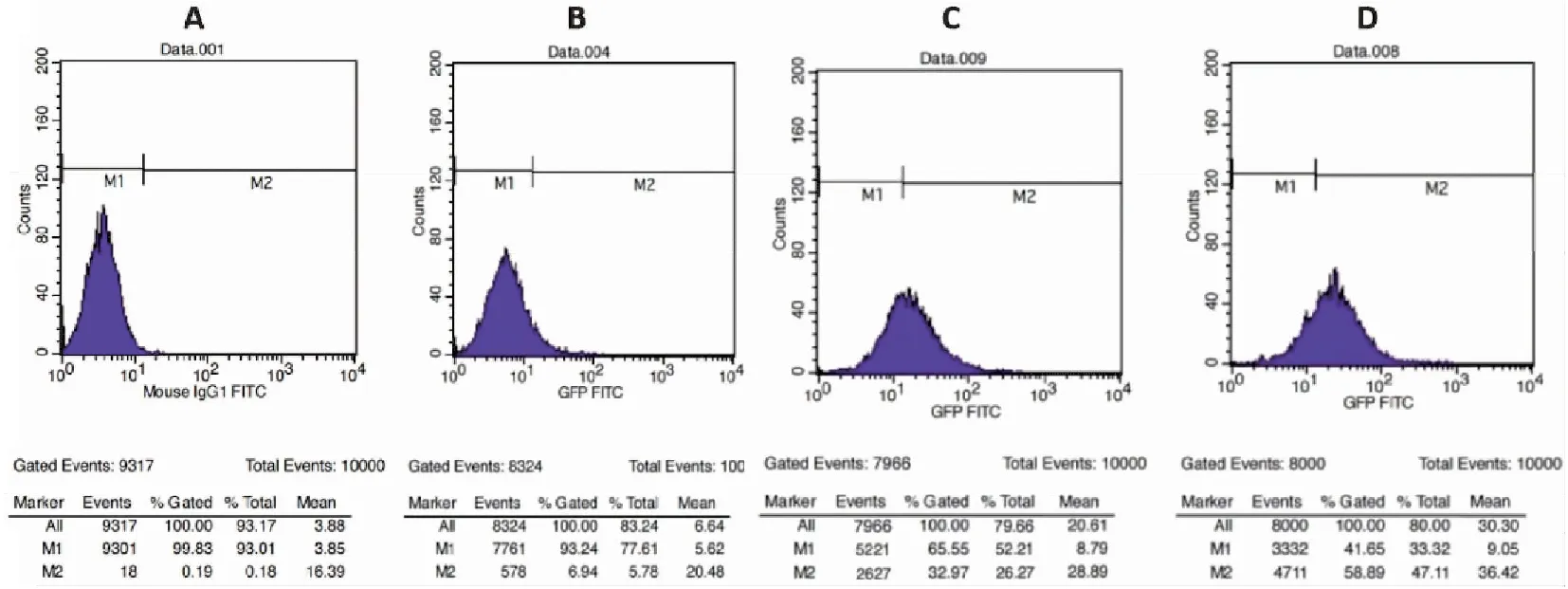
圖8 不同濃縮方法獲得的慢病毒顆粒感染CIK細胞的流式細胞比較
3 討 論
前列腺癌是危害老年男性健康的常見癌癥之一,其發病率在我國呈明顯的逐年上升趨勢。前列腺癌具有潛伏期長、發病率高的特點,但臨床上其早期診斷率卻很低,因此大多數患者失去了早期手術根治的機會。PSMA是存在于前列腺腺上皮細胞且橫跨細胞膜的II型固有膜蛋白,由于其在前列腺癌上皮細胞尤其是在雄激素非依賴性前列腺癌及其轉移灶中有最高的表達[10],明顯高于正常前列腺上皮細胞內的表達,并且在前列腺外的實體腫瘤供應營養物質的新生血管的內皮細胞中也有表達,但在前列腺外的正常組織中不表達或少量表達[11],因此可以作為前列腺組織的標記物。
目前CAR-T細胞技術在淋巴瘤[12]、卵巢癌[13]、神經母細胞瘤[14]、白血病[15]、多發性骨髓瘤[16]、乳腺癌[17]等惡性腫瘤患者的治療中均顯示出良好的抗腫瘤效應[18-20]。CAR-T的發展十分迅速,然而應用仍然還面臨許多困難,比如:臨床上使用的CAR-T療法所帶來的脫靶毒性、器官毒性等;腫瘤微環境的免疫抑制、抗原表達缺失或下調以及CAR-T細胞持久性不足等導致仍有患者復發;治療實體瘤效果不佳,不能夠有效地浸潤到腫瘤組織內部;CAR-T細胞生存時間不長。
基于CAR-T療法的原理,研究人員通過CAR修飾CIK細胞、NK細胞以及γδT細胞等,以期解決CAR-T療法所面臨的難題。CIK細胞是以T細胞為主的非均質細胞群,兼具有T淋巴細胞強大的抗腫瘤活性和NK細胞的非限制性殺瘤等優點。相較于CAR-T,選用CIK這種異質混合型的細胞[21]對于治療時易產生的嚴重副反應有減輕作用。除了血液腫瘤之外,CAR-CIK細胞在實體瘤研究中也取得一定的效果。通過Her-2、EGFR[22]、CEA[23]等腫瘤潛在靶點,可以實現對實體瘤的靶向殺傷。
免疫細胞轉染效率不高一直是困擾其基因改造的一個難題,慢病毒載體可以像轉導分裂細胞一樣,高效轉導非分裂細胞,因此其可以轉導更為廣泛的細胞,包括那些難轉導的血液前體細胞、神經細胞、淋巴細胞和巨噬細胞[24]。本研究結果表明,在應用慢病毒顆粒感染CIK細胞時,僅僅加入轉染增強劑聚凝胺并不能提高其感染效率,只有在加入轉染增強劑的同時,通過室溫(26 ℃)+長時間(4 h)+低速離心(150 g)處理才能使轉染效率達到可觀的目標,這與此方法增加了病毒顆粒與CIK細胞接觸的緊密度可能相關。
為了臨床實驗或后期基因功能研究,獲得高滴度的病毒是十分必要的。而通過研究不同慢病毒載體質粒的包裝能力,發現隨著插入目的片段的增長,病毒滴度則呈現半對數形式下降,目的質粒愈長則包裝有活力病毒顆粒的能力愈下降[25]。因此當研究的目的基因較大時,選擇優化后的病毒包裝體系才可能得到高效率的病毒顆粒。為了產生足夠數量的基因工程化免疫細胞用于臨床實驗,生產大量的慢病毒并進行濃縮處理是必要的。本研究結果表明,相較于超濾管濃縮慢病毒的方法,超速離心法和PEG-8000濃縮法更能提高PSMA-CAR慢病毒的濃縮效率,并且PEG-8000濃縮法的效率遠遠高于超速離心法。在進行少量病毒濃縮時,超濾管濃縮法是方便快捷的方法,但需要濃縮病毒量較多時,則需要較多耗材,費用巨大;應用超濾管濃縮慢病毒時需要根據包裝出慢病毒的大小選擇超濾管的型號,型號選擇不準確也可能是導致濃縮效率不高的原因之一;此外,超濾管不只濃縮了慢病毒顆粒,還濃縮了培養液中的鹽離子及酸堿指示劑等成分,濃縮這些成分可能是導致感染后CIK細胞凋亡較多,造成感染效率不高的主要原因。超速離心法對設備和耗材的要求很高,但目前中國沒有國產的超速離心機,進口超速離心機價格都很貴,并不是一般實驗室所能配備,并且和設備相匹配的超速離心管價格也很昂貴,屬于一次性耗材,因此超速離心法不適用于大量制備慢病毒顆粒。PEG-8000濃縮法所需試劑耗材價格低廉,實驗設備要求不高,并且濃縮效率較高,是大量濃縮慢病毒顆粒的首選方法。
本研究的結果顯示,在倒置熒光顯微鏡下觀察,CIK細胞的轉染效率比流式細胞儀檢測結果要高。這可能是由于GFP吸收的光譜,最大峰值為395 nm(紫外線),并有一個峰值為470 nm的副峰(藍光);發射光譜最大峰值為509nm(綠光),并帶有峰值為540 nm的側峰。GFP的光譜特性與FITC很相似,因此為熒光素FITC設計的熒光顯微鏡濾光片組合同樣適用于GFP觀察;但倒置熒光顯微鏡的藍光激發濾色片為460~490 nm,其發射片波長為515 nm,而流式細胞儀濾光片的488 nm激光的熒光通道則包括530/30 nm、585/42 nm、670 nm LP。這就導致在倒置熒光顯微鏡下觀察的結果與流式細胞儀檢測的結果不一致。由于慢病毒包裝時的轉染為瞬時轉染,目的載體進入細胞中的數量不一致,這就導致細胞表達 GFP時有強也有弱,應用倒置熒光顯微鏡觀察時,可增大激發光的強度,發光較弱的細胞也能觀測到,這也可能是導致流式細胞儀檢測結果相對低一些的原因。因此,本研究的實際轉染效率應高于流式細胞儀所檢測的結果。
綜上所述,隨著腫瘤免疫學理論和技術的發展,利用基因工程修飾免疫細胞的過繼性免疫治療,將成為治療惡性腫瘤的有效手段。本研究通過比較PSMA-CAR慢病毒顆粒感染CIK細胞的效率,探討PSMA-CAR慢病毒顆粒的最佳濃縮方法以及提升感染CIK細胞效率的最佳方法,從而為應用CAR 技術治療前列腺癌奠定基礎。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

