羥自由基氧化對牛肌原纖維蛋白結構與乳化性能的影響
馬思麗,楊 波,李亞蕾,羅瑞明,馬旭華
(寧夏大學食品與葡萄酒學院,寧夏 銀川 750021)
肉及肉制品在加工貯藏過程中極易受到溫度、光照和氧氣等外界條件的影響而導致蛋白質氧化,致使肉品質量下降,品質劣變嚴重[1-2]。蛋白質氧化會導致其結構改變,包括氨基酸側鏈的修飾、蛋白質肽鏈骨架的斷裂、蛋白分子內和分子間發生交聯或聚合等,進而引起蛋白質凝膠性和乳化性等功能特性的改變[3]。
目前,關于蛋白質功能特性方面的研究,多集中于氧化對肌原纖維蛋白結構與凝膠特性的影響,而關于氧化對肌原纖維蛋白結構變化與乳化性能的研究較少,且現有研究報道結果不一致。Sun Weizheng等[4]采用Fenton體系構建羥自由基氧化體系(H2O2濃度分別為0、0.2、0.5、1.0、3.0、5.0、10 mmol/L),并于37 ℃將豬肌原纖維蛋白(蛋白終質量濃度10 mg/mL)氧化孵育3 h,探究化學氧化對豬肌原纖維蛋白乳化特性的影響,發現隨H2O2濃度的增加,肌原纖維蛋白的電荷、表面活性和結構發生改變,蛋白質氧化對肌原纖維蛋白的乳化性能有負面影響。岳開華等[5]采用羥自由基氧化體系(FeCl3、抗壞血酸濃度均為0.1 mmol/L,H2O2濃度分別為1、5、10 mmol/L)于4 ℃條件下對海鱸魚肌原纖維蛋白(蛋白終質量濃度10 mg/mL)分別氧化2、4、6 h,結果發現同一氧化時間下,蛋白質的乳化活性和乳化穩定性隨氧化劑濃度增加呈下降趨勢,而同一氧化劑濃度下,蛋白質的乳化活性和乳化穩定性隨氧化時間的延長逐漸降低。李艷青[6]采用羥自由基氧化體系(FeCl3、抗壞血酸濃度均為0.1 mmol/L,H2O2濃度分別為0、0.1、1、5、10、20 mmol/L)于4 ℃條件下將鯉魚肌原纖維蛋白(蛋白終質量濃度20 mg/mL)分別氧化孵育1、3、5 h,發現同一氧化時間下,隨H2O2濃度的升高,鯉魚肌原纖維蛋白乳化活性和乳化穩定性呈下降趨勢;而張麗等[7]采用羥自由基氧化體系(0.01 mmol/L FeCl3、0.1 mmol/L抗壞血酸,H2O2濃度分別為0.3、0.4、0.5 mmol/L)于4 ℃條件下將牦牛肌原纖維蛋白(蛋白終質量濃度(15±0.5)mg/mL)氧化孵育24 h,發現適當氧化對牦牛肌原纖維蛋白的溶解性和乳化性有一定改善作用。可見,關于氧化強度對肌原纖維蛋白乳化性能的影響還需進一步研究。
在宰后成熟過程中引起肉品蛋白質氧化的途徑有羥自由基氧化、高鐵肌紅蛋白氧化和脂質氧化3 種[8],其中羥自由基氧化被認為是鮮肉氧化的主要原因,它直接影響肌原纖維蛋白的結構與功能性質[6]。牛肉富含人體必需氨基酸,具有高蛋白質、低脂肪和低膽固醇等特點,深受消費者喜愛,但其在貯藏加工過程中易受到氧化的影響[9],因此,本研究主要針對牛肌原纖維蛋白,借助Fenton氧化體系構建羥自由基體外模擬氧化體系,分析不同氧化強度下肌原纖維蛋白理化特性、交聯降解情況、結構以及乳化性能的變化,探究蛋白質氧化程度、結構變化和乳化性能的內在聯系,以期為肉及肉制品的加工和貯藏提供理論參考。
1 材料與方法
1.1 材料與試劑
新鮮秦川牛肉采自寧夏涇源縣清苑牧業有限公司,選取6 頭48 月齡生長發育良好、體況相近、健康無病的秦川公牛(去勢),屠宰后立即取背最長肌,真空包裝置于裝有冰袋的保溫箱中運回實驗室。
脲(尿素)、磷酸鈉(磷酸三鈉)、磷酸(質量分數85%)、氫氧化鈉(粒狀)(均為分析純)國藥集團化學試劑有限公司;抗壞血酸鈉、無水氯化鎂、考馬斯亮藍R250、鹽酸胍、5,5’-二硫代雙(2-硝基苯甲酸)、乙二醇雙(2-氨基乙基醚)四乙酸(ethylene bis(2-oxyethylenenitrilo)tetraacetic acid,EGTA)(均為分析純) 上海麥克林生化科技有限公司;2,4-二硝基苯肼(分析純) 北京索萊寶科技有限公司;乙醇(體積分數95%)、氯化鈉、十二烷基硫酸鈉、氯化鉀、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(均為分析純) 西隴化工股份有限公司;冰乙酸(優級純)、過氧化氫(質量分數30%,分析純) 天津市大茂化學試劑廠。
1.2 儀器與設備
TGL-24M高速冷凍離心機 長沙平凡儀器儀表有限公司;UV-1200紫外分光光度計 上海美譜達儀器有限公司;SJ-3F便攜式pH計 上海儀電科學儀器股份有限公司;JXFSTPRP-CL全自動樣品冷凍研磨儀、JXH-100恒溫混勻儀 上海凈信實業發展有限公司;Spectrum Two傅里葉變換紅外光譜儀 美國Perkin Elmer公司。
1.3 方法
1.3.1 原材料預處理
在實驗室剔除牛背最長肌多余脂肪與結締組織后,分割成大小薄厚均等的肉塊(3 cm×3 cm×3 cm),無菌生理鹽水沖洗干凈后,用濾紙吸干表面水分,立即用液氮冷凍2 h,然后置于-80 ℃冰箱保存備用。
1.3.2 肌原纖維蛋白的提取
參考Park等[10]的方法并作適當修改。稱取適量已切碎的肉樣,按料液比1∶4(g/mL)加入分離緩沖液(0.1 mol/L NaCl、10 mmol/L Na3PO4、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0)混合,8 000 r/min勻漿30 s,暫停1 min,以同樣轉速再勻漿30 s,勻漿液過80 目篩,然后濾液在4 ℃、2 000×g離心15 min,收集沉淀。采用上述相同的混合和離心條件,重復操作2 次。所得沉淀按料液比1∶4(g/mL)加入0.1 mol/L NaCl溶液洗滌,離心2 次后收集沉淀即為肌原纖維蛋白,于4 ℃冷藏,24 h內用完。
1.3.3 肌原纖維蛋白的氧化
參考Xiong Youling[11]和方海硯[12]等的方法構建Fenton氧化體系:0.01 mmol/L FeCl3、0.1 mmol/L VC,H2O2濃度分別為0.5、1、5、10、20 mmol/L,以上氧化體系在50 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl,pH 6.0)中進行。將提取出的肌原纖維蛋白均勻分散于構建的氧化體系中(蛋白終質量濃度15 mg/mL),在4 ℃條件下氧化24 h后加入終濃度1 mmol/L EDTA終止反應,冷凍離心(4 ℃、4 000 r/min,10 min),沉淀用5 倍體積50 mmol/L磷酸鹽緩沖液(pH 7.0)溶解,4 ℃、2 000×g離心15 min,收集沉淀,重復洗滌2 次以除去氧化劑。以肌原纖維蛋白分散于50 mmol/L磷酸鹽緩沖液(含0.6 mmol/L NaCl,pH 6.0,蛋白終質量濃度15 mg/mL)為對照組,于4 ℃放置24 h,其余操作同氧化組。
1.3.4 羰基含量的測定
參考Oliver等[13]的方法并作適當修改。用0.1 mol/L KCl溶液將肌原纖維蛋白質量濃度調整為5 mg/mL,用2,4-二硝基苯肼反應測定羰基含量,摩爾吸光系數為22 000 L/(mol·cm)。
1.3.5 總巰基和游離巰基含量的測定
參考Yongsawatdigul等[14]的方法并稍作修改。
總巰基含量:取0.5 mL 1 mg/mL肌原纖維蛋白溶液加入10 mL離心管中,每管加入4.5 mL Tris-甘氨酸緩沖液(0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L EDTA、8 mol/L尿素,pH 8.0),混勻后加入0.5 mL Ellman試劑,渦旋混勻后在30 ℃條件下反應30 min,然后在波長412 nm處測定吸光度。
游離巰基含量:在不含尿素的情況下,于30 ℃反應30 min,其余操作同上。
根據巰基摩爾吸光系數13 600 L/(mol·cm)按式(1)計算巰基含量。實驗重復3 次,結果以每毫克蛋白所含巰基物質的量表示。用考馬斯亮藍法,以牛血清蛋白做標準曲線,計算蛋白含量。

式中:A為樣品組在412 nm波長處的吸光度;ρ為蛋白質量濃度/(mg/mL);11為稀釋倍數。
1.3.6 二聚酪氨酸含量的測定
參考張麗等[7]的方法并加以修改,用20 mmol/L磷酸鹽緩沖液(含0.6 mol/L KCl,pH 6.0)調節蛋白質量濃度,溶液經過濾除去不溶物質后,用考馬斯亮藍法測定蛋白質量濃度。用熒光分光光度計測定吸光度,發射波長420 nm,激發波長325 nm,狹縫寬度10 nm。二聚酪氨酸含量以相對熒光值(即吸光度除以蛋白質量濃度)表示。
1.3.7 表面疏水性的測定
參考Chelh等[15]的方法并稍作修改,用20 mmol/L磷酸鹽緩沖液(含0.6 mol/L KCl,pH 6.0)將蛋白質溶液稀釋至1 mg/mL。取1 mL稀釋后的蛋白質溶液加入80 μL 1 mg/mL溴酚藍溶液混勻,室溫下攪拌10 min,7 000 r/min離心15 min,取上清液以20 mmol/L磷酸鹽緩沖液(含0.6 mol/L KCl,pH 6.0)稀釋10 倍后,測定595 nm波長處吸光度。以1 mL 20 mmol/L的磷酸鹽緩沖液(pH 6.0)加入80 μL 1 mg/mL溴酚藍溶液作為空白組。表面疏水性按式(2)計算:
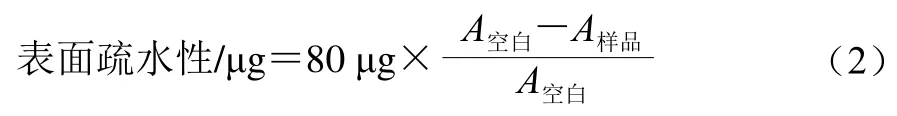
式中:A空白為空白組在595 nm波長處的吸光度;A樣品為樣品組在595 nm波長處的吸光度。
1.3.8 蛋白質二級結構的測定
參考Li Ke等[16]的方法并稍作修改,將氧化后的肌原纖維蛋白膏真空冷凍干燥后,與干燥的溴化鉀按質量比1∶150充分混合,用瑪瑙研缽碾磨,然后將粉末放入壓片機中制成薄片。用傅里葉紅外光譜儀采集光譜數據,掃描范圍4 000~400 cm-1,掃描64 次,分辨率4 cm-1。獲得1 700~1 600 cm-1的吸收光譜,用于酰胺Ⅰ帶分析。利用PeakFit 4.12軟件對1 700~1 600 cm-1波段內的光譜圖進行傅里葉自動去卷積和二階導數峰擬合,計算蛋白質二級結構α-螺旋、β-轉角、β-折疊和無規卷曲的相對含量。
1.3.9 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
參考Shen Hui等[17]的方法并稍作修改,將不同氧化程度的肌原纖維蛋白懸濁液(4 mg/mL)與50 mmol/L Tris緩沖液(8 mol/L尿素、2 mol/L硫脲、3 g/100 mL SDS、0.05%溴酚藍、20%(V/V)甘油,pH 6.8)按體積比1∶1混合,沸水浴中加熱5 min,然后5 000 r/min離心5 min,取15 μL上清液加入到5%的濃縮膠中,用10%的分離膠分離樣品。先以80 V恒壓電泳至濃縮膠與分離膠分界處,再以120 V恒壓電泳至底部。電泳結束后用考馬斯亮藍R250溶液染色30 min,然后在甲醇-冰醋酸-蒸餾水(2.5∶1∶6.5,V/V)中脫色12 h。
1.3.10 肌原纖維蛋白溶解度的測定
參照Wang Shuangxi等[18]的方法并略加修改。用20 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl,pH 6.0)將蛋白質溶液稀釋至2 mg/mL, 5 000×g離心10 min,收集上清液。采用考馬斯亮藍法測定上清液中蛋白含量。計算上清液中蛋白含量與原溶液中蛋白含量的百分比即為肌原纖維蛋白溶解度。
1.3.11 肌原纖維蛋白濁度的測定
用20 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl,pH 6.0)將蛋白溶液稀釋至1 mg/mL,吸取5 mL于試管中,分別于30、40、50、60、70、80 ℃水浴30 min后取出,冷卻后以不加蛋白的溶液為空白,在600 nm波長處測定吸光度。濁度以A600nm表示。
1.3.12 肌原纖維蛋白乳化性能的測定
參考劉娟[19]的方法。肌原纖維蛋白溶解于0.1 mol/L pH 6.5磷酸鹽緩沖溶液中,蛋白質量濃度1 mg/mL,將2.0 mL大豆油和8.0 mL蛋白溶液放入直徑2.5 cm塑料離心管中,10 000 r/min高速勻漿1 min,立即從距離心管底0.5 cm處取勻漿液50 μL,加入到5 mL 0.1% SDS溶液中,振蕩混勻后在500 nm波長處測定吸光度A0,靜置10 min后再次在相同位置取勻漿液50 μL,加入到5 mL 0.1% SDS溶液中,振蕩混勻后測定吸光度A10,用0.1% SDS溶液作空白對照。肌原纖維蛋白勻漿液的乳化活性指數(emulsifying activity index,EAI)和乳化穩定性指數(emulsification stability index,ESI)分別按式(3)、(4)計算:

式中:φ為油相體積分數(0.2);ρ為蛋白質質量濃度/(mg/mL)。
1.4 數據分析
2 結果與分析
2.1 羥自由基氧化對牛肌原纖維蛋白羰基含量的影響
蛋白質羰基化合物是肉類在貯藏過程中蛋白質氧化的主要產物。因此,蛋白質的羰基含量是評價蛋白質氧化的重要指標之一[20]。由圖1可知,隨H2O2濃度的增加,羰基含量顯著增加(P<0.05)。對照組(0 mmol/L H2O2)羰基含量為1.69 nmol/mg,當H2O2濃度為20 mmol/L時,羰基含量為5.33 nmol/mg,相比對照組增加了2.15 倍,這說明隨H2O2濃度的增加,產生的羥自由基含量逐漸增加,肌原纖維蛋白的氧化程度也隨之加劇。

圖1 羥自由基氧化后牛肌原纖維蛋白中羰基含量的變化Fig. 1 Changes in carbonyl content in myofibrillar protein after oxidation by hydroxyl radical
2.2 羥自由基氧化對牛肌原纖維蛋白總巰基和游離巰基含量的影響
巰基的減少是氧化攻擊下蛋白質變化的主要共同特征之一[11]。由圖2可知,隨H2O2濃度的增加,總巰基和游離巰基含量均顯著降低(P<0.05)。對照組(0 mmol/L H2O2)總巰基含量和游離巰基含量分別為68.71 nmol/mg和64.32 nmol/mg,當H2O2濃度增加至20 mmol/L時,總巰基含量和游離巰基含量分別降至62.46 nmol/mg和48.68 nmol/mg,較對照組相比,分別降低了9.10%和24.32%。這可能是因為肌原纖維蛋白巰基容易被活性氧自由基攻擊,轉化為二硫鍵、亞磺酸、磺酸或被一氧化氮亞硝酰化[21]。

圖2 羥自由基氧化后牛肌原纖維蛋白中總巰基、游離巰基含量的變化Fig. 2 Changes in contents of total sulfhydryl and free sulfhydryl groups in myofibrillar protein after oxidation by hydroxyl radical
2.3 羥自由基氧化對牛肌原纖維蛋白二聚酪氨酸含量的影響
酪氨酸也容易受到活性氧的攻擊,產生的酪氨酸自由基和酪氨酸殘基形成二酪氨酸[22]。由圖3可知,隨H2O2濃度的增加,二聚酪氨酸含量呈上升趨勢(P<0.05),對照組中二聚酪氨酸含量為25.06,當H2O2濃度為20 mmol/L時,二聚酪氨酸含量為63.18,較對照組增加了1.52 倍。
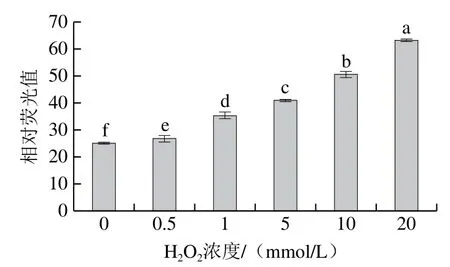
圖3 羥自由基氧化后牛肌原纖維蛋白中二聚酪氨酸含量的變化Fig. 3 Change in dimer tyrosine content in myofibrillar protein after oxidation by hydroxyl radical
2.4 羥自由基氧化對牛肌原纖維蛋白表面疏水性的影響
表面疏水性即蛋白質表面疏水性氨基酸的含量,可以用來評估蛋白質構象的變化[22]。由圖4可知,隨H2O2濃度的增加,肌原纖維蛋白表面疏水性呈上升趨勢(P<0.05)。對照組中肌原纖維蛋白溴酚藍結合量為30.17 μg,當H2O2濃度增加至20 mmol/L,溴酚藍結合量為55.04 μg,與對照組相比肌原纖維蛋白表面疏水性增加82.43%。

圖4 羥自由基氧化后牛肌原纖維蛋白表面疏水性的變化Fig. 4 Change in surface hydrophobicity of myofibrillar protein after oxidation by hydroxyl radical
2.5 羥自由基氧化對牛肌原纖維蛋白二級結構的影響
1 700~1 600 cm-1波段主要由C=O的伸縮振動引起,該波段紅外光譜可用于蛋白二級結構分析[4]。由表1可知,隨H2O2濃度的增加,蛋白質氧化程度加劇,蛋白質二級結構中α-螺旋相對含量呈下降趨勢(P<0.05),β-折疊呈上升趨勢(P<0.05),β-轉角整體呈下降趨勢,無規卷曲則整體呈上升趨勢,這說明氧化對蛋白質二級結構有影響,使蛋白質二級結構從有序向無序轉變。

表1 羥自由基氧化后牛肌原纖維蛋白二級結構的相對含量變化Table 1 Changes in secondary structures of myofibrillar protein after oxidation by hydroxyl radical %
2.6 不同氧化強度肌原纖維蛋白的SDS-PAGE分析

圖5 不同氧化強度肌原纖維蛋白的SDS-PAGE圖Fig. 5 SDS-PAGE pattern of myofibrillar protein oxidized to different degrees
如圖5所示,條帶由上到下依次出現245 kDa的肌球蛋白重鏈、43 kDa的肌動蛋白以及15~25 kDa的肌球蛋白輕鏈。隨H2O2濃度的增加,肌球蛋白重鏈和肌球蛋白輕鏈條帶灰度逐漸變淺,說明氧化對肌球蛋白有影響;肌動蛋白條帶灰度在0.5~1 mmol/L H2O2時略微減弱,說明氧化對肌動蛋白的影響較肌球蛋白較小。
2.7 羥自由基氧化對牛肌原纖維蛋白溶解度的影響
由圖6可知,隨H2O2濃度的增加,肌原纖維蛋白的溶解度呈先上升后降低的趨勢(P<0.05),當H2O2濃度0~0.5 mmol/L時,溶解度變化不顯著(P>0.05),H2O2濃度1 mmol/L,溶解度達到最大值35.22%,較對照組(0 mmol/L H2O2)增加了7.44%,之后隨H2O2濃度的增加,肌原纖維蛋白溶解度顯著降低(P<0.05),H2O2濃度20 mmol/L溶解度為28.39%,較對照組降低了13.39%。

圖6 羥自由基氧化后牛肌原纖維蛋白溶解度的變化Fig. 6 Change in solubility of myofibrillar protein after oxidation by hydroxyl radical
2.8 羥自由基氧化對牛肌原纖維蛋白濁度的影響

圖7 羥自由基氧化后牛肌原纖維蛋白濁度的變化Fig. 7 Change in myofibrillar protein turbidity after oxidation by hydroxyl radical
蛋白溶液加熱后的濁度水平通常用于衡量肌原纖維蛋白熱誘導聚集的變化情況[6]。由圖7可知,不同氧化程度下,蛋白濁度均在40 ℃顯著降低(P<0.05),這可能是由于蛋白質分子展開而導致濁度下降[23],隨后濁度隨溫度升高呈上升趨勢(P<0.05),這可能是由于肌原纖維蛋白的分子內和分子間相互作用會增強聚集[24]。30 ℃時,20 mmol/L H2O2組蛋白濁度較對照組增加了78.81%,80 ℃時,20 mmol/L H2O2組蛋白濁度增加了1.29 倍。在同一溫度下,蛋白質氧化程度越大,濁度越高。以上結果說明氧化會導致肌原纖維蛋白變性,增強蛋白的聚集行為,導致蛋白質濁度增加。
2.9 羥自由基氧化對牛肌原纖維蛋白乳化性能的影響
蛋白質乳化性質一般用EAI和ESI評價,反映了蛋白質形成乳化體系及其穩定乳化體系的能力[5]。如圖8所示,隨H2O2濃度的增加,EAI和ESI都呈先上升后下降的趨勢(P<0.05),當H2O2濃度為1 mmol/L時,EAI和ESI均達到最大,分別為18.33 m2/g和31.95%,較對照組分別增加38.13%和20.66%,H2O2濃度20 mmol/L,EAI和ESI分別為8.74 m2/g和20.02%,分別較對照組降低34.18%和24.41%,這說明羥自由基攻擊引起的氧化嚴重影響了牛肌原纖維蛋白的乳化性能。
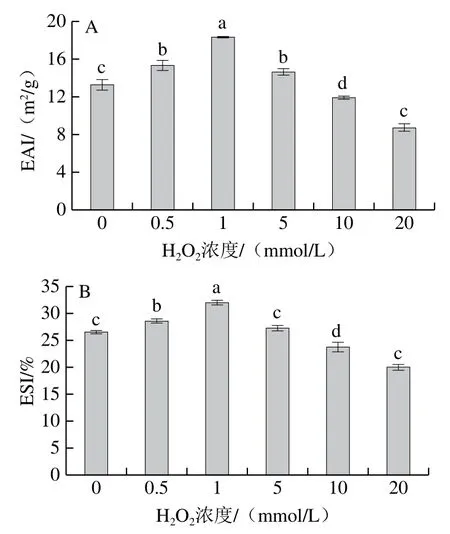
圖8 羥自由基氧化后牛肌原纖維蛋白EAI(A)和ESI(B)的變化Fig. 8 Change in emulsification properties of myofibrillar protein after oxidation by hydroxyl radical
2.10 各指標間的相關性分析

表2 各指標間的Pearson相關性Table 2 Pearson correlation coefficients between all indicators tested
通過對牛肌原纖維蛋白在氧化過程中各指標之間進行Pearson相關性分析(表2)發現,牛肌原纖維蛋白在氧化過程中,羰基含量與二聚酪氨酸含量(r=0.989,P<0.01)、表面疏水性(r=0.988,P<0.01)、β-折疊相對含量(r=0.992,P<0.01)、濁度(r=0.976,P<0.01)、無規卷曲相對含量(r=0.361,P>0.05)呈正相關,與其他指標呈負相關。羰基含量是蛋白質氧化的重要指標之一,羰基含量與各指標之間均有相關性,表明羥自由基氧化對肌原纖維蛋白的結構與功能特性均有影響。表面疏水性與濁度(r=0.976,P<0.01)呈極顯著正相關,與溶解度(r=-0.783,P<0.01)、EAI(r=-0.623,P<0.01)和ESI(r=-0.680,P<0.01)呈極顯著負相關;α-螺旋相對含量與濁度(r=-0.988,P<0.01)呈極顯著負相關,與溶解度(r=0.765,P<0.01)、EAI(r=0.658,P<0.01)和ESI(r=0.721,P<0.01)呈極顯著正相關;β-折疊相對含量和與濁度(r=0.993,P<0.01)呈極顯著正相關,與溶解度(r=-0.778,P<0.01)、EAI(r=-0.680,P<0.01)和ESI(r=-0.683,P<0.01)呈極顯著負相關,表明蛋白質結構變化與乳化性質之間有密切聯系。
3 討 論
羰基主要通過氨基酸側鏈的直接氧化、與還原糖的非酶羰基反應、與非蛋白糖基化化合物的結合以及多肽鏈的氧化斷裂產生,是蛋白質最重要的表征模式[25]。本研究發現,在Fenton氧化體系中,隨H2O2濃度的增加,羰基含量逐漸增加,這表明隨H2O2濃度的增加肌原纖維蛋白氧化程度加劇。崔文斌等[8]的研究指出,牦牛肉在4 ℃氧化24 h后,羰基含量隨H2O2濃度的增加呈上升趨勢,這與本實驗結果一致。扶慶權[26]采用Fenton氧化體系模擬鮮肉氧化得出相同結論。巰基的丟失也是肉與肉制品中蛋白質氧化的標志[27]。本研究發現,總巰基和游離巰基含量都隨H2O2濃度的增加逐漸降低,可能是因為肌原纖維蛋白中的巰基氧化形成多肽分子間或分子內二硫鍵,或進一步氧化成磺酸類或其他氧化產物,從而導致巰基含量的下降[8]。另有研究表明,在自由基氧化體系中,酪氨酸極易被自由基攻擊產生酪氨酸自由基和酪氨酸殘基,形成二聚酪氨酸,因此二聚酪氨酸的含量變化也被用于研究蛋白質氧化的程度[25]。本實驗中,隨氧化劑濃度的增加,二聚酪氨酸的含量顯著增加,這與趙冰等[28]在不同濃度H2O2氧化體系中肌原纖維蛋白氧化的研究結果類似,表明隨H2O2濃度的增加,產生較多的羥自由基,使氨基酸側鏈被攻擊的幾率變大,進而形成更多的酪氨酸自由基和酪氨酸殘基,這些自由基和殘基通過共價鍵與非共價鍵作用形成二聚酪氨酸[23]。
表面疏水性是蛋白質變性和水解的良好標志[29]。本研究發現,表面疏水性與羰基含量呈極顯著正相關,表明隨氧化程度的增加蛋白質表面疏水性呈上升趨勢,這與Shen Hui[17]和Cao Yungang[30]等的研究結果類似。Estévez[20]提出表面疏水性的增加可能是因為氧化損傷誘導肌原纖維蛋白部分解折疊,從而暴露了埋藏于蛋白質分子內部的疏水性氨基酸。此外,氧化應激下某些肽的裂解也可能導致蛋白質表面疏水性的增強[31]。蛋白質二級結構主要通過骨架上羰基和酰胺基團之間形成的氫鍵維持,氫鍵是穩定二級結構的主要作用力,二級結構主要由α-螺旋、β-折疊、β-轉角和無規卷曲4 種構象組成[12]。本研究結果表明,隨氧化程度的增加,α-螺旋和β-轉角相對含量呈下降趨勢,β-折疊和無規卷曲相對含量呈上升趨勢,表明氧化對蛋白質二級結構有影響。α-螺旋相對含量下降和β-折疊相對含量增加的原因是羥自由基通過削弱氫鍵改變蛋白質的二級結構,α-螺旋逐漸展開,多肽鏈重排形成β-折疊[32]。張海璐等[33]對羊肉中肌原纖維蛋白采用不同程度的體外模擬氧化,發現隨氧化程度的增加,α-螺旋逐漸降低,與本實驗結果一致。相關性分析發現,表面疏水性與α-螺旋和β-折疊相對含量極顯著相關,表明蛋白質表面疏水性的增加與蛋白質二級結構的變化有關。Morzel等[25]指出氧化可能導致蛋白二級結構改變,導致溶液中極性和非極性基團數量的改變,因此可能增加表面疏水性。另有報道稱氧化使埋藏在分子內部的疏水基團暴露,導致分子內氫鍵減少,使蛋白二級結構發生改變[4]。此外,Xiong Youling等[11]研究發現二級結構中α-螺旋和β-折疊的轉變可能對牦牛肌原纖維蛋白的功能特性有影響。此外,張麗等[7]發現二級結構大多數指標與溶解度、濁度和乳化特性相關性顯著。這與本研究中相關性分析結果類似,表明氧化導致的結構變化對其乳化特性等功能性質有影響。
SDS-PAGE圖譜顯示在不同氧化強度下蛋白質的交聯聚集和降解情況[11],蛋白質發生降解主要表現為蛋白質條帶的模糊、弱化和擴展[34],這表明氧化在一定程度對蛋白質的交聯降解有影響。本研究發現隨H2O2濃度的增加,肌球蛋白重鏈和肌球蛋白輕鏈條帶灰度逐漸變淺,說明隨氧化強度的增加,肌球蛋白發生交聯。肌動蛋白條帶灰度在0.5~1 mmol/L H2O2時稍有減弱,這說明與肌球蛋白相比,氧化對肌動蛋白的影響較小。Zhang Dong等[35]對不同氧化強度的豬肌原纖維蛋白進行SDS-PAGE分析發現,肌球蛋白重鏈和肌動蛋白條帶灰度隨氧化程度的增加逐漸變淺。肌球蛋白和肌動球蛋白構成了油滴周圍的界面蛋白膜[16],因此氧化誘導肌球蛋白和肌動蛋白的交聯可以解釋高氧化強度下肌原纖維蛋白EAI和ESI降低的原因。
由于氧化引起的蛋白交聯會導致肌原纖維蛋白發生聚集和沉淀,引起溶解度降低和濁度增加[6],因此溶解度和濁度都可以表征蛋白質聚集的程度[36]。本研究發現,隨H2O2濃度的升高和氧化強度的增加,肌原纖維蛋白的溶解度呈先上升后下降的趨勢,濁度呈先減小后增加的趨勢。Zhang Dong等[35]得出類似結論。Estévez[20]指出輕微的氧化可能會導致蛋白質的部分解折疊,使肌原纖維蛋白的溶解度升高,濁度降低。之后,隨著氧化強度的增加,肌原纖維蛋白的溶解度下降,濁度升高,這可能是因為氧化使蛋白質結構展開,導致分子內疏水性基團暴露,增加了蛋白質分子之間的疏水相互作用,從而導致蛋白質聚集[21]。此外,氧化使蛋白質中的巰基轉化為二硫鍵,導致蛋白質聚集,也是溶解度降低和濁度增加的原因[37]。
肌原纖維蛋白是良好的乳化劑,因為其具有兩親性結構,可以降低液滴表面張力并穩定系統[38]。本研究發現,隨氧化程度的增加,EAI和ESI都呈先上升后下降的趨勢,表明適度氧化對肌原纖維蛋白的乳化性能產生有利影響,而過度氧化則會破壞肌原纖維蛋白的乳化特性。低強度氧化會誘導肌原纖維蛋白構象發生改變,蛋白質部分解折疊暴露出較多的疏水基團,使肌原纖維蛋白在形成乳液的過程中能更好地吸附在油-水界面,從而有效提升蛋白溶液的乳化活性和乳化穩定性[39]。李艷青[6]研究發現,在Fenton氧化體系中,氧化引起氨基酸側鏈改變,使蛋白質發生變性,導致蛋白聚集體產生,蛋白不能形成穩定的界面膜,從而使其乳化活性和乳化穩定性下降,并指出EAI和ESI與溶解度呈正相關,這與本研究結果一致,即蛋白質溶解度越低,乳化活性和乳化穩定性也相對越低,這可能是因為蛋白質在發揮乳化作用前需先溶解并轉移到表面[40]。相關性分析發現,EAI和ESI與表面疏水性和β-折疊相對含量呈顯著負相關,這與Sun Weizheng等[4]的結論相似,這可能是由于高強度氧化誘導表面疏水性和β-折疊相對含量的增加,造成表面活性和蛋白質分子表面作用力減弱,導致界面蛋白膜的黏度降低,乳液液滴間通過疏水相互作用的排斥力增加,從而導致乳液穩定性下降[41-42]。
4 結 論
本實驗研究了不同氧化強度下,牛肌原纖維蛋白理化特性、結構以及乳化性能的變化及其內在聯系。結果表明:隨H2O2濃度的增加,羰基含量和二聚酪氨酸含量逐漸增加,總巰基和游離巰基含量下降,表明隨H2O2濃度的增加肌原纖維蛋白的氧化程度加劇。隨氧化程度的增加,表面疏水性和α-螺旋相對含量呈上升趨勢,β-折疊相對含量呈下降趨勢。SDS-PAGE結果表明氧化誘導蛋白質產生交聯。溶解度、EAI和ESI都隨氧化程度的增加呈先上升后下降的趨勢,濁度呈先減小后增加的趨勢。相關性結果表明氧化誘導的蛋白質結構變化對肌原纖維蛋白的乳化性能有影響。綜上所述,Fenton氧化體系中產生的羥自由基能夠顯著促進肌原纖維蛋白的氧化,導致其結構發生改變,進而影響其乳化性能,因此有必要根據肌原纖維蛋白的氧化特性和結構變化,實施相應的調控方案控制蛋白質氧化,減少肉品在貯藏與加工過程中的損失。

