酵母菌與乳酸菌發(fā)酵馬乳產(chǎn)ACE抑制肽
唐 蓉,王 康,郭元晟,劉彥敏,孫建萍,朱建軍,*,伊日布斯,*
(1.昆明理工大學(xué)生命科學(xué)與技術(shù)學(xué)院,云南 昆明 650500;2.錫林郭勒職業(yè)學(xué)院生物工程研究院,內(nèi)蒙古 錫林浩特 026000)
高血壓是最常見的心血管慢性疾病,往往會導(dǎo)致心臟病、腦卒中、腎衰等多種并發(fā)癥且具有高死亡率[1]。酸馬乳是北方游牧民族的傳統(tǒng)飲品,以新鮮馬乳為原料,經(jīng)乳酸菌和酵母菌等微生物自然發(fā)酵而成的一種具有獨特香氣的酸性含醇發(fā)酵乳。酸馬乳在臨床研究中對高血脂、高血壓、冠心病等心血管疾病具有顯著療效[2-3],蒙古族傳統(tǒng)醫(yī)學(xué)研究報道酸馬乳具有降壓療效,被建議作為治療高血壓的輔助藥物[4-5],但其降壓機制仍不清楚。
血管緊張素轉(zhuǎn)換酶(angiotensin-converting enzyme,ACE)是重要的血壓調(diào)節(jié)酶,該酶通過將血管緊張素I轉(zhuǎn)化為血管緊張素II收縮血管,以及使緩激肽失活,導(dǎo)致血壓升高[6]。抑制ACE可以抑制血管緊張素I轉(zhuǎn)化為血管緊張素II和提升血管舒張緩激肽的活性,從而達到調(diào)節(jié)血壓的效果[7]。ACE是篩選降血壓藥物的重要靶點,并且ACE抑制劑已經(jīng)是臨床上常用的降血壓藥物。
食源性ACE抑制肽由于安全性高、來源廣泛、無毒副作用而成為高血壓防治領(lǐng)域的研究熱點,其中發(fā)酵乳的研究更為廣泛[8]。發(fā)酵乳不僅是易消化的蛋白質(zhì)來源,還具有很高的營養(yǎng)價值和廣泛的生物活性成分,尤其是抗高血壓活性肽[9]。自1995年Nakamura等[10]從Calpis中分離得到具有抑制ACE活性的三肽VPP和IPP能降低自發(fā)性高血壓大鼠的血壓后,越來越多的研究者從發(fā)酵乳中分離得到具有抑制ACE活性的小分子肽[11-14]。但是目前發(fā)酵乳抗高血壓活性的研究大多都使用乳酸菌發(fā)酵,利用酵母菌或乳酸菌與酵母菌共發(fā)酵的研究卻比較少。酵母菌是傳統(tǒng)發(fā)酵乳中常見的微生物類群,例如在開菲爾、酸馬乳、酸駝乳等傳統(tǒng)發(fā)酵乳中酵母菌的數(shù)量可達106CFU/mL[15],它不僅可為發(fā)酵乳賦予獨特的風(fēng)味特征,而且還能水解乳蛋白產(chǎn)生活性肽[16]。酵母菌在乳中生長或發(fā)酵時,利用其自身的蛋白水解系統(tǒng),將乳蛋白降解成小肽和氨基酸供給自身需要的氮源,同時釋放生物活性肽,已有研究報道從酵母菌發(fā)酵的脫脂乳中分離純化出ACE抑制肽VLSRYP和LRFF[17]。本研究從傳統(tǒng)酸馬乳中分離純化并篩選出具有ACE抑制活性的乳酸菌與酵母菌,旨在通過共發(fā)酵馬乳生產(chǎn)和純化具有ACE抑制活性的生物活性組分。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品與菌株
鮮馬乳采自內(nèi)蒙古錫林郭勒盟,-20 ℃保存?zhèn)溆谩K镁昃鶑膬?nèi)蒙古錫林郭勒盟傳統(tǒng)酸馬乳樣品中分離純化所得,-80 ℃保存。
1.1.2 試劑
蛋白胨、酵母膏、MRS肉湯、瓊脂、兩性霉素B中國Solarbio公司;馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養(yǎng)基 上海陸橋有限公司;胃蛋白酶、胰蛋白酶 上海源葉生物科技有限公司;馬尿酸(色譜級)、ACE(源自兔肺)、馬尿酸-組氨酰-亮氨酸(hippuryl-L-histidyl-L-leucine,HHL)、乙腈(色譜級)、鄰苯二甲醛(1,2-phthalic dicarboxaldehyde,OPA) 德國Sigma公司;所有分離用有機溶劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
PH104A恒溫培養(yǎng)箱 上海一恒科技有限公司;4802UV/VIS紫外-可見光分光光度計 優(yōu)尼科儀器有限公司;THZ-072HT控溫搖床 上海申能博彩生物科技有限公司;ABI2700聚合酶鏈式反應(yīng)(polymerase chain reaction,PCR)儀 美國Applied Biosystem公司;Sartorius PB-10型pH計 上海珂淮儀器有限公司;Heraeus Fresco 17R臺式低溫高速離心機 美國賽默飛世爾科技公司;LC-20A高效液相色譜(high performance liquid chromatography,HPLC)系統(tǒng)(配有可變波長紫外檢測器) 日本島津公司;AKTA蛋白純化系統(tǒng)美國GE Healthcare公司;冷凍干燥機 寧波新芝生物科技股份有限公司。
1.3 方法
1.3.1 馬乳發(fā)酵
發(fā)酵劑制備:-80 ℃冰箱中取出菌株,乳酸菌于MRS液體培養(yǎng)基37 ℃靜置培養(yǎng);酵母菌于酵母浸出粉胨葡萄糖液體培養(yǎng)基28 ℃、150 r/min搖床培養(yǎng),均活化2 代后生長到對數(shù)生長期使用。將活化好的菌液于4 000×g、4 ℃離心5 min,棄去上清液,用預(yù)先滅菌的生理鹽水重復(fù)清洗菌體3 次,收集菌體。最后懸浮于與培養(yǎng)液同體積的無菌生理鹽水中,制成菌懸液作為母發(fā)酵劑。
發(fā)酵:鮮馬乳95 ℃、5 min滅菌后冷卻至37 ℃。滅菌后的馬乳分別接種體積分數(shù)4%乳酸菌、4%酵母菌和各2%的乳酸菌和酵母菌,混合1 min。接種乳酸菌的馬乳置于37 ℃恒溫培養(yǎng)箱;接種酵母菌的馬乳置于30 ℃、150 r/min搖床。發(fā)酵乳一式3 份進行。
1.3.2 菌株的鑒定
對篩選出的乳酸菌和酵母菌進行16S rRNA和26S rRNA分子生物學(xué)鑒定,表1為PCR擴增引物序列。PCR采用25 μL體系:10×PCR Buffer 2.2 μL;dNTPs(2.5 mmol/L)2.5 μL;ddH2O 17.5 μL;上下游引物(10 μmol/L)分別為0.5 μL;DNA模板1 μL;Taq酶0.5 μL。16S rRNA的PCR設(shè)定程序為:94 ℃預(yù)變性3 min,94 ℃變性30 s,52 ℃退火30 s,72 ℃延伸75 s,共30 個循環(huán);26S rRNA的PCR設(shè)定程序為:94 ℃預(yù)變性3 min,94 ℃變性30 s,53 ℃退火30 s,72 ℃延伸30 s,共30 個循環(huán);使用無菌的ddH2O作為陰性對照。PCR產(chǎn)物用1%的瓊脂糖凝膠電泳鑒定,經(jīng)純化回收后交由生工生物工程(上海)股份有限公司進行測序。
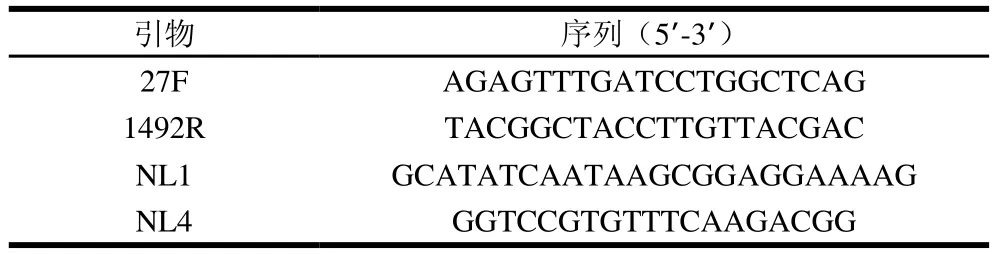
表1 PCR擴增引物序列Table 1 Primer sequences used for PCR amplification
1.3.3 pH值和活菌數(shù)的測定
pH值測定:使用pH計。活菌數(shù)測定:乳酸菌涂布于MRS固體培養(yǎng)基后37 ℃恒溫培養(yǎng)2 d;酵母菌涂布于PDA固體培養(yǎng)基后28 ℃恒溫培養(yǎng)2 d。每個樣品測定3 個平行。
1.3.4 水溶性提取物的制備
樣品發(fā)酵結(jié)束后,用1 mol/L的HCl溶液將其pH值調(diào)至4.3,10 000×g離心10 min后收集上清液,再用1 mol/L的NaOH溶液將其pH值調(diào)節(jié)至7.0后,于10 000×g再次離心10 min并收集上清液,上清液經(jīng)0.45 μm濾膜過濾后保存于-20 ℃冰箱,用于下一步分析。
1.3.5 蛋白水解度的測定
采用OPA法[18]測定游離氨基含量估算蛋白質(zhì)水解度,對應(yīng)標準曲線的絲氨酸質(zhì)量濃度表示OPA指數(shù),即水解度。
樣品測定:1 mL發(fā)酵馬乳樣品中加入0.5 mL蒸餾水混勻,再加入2.5 mL 0.75 mol/L三氯乙酸溶液混勻,靜置10 min后5 000×g、4 ℃離心10 min,留上清液備用。取400 μL上清液與3 mL的OPA試劑混勻,室溫避光反應(yīng)2 min后,在340 nm波長處測其吸光度,對應(yīng)絲氨酸質(zhì)量濃度表示蛋白水解度,每個樣品測定3 個平行。
標準曲線測定:分別配制質(zhì)量濃度為0.025、0.05、0.075 mg/mL和0.1 mg/mL絲氨酸標準溶液。400 μL絲氨酸標準溶液加入到3 mL OPA試劑中,混合均勻,室溫靜置2 min后,在340 nm波長處測定吸光度。以蒸餾水作空白對照,每個樣品重復(fù)測定3 次,取平均值繪制標準曲線。所得標準曲線方程為:Y=8.026X-0.004 796(R2=0.999),X表示絲氨酸質(zhì)量濃度(mg/mL),Y表示340 nm波長處吸光度。
1.3.6 ACE抑制率的測定
參考Mao Xueying等[19]的方法,進行修改后使用HPLC法測定樣品的ACE抑制活性。HHL溶解于含300 mmol/L NaCl的100 mmol/L硼酸鈉緩沖液中(pH 8.3)。40 μL發(fā)酵馬乳提取物和100 μL HHL(10 mmol/L)在37 ℃溫育10 min后加入40 μL 0.01 U/mL ACE 37 ℃反應(yīng)30 min,煮沸10 min終止反應(yīng)。加入400 μL去離子水,10 000×g離心5 min,經(jīng)過0.45 μm水系過濾器過濾樣品,上樣20 μL進行HPLC分析,每個樣品做3 個平行反應(yīng)。HPLC檢測條件:分析柱Kromasil C18(150 mm×4.6 mm,5 μm);流動相:25%乙腈-75%水,含0.1%三氟乙酸;柱溫30 ℃;流速1 mL/min;228 nm監(jiān)測洗脫;結(jié)束時間10 min。根據(jù)馬尿酸標準曲線測定樣品產(chǎn)生的馬尿酸的質(zhì)量濃度。ACE抑制率按下式計算:
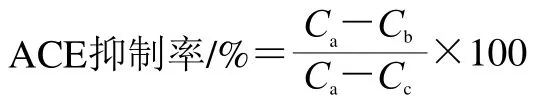
式中:Ca為緩沖液代替樣品進行反應(yīng)的馬尿酸質(zhì)量濃度/(μg/mL);Cb為樣品反應(yīng)后產(chǎn)生的馬尿酸質(zhì)量濃度/(μg/mL);Cc為緩沖液代替ACE進行反應(yīng)的馬尿酸質(zhì)量濃度/(μg/mL)。
1.3.7 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析發(fā)酵產(chǎn)物的組成
選用5%濃縮膠和12%分離膠對鮮馬乳和發(fā)酵馬乳中的蛋白質(zhì)進行SDS-PAGE,在0.5 mol/L pH 6.8 Tris-HCl和1.5 mol/L pH 8.8 Tris-HCl緩沖液中運行2 h分離。隨后將蛋白質(zhì)在含有0.1 g/100 mL考馬斯亮藍R-250、40%(體積分數(shù),下同)甲醇、50%水和10%乙酸的混合溶液中染色過夜。染色結(jié)束后在沒有考馬斯亮藍R-250的溶液中脫色,使用凝膠成像系統(tǒng)對脫色好的凝膠進行拍照并保存。
1.3.8 反相高效液相色譜(reversed-phase high performance liquid chromatography,RP-HPLC)分析發(fā)酵產(chǎn)物組成
根據(jù)Vincenzetti等[20]的方法作修改,對鮮馬乳和發(fā)酵馬乳蛋白和多肽組成進行RP-HPLC分析。樣品處理:發(fā)酵乳加2 倍體積CL Buffer,混勻后室溫下靜置5 min,4 000×g離心15 min,0.45 μm濾膜過濾后取20 μL上樣。色譜條件:色譜柱:C18(250 mm×4.6 mm,5 μm,100 ?);流動相A:0.1% TFA溶液,流動相B:0.1% TFA-乙腈溶液;進樣量20 μL;流速1 mL/min;檢測波長220 nm;檢測溫度30 ℃;洗脫程序:0~5 min,95% A、5% B;5~40 min,95%~20% A、5%~80% B;40~50 min,20%~95% A、80%~5% B;50~70 min,95% A、5% B;70 min停止。
1.3.9 發(fā)酵產(chǎn)物的體外模擬胃腸消化
參照Alting等[21]的方法并稍作修改。首先,將馬乳發(fā)酵產(chǎn)物溶于蒸溜水中配成3 g/100 mL溶液,加入胃蛋白酶,酶與底物質(zhì)量比為1∶50,用1 mol/L HCl溶液將其pH值調(diào)至2,經(jīng)0.22 μm濾膜過濾除菌后,啟動體外胃模擬消化,37 ℃酶解60 min;用1 mol/L NaOH溶液調(diào)節(jié)pH 7,加入胰蛋白酶,酶與底物質(zhì)量比為1∶50,經(jīng)0.22 μm濾膜過濾除菌后,啟動體外腸道模擬消化,保持pH 7,37 ℃酶解120 min,整個水解過程中持續(xù)攪拌。酶解結(jié)束后沸水浴5 min,滅活蛋白酶。水解液1 800×g、4 ℃離心10 min,收集上清液,真空冷凍干燥后于-20 ℃保存。
1.3.10 AKTA葡聚糖G-25凝膠色譜分離ACE抑制肽
將SephedaxG-25凝膠浸泡充分溶脹后裝入層析柱中,預(yù)先用蒸餾水沖洗柱子使其平衡至基線平穩(wěn)。樣品凍干粉溶于蒸餾水中,過0.45 μm濾膜,配成100 mg/mL,取10 mL上樣于層析柱,采用0.5 mL/min的蒸餾水洗脫,220 nm波長處測定吸光度,人工收集洗脫液。合并后的分離峰冷凍干燥制成凍干粉,蒸餾水溶解配成不同濃度,分別測定各分離峰的抑制率。
1.4 統(tǒng)計分析
實驗數(shù)據(jù)通過Graphpad Prism8.2.1軟件進行計算繪圖;響應(yīng)面使用Mintab19進行設(shè)計和分析;并使用IBM SPSS Statistics 26進行顯著性檢驗。結(jié)果以表示,P<0.05,差異顯著。
2 結(jié)果與分析
2.1 發(fā)酵菌株的篩選與鑒定
從傳統(tǒng)酸馬乳樣品中分離獲得乳酸菌234 株,酵母菌102 株,在馬乳中進行發(fā)酵,乳酸菌在馬乳中生長代謝良好則可大量產(chǎn)酸,降低乳環(huán)境的pH值,以pH值作為篩選乳酸菌的條件,在37 ℃條件下馬乳中培養(yǎng)24 h,pH值降至5.0以下的乳酸菌株10 株。酵母菌在馬乳中生長代謝良好則活菌數(shù)的較多,菌液的OD600nm值較高,以酵母菌生長的OD600nm值為指標篩選出在30 ℃、150 r/min條件下馬乳中培養(yǎng)24 h,OD600nm值增至1.5以上的酵母菌8 株。
對以上發(fā)酵性能良好的乳酸菌和酵母菌分別進行16S rRNA和26S rRNA測序,利用GenBank數(shù)據(jù)庫的BLAST程序進行序列相似性的比對,結(jié)果如表2、3所示。進而對分離獲得的菌株進行系統(tǒng)發(fā)育分析,結(jié)果如圖1所示,菌株L1、L3、L4、L6、L7、L9、L10聚類于乳桿菌屬(Lactobacillus),L1與乳酸桿菌(L. diolivorans)的同源性為100%,L3與副干酪乳桿菌(L. paracasei)的同源性為99.26%、L4與乳桿菌(Lactobacillus)的同源性為98.47%,L6、L9與嗜酸乳桿菌(L. acidophilus)的同源性大于97%,L7、L10與植物乳桿菌(L. plantarum)的同源性大于98%。菌株L2與腸球菌屬(Enterococcus)的杜蘭腸球菌(E. durans)同源性為99.15%;菌株L5和L8聚類于乳球菌屬(Lactococcus),與乳酸乳球菌(L. lactis)的同源性大于98%。酵母菌的系統(tǒng)發(fā)育分析結(jié)果如圖2所示,菌株Y1、Y2、Y6聚類于畢赤酵母屬(Pichia),Y1與發(fā)酵畢赤酵母(P. fermentans)的同源性為99.63%,Y2、Y6與庫德里阿茲威氏畢赤酵母(P. kudriavzevii)的同源性大于99%;菌株Y3、Y8聚類于克魯維酵母屬(Kluyveromyces),與馬克思克魯維酵母(K.marxianus)的同源性為100%;菌株Y4與哈薩克斯坦酵母屬(Kazachstania)的薩克斯坦單胞釀酒酵母(K.unispora)的同源性為99.63%;菌株Y5與釀酒酵母屬(Saccharomyces)的釀酒酵母(S. cerevisiae)同源性為99.65%;菌株Y7與耶氏酵母屬(Yarrowia)的解脂耶氏酵母(Y. lipolytica)同源性為100%。
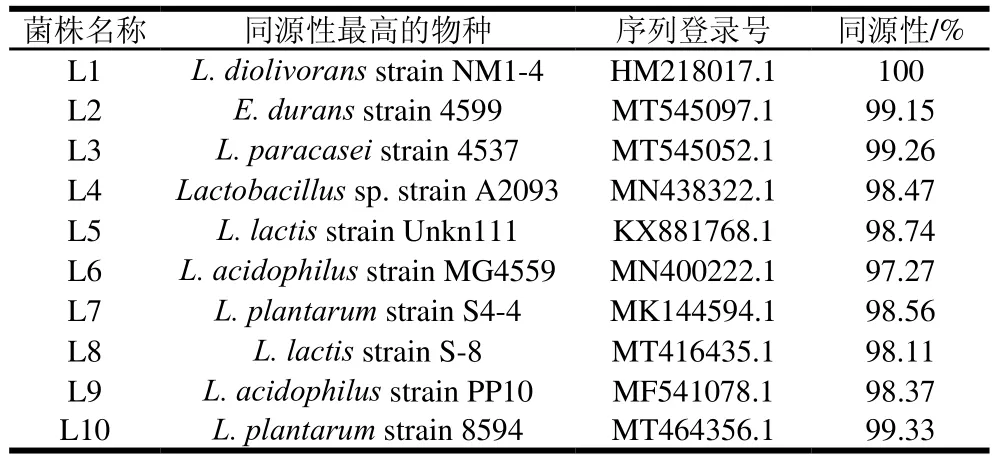
表2 乳酸菌鑒定結(jié)果Table 2 Identification of lactic acid bacteria
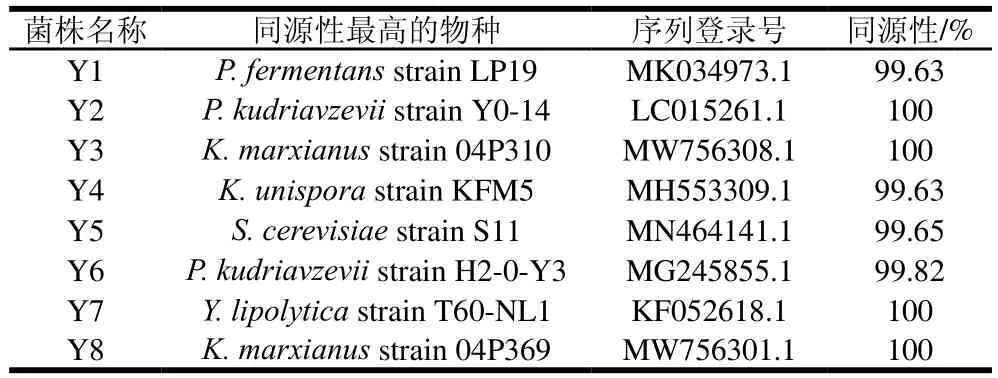
表3 酵母菌鑒定結(jié)果Table 3 Results of yeast identification
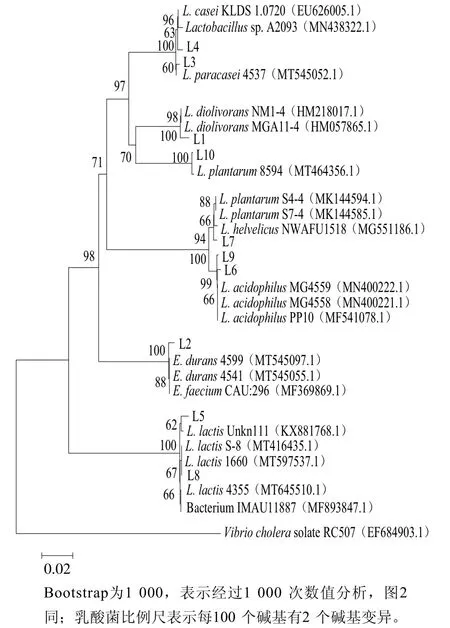
圖1 乳酸菌的系統(tǒng)發(fā)育分析Fig. 1 Phylogenetic tree of lactic acid bacteria
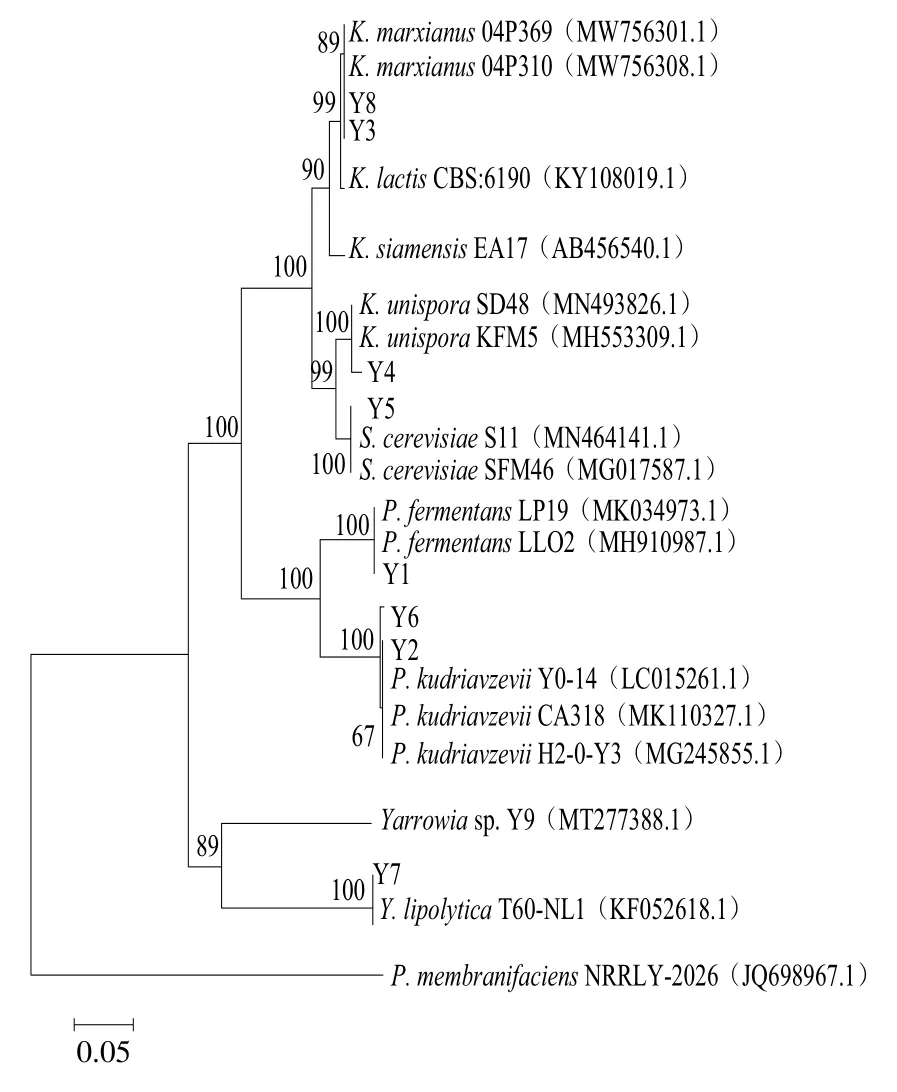
圖2 酵母菌的系統(tǒng)發(fā)育分析Fig. 2 Phylogenetic tree of yeast
2.2 ACE抑制活性乳酸菌的篩選
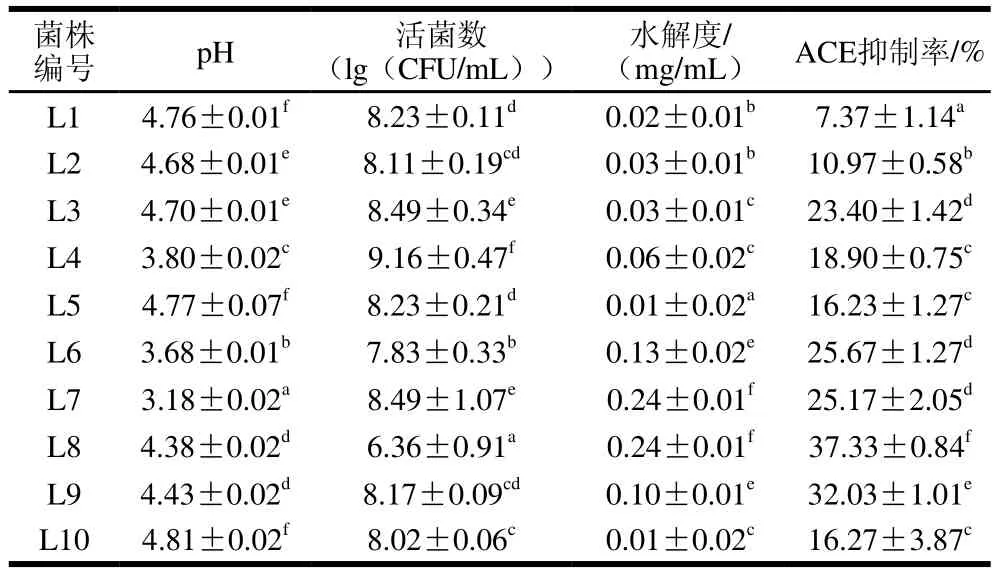
表4 乳酸菌發(fā)酵馬乳篩選結(jié)果Table 4 Properties of fermented milk with lactic acid bacteria
以上篩選出的10 株乳酸菌在馬乳中生長發(fā)酵能力具有差異,如表4所示,所用菌株發(fā)酵馬乳的ACE抑制率均高于原馬乳的5.19%,其中ACE抑制率最高的為L8,抑制率可達到37.33%,其水解度最大可達0.24 mg/mL,pH值為4.38,活菌數(shù)為6.36(lg(CFU/mL))。所用乳酸菌發(fā)酵馬乳pH值均降至5以下,發(fā)酵60 h L4菌株的活菌數(shù)最多為9.16(lg(CFU/mL)),L8菌株發(fā)酵60 h活菌數(shù)最少為6.36 (lg(CFU/mL))。L7和L8對馬乳蛋白的水解度相同為0.24 mg/mL;L6和L9的蛋白水解能力適中,水解度分別可達0.13 mg/mL和0.10 mg/mL;其他菌株發(fā)酵馬乳的蛋白水解度都小于0.10 mg/mL。
2.3 ACE抑制活性酵母菌的篩選
篩選獲得的8 株酵母菌在馬乳中的生長發(fā)酵也具有較大差異,如表5所示,其中Y2和Y6發(fā)酵馬乳ACE抑制率低于原馬乳的5.19%,其他菌株發(fā)酵馬乳的ACE抑制率均高于原馬乳,其中ACE抑制率最高的是Y7,抑制率可達到51.17%,其水解度最大可達0.22 mg/mL,pH值可降至5.70,活菌數(shù)為6.75(lg(CFU/mL))。在發(fā)酵60 h Y8菌株的活菌數(shù)最多為8.36(lg(CFU/mL)),Y6菌株的活菌數(shù)最少為6.65(lg(CFU/mL))。所測酵母菌發(fā)酵馬乳的pH值除Y7外其他沒有明顯下降。Y7的蛋白水解能力最強,最大水解度可達0.22 mg/mL,是其他菌株的4 倍以上,其他菌株之間的水解度差異不顯著。
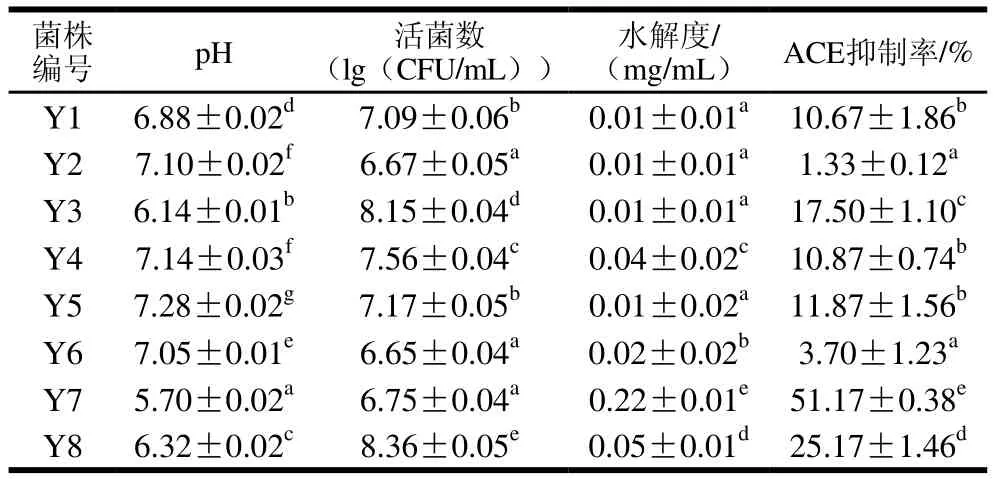
表5 酵母菌發(fā)酵馬乳篩選結(jié)果Table 5 Properties of fermented milk with yeast
2.4 不同因素對乳酸菌與酵母菌共發(fā)酵馬乳ACE抑制活性的影響
為考察乳酸菌和酵母菌組合發(fā)酵馬乳的ACE抑制活性,選擇ACE抑制率最高的乳酸菌L8和酵母菌Y7進行組合發(fā)酵,并測試發(fā)酵條件對乳酸菌和酵母菌共發(fā)酵馬乳ACE抑制率的影響。如圖3所示,不同接種比例發(fā)酵馬乳的ACE抑制率均為60%左右,經(jīng)分析統(tǒng)計學(xué)分析無顯著差異(P>0.05),因此后續(xù)響應(yīng)面試驗設(shè)計中無考慮該因素。隨著接種量的增加,發(fā)酵馬乳ACE抑制率先增加后降低,接種量為6%時ACE抑制率達到最大為70%;隨著發(fā)酵時間的延長,發(fā)酵馬乳ACE抑制率先增加后降低,發(fā)酵60 h ACE抑制率達到最大值70.3%;隨著溫度升高,發(fā)酵馬乳中ACE抑制率的變化趨勢都是先升高后降低,在30 ℃時ACE抑制率均達到最大值70.4%;隨著搖床轉(zhuǎn)速的增加ACE抑制率先升高后降低,在100 r/min時ACE抑制率最大值65%。
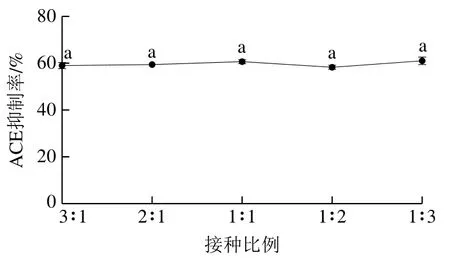
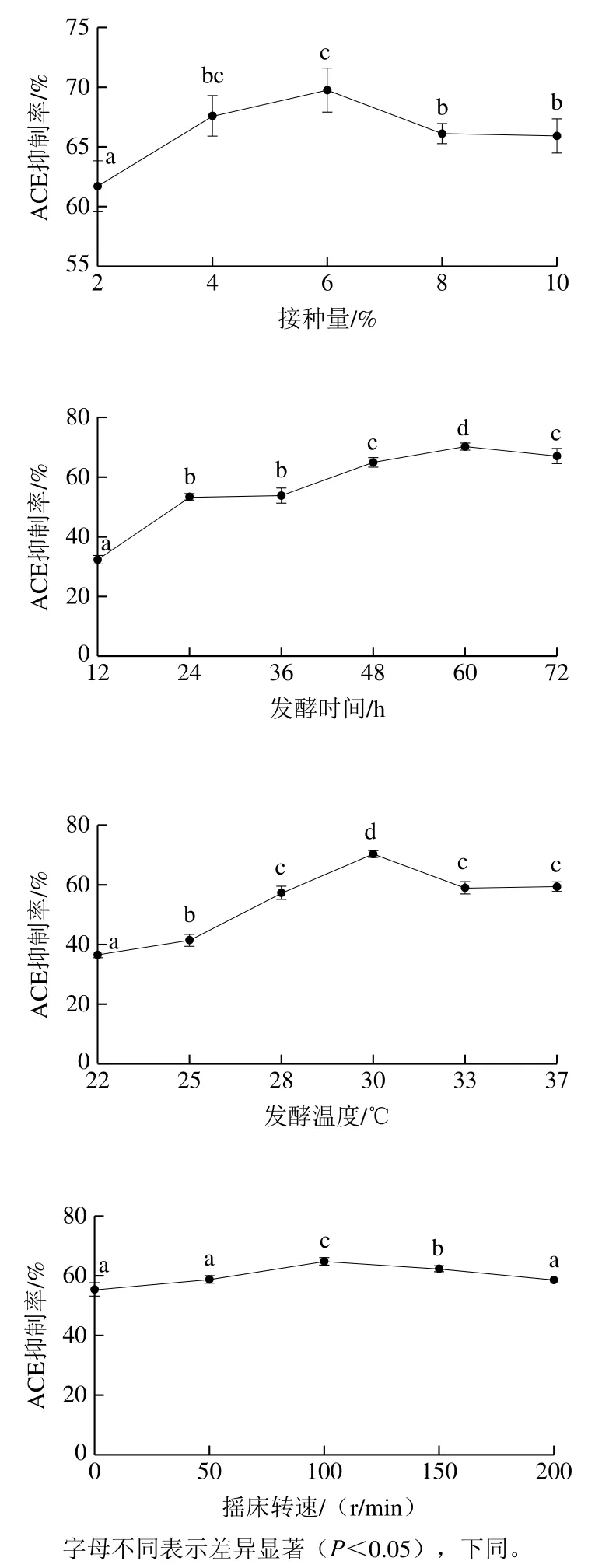
圖3 不同因素發(fā)酵馬乳的ACE抑制活性Fig. 3 Effect of fermentation conditions on the ACE-inhibiting activity of fermented horse milk
2.5 乳酸菌與酵母菌共發(fā)酵馬乳ACE抑制活性的響應(yīng)面優(yōu)化分析
采用二階模型描述ACE抑制率和不同發(fā)酵條件之間的關(guān)系。Y為ACE抑制活性的預(yù)測值,X1、X2、X3和X4分別為發(fā)酵溫度、發(fā)酵時間、接種量和轉(zhuǎn)速的實際值。獲得響應(yīng)值A(chǔ)CE抑制率的回歸模型方程式為:
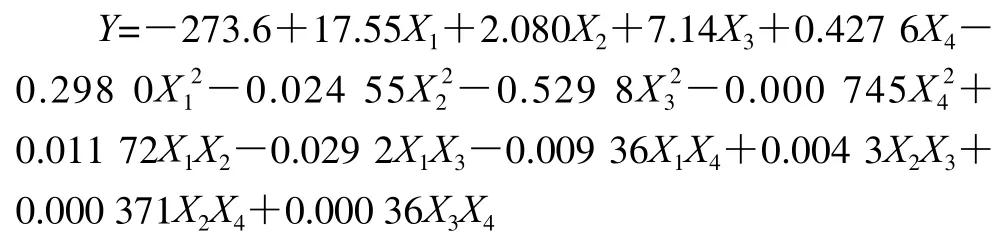
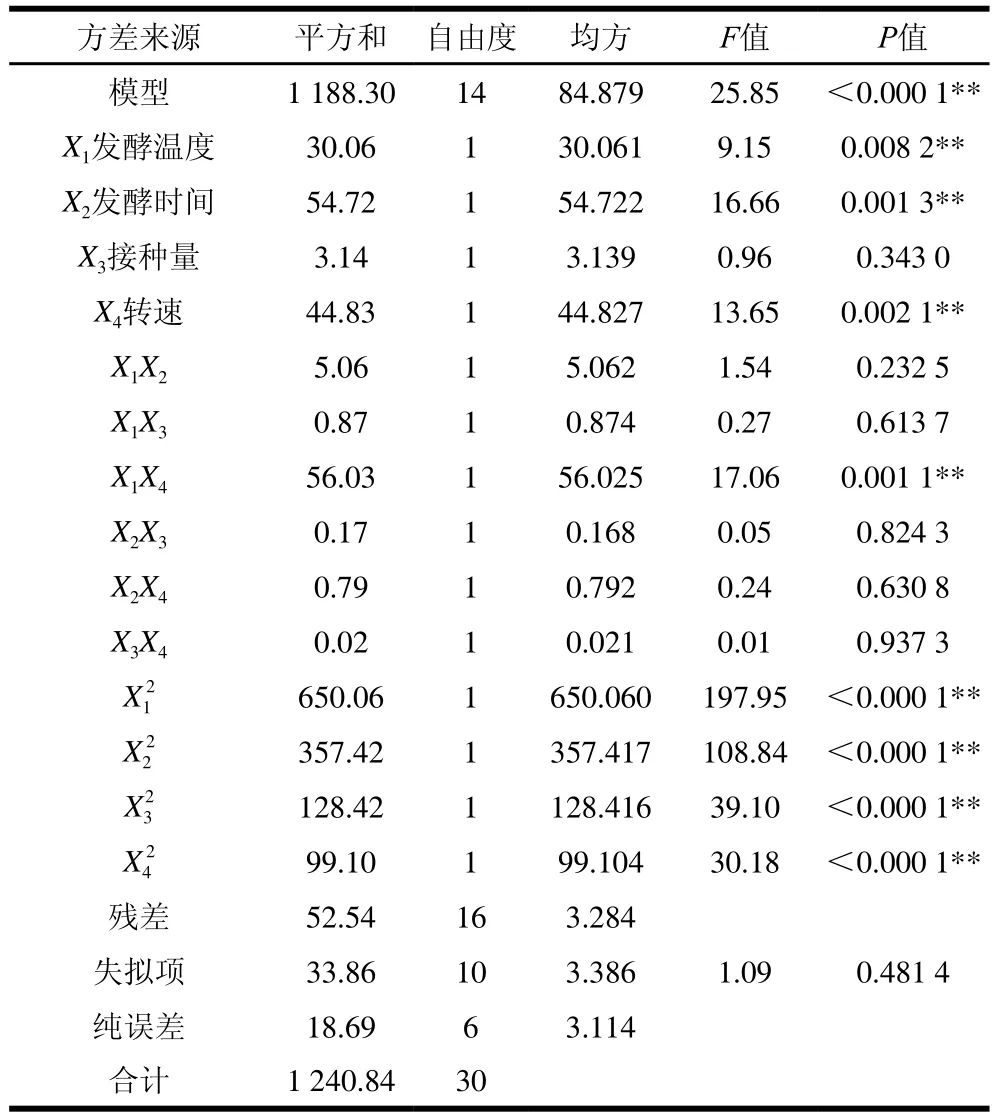
表6 回歸模型系數(shù)顯著性檢驗Table 6 Analysis of variance of quadratic polynomial model and significance test
由表6可知,模型顯著(P<0.000 1),失擬項不顯著(P>0.05),模型復(fù)相關(guān)系數(shù)R2為0.957 7,校正決定系數(shù)R2為0.920 6,說明該模型擬合度較高。各因素對發(fā)酵馬乳ACE抑制率的影響程度從強到弱依次為:發(fā)酵時間>轉(zhuǎn)速>發(fā)酵溫度>接種量。結(jié)合表中F值可知,發(fā)酵溫度(X1)、發(fā)酵時間(X2)和轉(zhuǎn)速(X4)對ACE抑制率線性效應(yīng)極顯著(P<0.01),且對響應(yīng)值的曲面效應(yīng)極顯著,而接種量(X3)線性效應(yīng)(P=0.343)和響應(yīng)值的曲面效應(yīng)不顯著。參數(shù)間的交互效應(yīng)也會對響應(yīng)值A(chǔ)CE抑制率產(chǎn)生影響,交互項X1X4的P值為0.001 1,表明發(fā)酵溫度與轉(zhuǎn)速的相互作用對ACE抑制率有顯著影響。如圖4所示,當發(fā)酵溫度和轉(zhuǎn)速向最優(yōu)點增加時,ACE抑制率顯著增加,溫度在24.8~31.4 ℃、轉(zhuǎn)速在60~190 r/min之間時ACE抑制率處于較高水平。進一步對以上實驗?zāi)P瓦M行典型性分析,溫度29 ℃、發(fā)酵時間52 h、接種量6%、轉(zhuǎn)速115 r/min為最優(yōu)發(fā)酵條件。
最優(yōu)條件下組合發(fā)酵與單菌發(fā)酵的實驗結(jié)果如表7所示,Y7+L8發(fā)酵結(jié)束后Y7的活菌數(shù)顯著高于Y7單菌發(fā)酵的活菌數(shù),L8的活菌數(shù)顯著低于L8單菌發(fā)酵的活菌數(shù)。Y7+L8發(fā)酵的pH值和酸度介于Y7和L8單菌發(fā)酵之間。Y7+L8發(fā)酵馬乳的水解度為0.65 mg/mL,ACE抑制率為80.67%,均顯著高于單菌發(fā)酵。
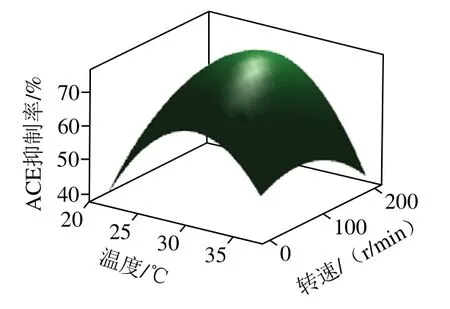
圖4 發(fā)酵溫度和轉(zhuǎn)速對發(fā)酵馬乳ACE抑制活性影響的響應(yīng)面圖Fig. 4 Response surface plot for the interactive effects of fermentation temperature and rotation speed on the ACE-inhibiting activity of fermented horse milk
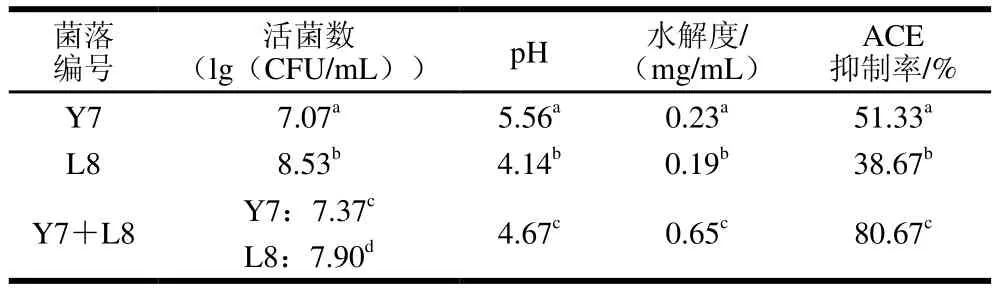
表7 乳酸菌與酵母菌單菌和共發(fā)酵ACE抑制活性及發(fā)酵特征比較Table 7 Comparison of ACE-inhibiting activity and fermentation characteristics between single-strain and mixed-strain fermentation
2.6 乳酸菌與酵母菌發(fā)酵馬乳對蛋白組成的影響
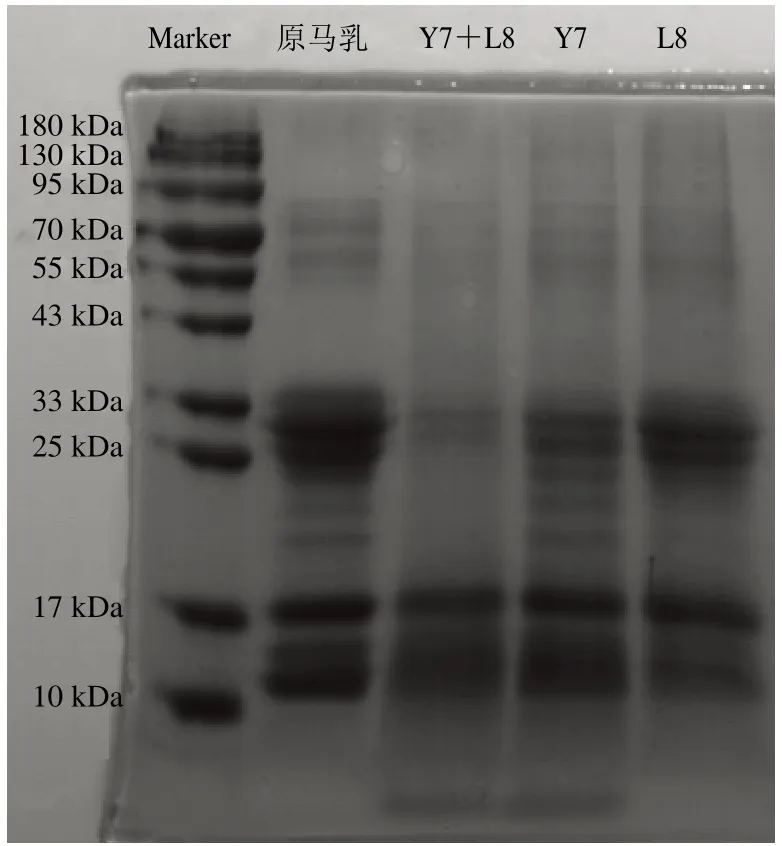
圖5 單菌發(fā)酵與共發(fā)酵的蛋白水解情況Fig. 5 Protein hydrolysis during single-strain fermentation and co-fermentation
單菌發(fā)酵與共發(fā)酵馬乳的SDS-PAGE如圖5所示,總體上Y7和L8單菌發(fā)酵馬乳與原馬乳相比蛋白有輕微的水解,其中Y7對蛋白的水解強于L8;Y7+L8共發(fā)酵對馬乳蛋白的水解能力顯著增強。參考Egito等[22]對馬乳中β-酪蛋白的鑒定,分子質(zhì)量為25.5 kDa左右的β-酪蛋白幾乎被完全水解,參考包艷青[23]對馬乳乳清蛋白的鑒定,分子質(zhì)量為18.5 kDa左右乳清蛋白部分水解,但分子質(zhì)量為14.2 kDa左右的β-乳球蛋白幾乎沒有水解。RP-HPLC實驗結(jié)果如圖6所示,L8和Y7單菌發(fā)酵對馬乳蛋白的水解能力很弱,其中Y7的水解能力強于L8。Y7+L8組合發(fā)酵對馬乳蛋白的水解能力顯著增強,結(jié)果與水解度和SDSPAGE的結(jié)果一致。
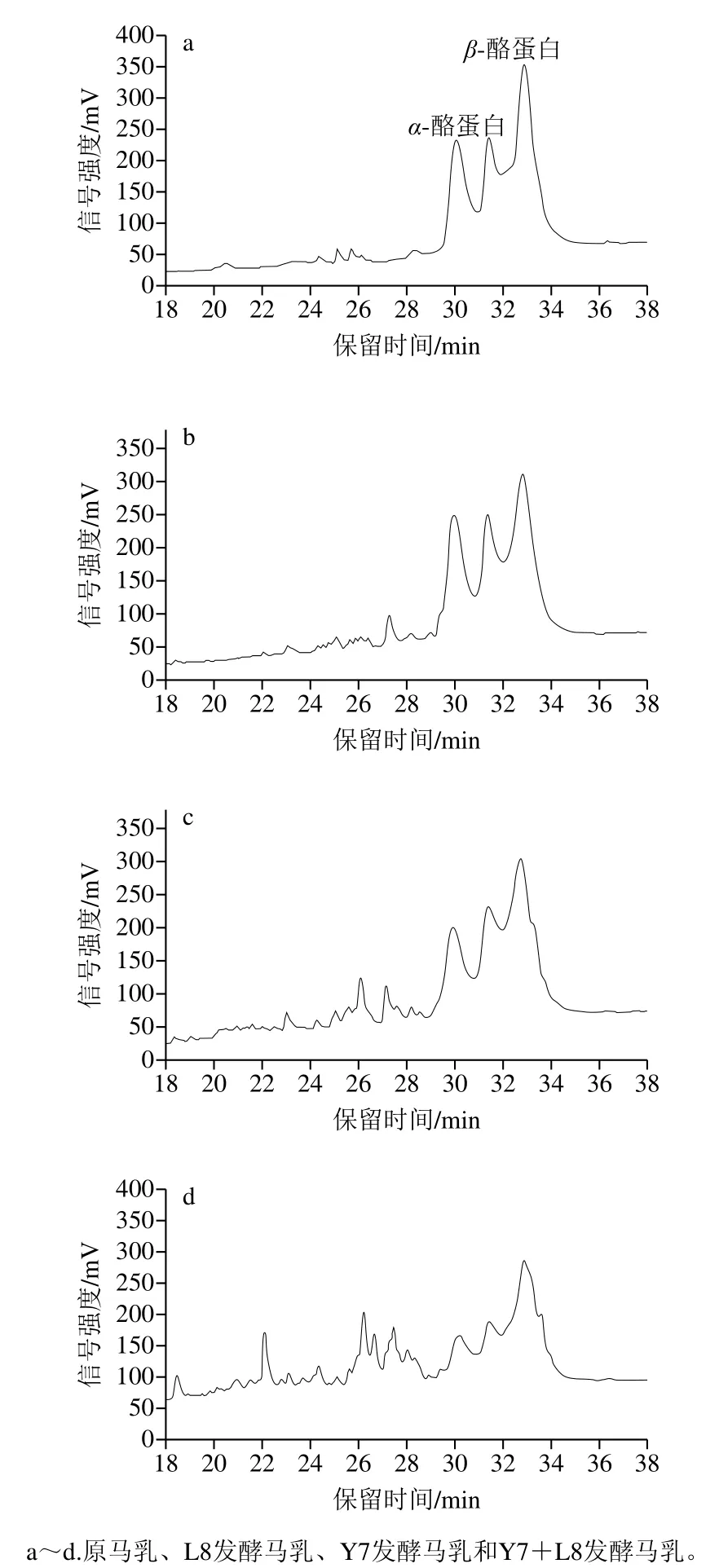
圖6 單菌發(fā)酵與共發(fā)酵的蛋白RP-HPLC圖譜Fig. 6RP-HPLC profiles of proteins in fermented milk produced by single-strain or co-fermentation
2.7 馬乳發(fā)酵產(chǎn)物ACE抑制組分的分離
組合發(fā)酵馬乳后經(jīng)葡聚糖G-25凝膠色譜對粗提物進行分離,得到4 個峰,如圖7所示。分別對4 個峰進行收集凍干,并以20 mg/mL質(zhì)量濃度溶于去離子水中進行ACE抑制率的測定。如圖8所示,4 個峰對ACE的抑制率分別為86%、30.5%、15%和24%。其中1號峰對ACE的抑制率顯著高于其他3 個峰,因此選取1號峰進行后續(xù)的分離純化。
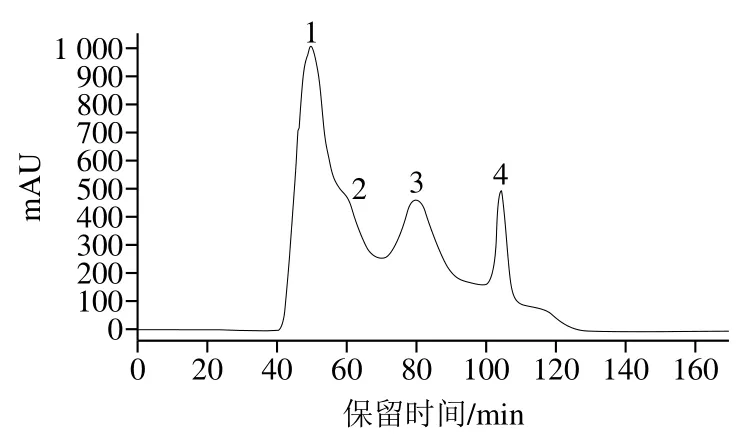
圖7 葡聚糖G-25凝膠色譜分離圖譜Fig. 7 Separation of ACE inhibiting peptides in fermented horse milk by Sephadex G-25 chromatography
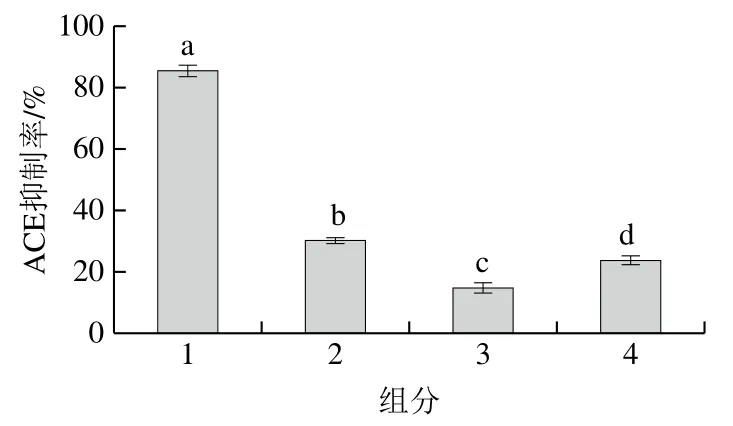
圖8 葡聚糖G-25凝膠色譜分離所得各組分的抑制率Fig. 8 ACE-inhibiting activity of fractions from Sephadex G-25 chromatography
2.8 馬乳發(fā)酵產(chǎn)物ACE抑制活性組分的耐消化特性
對葡聚糖G-25凝膠色譜分離的1號峰進行體外模擬胃消化及胃腸消化,HPLC如圖9所示,體外模擬胃消化與未消化相比保留時間短的肽段變化不明顯,一些保留時間長的疏水性強的肽段被水解為更多親水短肽;經(jīng)體外模擬胃腸消化后的肽段和疏水性肽段都明顯增多,水解液的活性隨之加強。測定消化前、胃消化及胃腸消化后的ACE半抑制濃度分別為 4.77、3.11 mg/mL和2.02 mg/mL,經(jīng)過胃消化和胃腸消化后ACE半抑制濃度逐漸降低,ACE抑制率增強(圖10)。
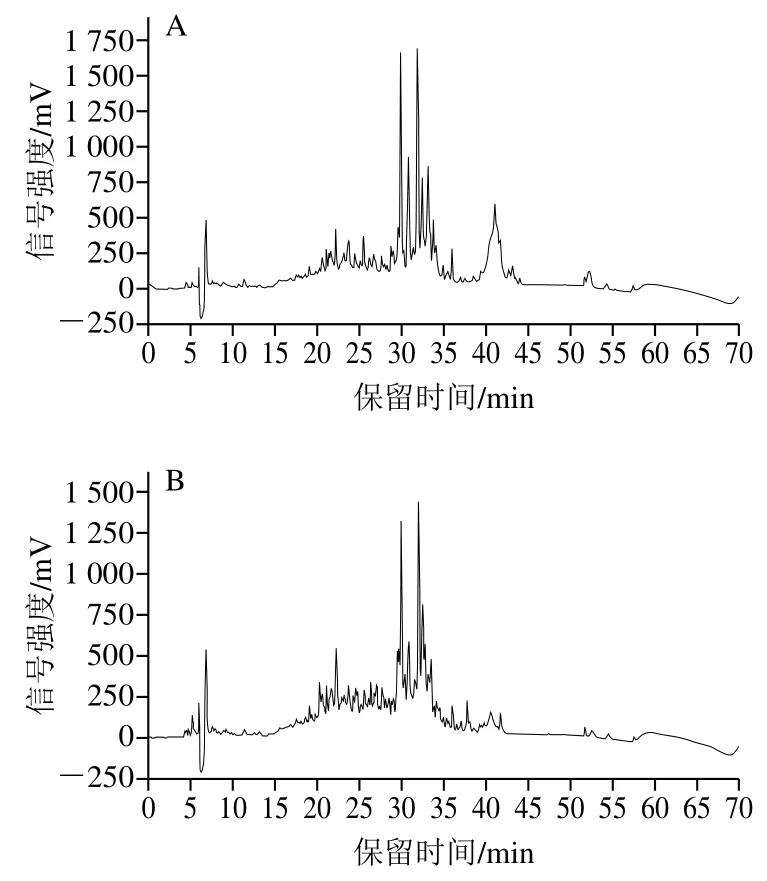
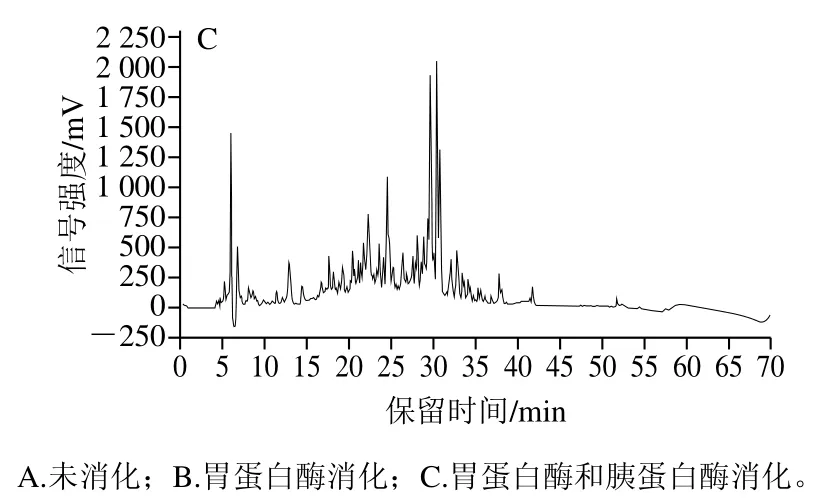
圖9 高活性組分體外模擬胃腸消化前后的肽譜變化Fig. 9 Changes in peptide profile before and after in vitro gastrointestinal digestion of ACE-inhibiting peptide
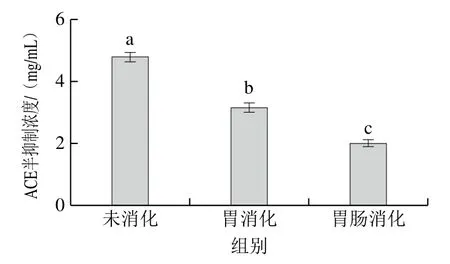
圖10 高活性組分體外模擬胃腸消化前后半抑制濃度的變化Fig. 10 Changes in IC50 of ACE-inhibiting peptide before and after in vitro gastrointestinal digestion
3 討 論
近年來隨著對乳源活性肽的研究,開發(fā)具有生物活性的發(fā)酵乳產(chǎn)品和篩選乳源生物活性肽逐漸成為國內(nèi)外的研究熱點。食源性ACE抑制肽是備受關(guān)注的生物活性肽,有研究表明用不同的乳酸菌發(fā)酵牛乳[24-25]、羊乳[26-27]和馬乳[28]能夠獲得ACE抑制肽。也有研究報道用來自傳統(tǒng)酸馬乳的酵母菌發(fā)酵牛乳能產(chǎn)ACE抑制肽[29-30],然而用酵母菌單獨發(fā)酵馬乳或乳酸菌和酵母菌共發(fā)酵馬乳產(chǎn)ACE抑制肽的研究鮮見報道。酵母菌是重要的乳源微生物資源,尤其在傳統(tǒng)含醇發(fā)酵乳如開菲爾、酸馬乳中的酵母菌是不可缺少的功能菌種,其數(shù)量可達106CFU/mL[15],而且與只用乳酸菌發(fā)酵的發(fā)酵乳不同的是酸馬乳在傳統(tǒng)醫(yī)學(xué)的臨床應(yīng)用中具有降血壓作用[4]。本研究通過從傳統(tǒng)酸馬乳中篩選的酵母菌發(fā)酵馬乳,發(fā)酵馬乳的ACE抑制率最高達到50%,高于乳酸菌發(fā)酵的馬乳所能達到的最高水平37.33%。說明酵母菌發(fā)酵馬乳不僅能釋放出ACE抑制肽,而且酵母菌的蛋白水解酶酶切位點可能更有利于水解馬乳蛋白釋放出特定ACE抑制肽。
傳統(tǒng)的含醇發(fā)酵乳制品是由多種乳酸菌和酵母菌等微生物自然發(fā)酵而成的,它們在長期適應(yīng)乳環(huán)境和發(fā)酵條件的過程中形成了特定的共生關(guān)系[31],這樣不僅給發(fā)酵乳賦予了豐富而獨特的風(fēng)味特征,而且可能帶來更加多樣的生物活性。本研究使用乳酸乳球菌與解脂耶氏酵母共發(fā)酵馬乳通過單因素和響應(yīng)面優(yōu)化發(fā)酵條件之后其ACE抑制率為80.67%,比單獨酵母的提高了29.34%,比乳酸菌提高了42%。共發(fā)酵52 h后解脂耶氏酵母的活菌數(shù)為7.37(lg(CFU/mL))顯著高于解脂耶氏酵母單獨發(fā)酵的活菌數(shù)7.07(lg(CFU/mL)),乳酸乳球菌的活菌數(shù)為7.90(lg(CFU/mL))顯著低于乳酸乳球菌單獨發(fā)酵的活菌數(shù)8.53(lg(CFU/mL))。共發(fā)酵的pH值介于單菌發(fā)酵之間,水解度顯著高于單菌發(fā)酵。共發(fā)酵體系中的乳酸乳球菌對解脂耶氏酵母的生長有一定的促進作用,從而增加了酵母菌對乳蛋白的水解,而解脂耶氏酵母對乳酸乳球菌的生長有抑制作用。王小標等[32]研究證明乳酸菌在馬乳中的生長代謝過程降低了乳制品的pH值,提供一個適宜的酸性環(huán)境促進了酵母菌的生長,而酵母菌分解脂肪生成的脂肪酸會抑制乳酸菌的生長。Chaves-Lopez等[30]用酵母菌、植物乳桿菌和糞腸球菌共發(fā)酵也能夠提高發(fā)酵ACE抑制肽的產(chǎn)生。本研究水解馬乳蛋白能力高的菌株普遍ACE抑制率也高,而且主要水解的是馬乳β-酪蛋白,說明蛋白水解度和ACE抑制率之間存在相關(guān)性,ACE抑制組分可能來源于馬乳的β-酪蛋白。Chen等[14]從傳統(tǒng)酸馬乳中分離出的ACE抑制肽來源于馬乳的β-酪蛋白(f213~241)證明了β-酪蛋白是較好的ACE抑制肽來源蛋白。
食源性生物活性肽只有被腸道吸收進入血液循環(huán)才能發(fā)揮其相應(yīng)的作用,然而在此過程中肽分子會受到胃腸消化酶的水解作用,因此生物活性肽經(jīng)過胃腸道消化后能否保持其活性至關(guān)重要。Iroyukifujita等[33]對ACE抑制肽經(jīng)胃腸消化后的抑制效果進行了研究,將經(jīng)過胃腸道消化后抑制活性增強的物質(zhì)稱為前藥。本實驗用乳酸菌與酵母菌共發(fā)酵馬乳分離得到的ACE抑制組分經(jīng)過胃腸消化后,其半抑制濃度從4.77 mg/mL降至2.02 mg/mL。該活性組分不僅能夠抵抗胃腸消化,而且經(jīng)胃腸消化后活性顯著提高,在體內(nèi)具有發(fā)揮較好降壓作用的潛能,屬于前藥類。王宇等[34]用乳酸菌發(fā)酵的牛乳具有ACE抑制活性并能很好地抵抗胃腸消化,與本研究結(jié)果相似。然而,ACE抑制肽在體內(nèi)的作用效果及其作用機制需要繼續(xù)進行活性肽的分離并用細胞實驗和動物實驗進一步驗證。
本研究利用特定的乳酸菌與酵母菌共發(fā)酵馬乳,獲得了在體外具有降壓作用的肽組分。說明了馬乳能作為ACE抑制肽的蛋白來源,除此之外,進一步證實了酵母菌能夠釋放ACE抑制肽,并且酵母菌與乳酸菌的共生系統(tǒng)能夠更好地發(fā)揮該作用。研究結(jié)果對更廣泛挖掘利用微生物資源具有重要意義和價值,也為闡明酸馬乳降壓作用的機制提供了新視角。

