哈維弧菌flhF和CU052_26825缺失株的構建及其生物學特性
鄧益琴,張亞秋,3,林梓陽,4,馮 娟,程長洪,馬紅玲,劉廣鑫,蘇友祿
哈維弧菌和缺失株的構建及其生物學特性
鄧益琴1,張亞秋1,3,林梓陽1,4,馮 娟1,程長洪1,馬紅玲1,劉廣鑫1,蘇友祿2
(1.中國水產科學研究院南海水產研究所 / 農業農村部南海漁業資源開發利用重點實驗室,廣東 廣州 510300;2.廣東省水環境與水產品安全工程技術研究中心 / 仲愷農業工程學院動物科技學院,廣東 廣州 510225;3.上海海洋大學水產與生命學院,上海 201306;4.海南大學海洋學院,海南 海口 570228)
【目的】研究哈維弧菌()345的GTP結合蛋白編碼基因和未知功能基因的生物學功能。【方法】利用同源重組技術構建345的和的缺失突變株,比較野生株和突變株的生長、運動性、胞外酶活性、耐藥性等生物學特性以及對花鱸()的毒性。【結果】基因和的缺失均不影響菌株的生長、運動性、胞外蛋白酶活性、對H2O2和Cu2+的壓力感應、對鐵的吸收利用、對大多數被測抗生素的抗性以及對花鱸的毒性;但和缺失后對氯霉素和氟苯尼考兩種氯霉素類抗生素均更加敏感。此外,缺失后,細菌生物膜形成能力顯著增強。【結論】和均參與調控哈維弧菌對氯霉素類抗生素的耐藥性,還參與調控哈維弧菌生物膜形成。
哈維弧菌;基因敲除;;;生物學特性;氯霉素類耐藥性
弧菌病是一種流行范圍廣、危害極為嚴重的水產動物傳染性疾病,極大地阻礙了水產養殖業的健康發展。哈維弧菌()是導致中國華南沿岸海水魚感染和死亡最主要的病原弧菌,是養殖業主要影響因素之一[1-2]。由于疫苗和免疫增強劑等其他防控方法的局限性,抗生素廣泛用于預治水產養殖細菌性疾病[3];但抗生素的過度使用會導致耐藥和多重耐藥細菌產生和積累[4]。Deng等[5]發現,華南沿岸分離的弧菌對所測試15種抗生素的耐藥指數可達0.60。Sadat等[6]從埃及魚貝中分離的副溶血弧菌()和溶藻弧菌()的多重耐藥率分別為69.04%和38%。這些均說明細菌高耐藥的嚴峻形勢。因此,深入認識生物耐藥性的發生與發展機制,是保證藥物正確使用的前提和基礎。
GTP結合蛋白編碼基因與細菌運動性、生物膜形成和毒力相關[7]。本課題組發現,對數期哈維弧菌于40℃下熱擊60 min后,未知功能基因表達量下降約30倍,而溫度對細菌致病性有潛在影響[8];因此,可能與哈維弧菌毒力相關。本研究利用同源重組技術構建致病性哈維弧菌 () 345的染色體上基因和未知功能基因[9]的缺失突變株,比較野生株與突變株的生長、運動性、胞外酶活性、耐藥性等多種生物學特性以及對花鱸()的毒性,為哈維弧菌和的基因功能研究奠定基礎,為防治哈維弧菌病提供理論依據。
1 材料與方法
1.1 材料
1.1.1 菌株、質粒和引物 哈維弧菌345由中國水產科學研究院南海水產研究所漁業生物病害防治研究室(下稱“本實驗室”)分離自中國南部沿海患病石斑魚()[9];自殺質粒pSW7848[10]、表達質粒pMMB207[11]、大腸桿菌Π3813[12]和GEB883[13]分別來自Didier Mazel、Zhao Zhe、Didier Mazel和Annick Jacq教授,并保存于本實驗室。所用引物見表1。
1.1.2 主要試劑 高保真酶PrimeSTAR?Max DNA polymerase、普通PCR酶Premix?(TaKaRa? Version 2.0)及限制性內切酶I購自Takara公司;瓊脂糖凝膠DNA回收試劑盒、DNA產物純化試劑盒購自天根生物科技(北京)有限公司;-葡萄糖、-阿拉伯糖、氯霉素、2′-脫氧胸苷(2′-Deoxythymidine,Thy)和2-2′-聯吡啶(2,2′-Dipyridyl,DIP)購自生工生物工程(上海)股份有限公司;2,6-二氨基丙烯酸(2,6-Diaminopimelic acid,DAP)購自Sigma公司;等溫組裝試劑盒ClonExpressMultiS One Step Cloning Kit購自Vazyme公司;抗生素藥敏紙片購自杭州天和微生物試劑有限公司。
1.1.3 主要培養基 LB(luria-bertani)培養基、MH肉湯培養基和技術瓊脂粉購自廣東環凱生物科技有限公司。1 L LB含10 g胰蛋白胨、5 g酵母提取物、10 g氯化鈉。1 L固體培養基含15 g瓊脂粉。將LB培養基氯化鈉質量濃度提高至30 g·L?1,即制得LBS(luria-bertani-salt)培養基。
1.1.4 實驗用魚 花鱸()購自深圳一養殖場。

表1 本研究所用引物
1.2 方法
1.2.1和缺失株的構建 參考Zhang等[14]方法并稍作修改。用引物對pSW7848-F/R線性化自殺質粒pSW7848。用引物對-UP-F/R和-DOWN-F/R擴增上、下游同源臂片段,并用引物對-UP-F/R、-DOWN-F/R擴增上、下游同源臂片段。使用等溫組裝試劑盒等溫組裝線性化質粒pSW7848和上下游同源臂片段,以及線性化質粒pSW7848和上下游同源臂片段。將等溫組裝液轉化進入接合作用中間宿主菌Π3813,用含有20 μg/mL氯霉素和0.3 mmol/L Thy的LB平板篩選可能成功的重組子,并用質粒檢測引物對Del-check-pSW7848-F/R對重組自殺質粒進行PCR和測序檢測,組裝成功的質粒PCR片段大小均約為2.3 kb,分別命名為pSW7848-Δ和pSW7848-Δ。進一步將重組自殺質粒pSW7848-Δ和pSW7848-Δ轉化進入接合作用供體菌GEB883。通過接合作用分別將重組自殺質粒pSW7848-Δ和pSW7848-Δ送入受體菌哈維弧菌野生株345。基于自殺質粒pSW7848在哈維弧菌中不能自主復制、有氯霉素抗性、毒性基因的表達受葡萄糖抑制而受阿拉伯糖誘導的特點[10],用含34 μg/mL氯霉素和2 g/L-葡萄糖的LBS平板進行第1次篩選,用含34 μg/mL氯霉素和2 g/L-阿拉伯糖的LBS平板進行第2次反向篩選,重組自殺質粒上基因的上下游同源臂片段分別與哈維弧菌基因組和基因的上下游同源臂片段發生兩次同源重組,得到哈維弧菌和缺失株,分別命名為345Δ和345Δ。
1.2.2和回補株的構建 參考Liu等[11]方法并稍作修改。用引物對pMMB207-F/R線性化回補質粒pMMB207。用引物對-F/R和-F/R分別擴增和基因回補片段(包括啟動子+ORF序列+終止子)。用等溫組裝試劑盒等溫組裝線性化質粒pMMB207和回補片段,以及線性化質粒pMMB207和回補片段。將等溫組裝液轉化入接合作用中間宿主菌Π3813,用含20 μg/mL氯霉素和0.3 mmol/L Thy的LB平板篩選可能成功的重組子,進一步用質粒檢測引物對com-check-pMMB207-F/R對重組質粒進行PCR和測序,組裝的PCR片段約為2.5、2.7 kb,分別命名為pMMB207-compMMB207-com。將重組回補質粒pMMB207-com和pMMB207-com轉化進入接合作用供體菌GEB883。通過接合作用將重組回補質粒pMMB207-com送入受體菌哈維弧菌的缺失株345Δ,并將重組回補質粒pMMB207-com送入受體菌哈維弧菌CU052_26825的缺失株345Δ。基于回補質粒pMMB207在哈維弧菌中能自主復制,有氯霉素抗性[11],用含34 μg/mL氯霉素的LBS平板篩選并純化2次,得到哈維弧菌和回補株,分別命名為345Δ-pMMB207-com-和345ΔpMMB207-com。同時,通過接合作用分別將回補質粒pMMB207送入受體菌哈維弧菌野生株345、的缺失株345Δ以及的缺失株345Δ,得到哈維弧菌345-pMMB207、345Δ-pMMB207及345Δ-pMMB207。
1.2.3 菌株生長分析 菌液制備:將野生株345,缺失突變株345Δ345Δ劃線于LBS平板,于28℃培養16 h,挑取單克隆分別接種至LBS液體培養基,于28℃、200 r·min–1條件下振搖培養16 ~ 24 h。用新鮮的LBS液體培養基將菌液稀釋至光密度(600 nm)= 0.001,按100 μL/孔分裝于96孔板,并用Spark微孔板檢測儀(TECA)測定不同時間點細菌光密度(600 nm),繪制生長曲線。實驗重復3次,由于3次重復結果相同,選擇1次代表性結果呈現,并使用IBM SPSS Statistics 19軟件進行單因素協方差分析(ANCOVA)[以野生株和缺失突變株為固定因子,以時間為協變量,以(600 nm)值為因變量]。
1.2.4 細菌游動性(Swimming)和涌動性(Swarming)測試 參考Zhang等[14]方法進行。按1.2.3制備菌液,用新鮮的LBS液體培養基將菌液稀釋至(600 nm) = 3.0,每個菌株取3 μL平行3次點樣到含3 g/L瓊脂的LBS半固體平板上,于28℃下靜置培養16 h,測量菌斑直徑,測試其游動性;同時取3 μL平行3次點樣到含3 g/L瓊脂的LBS固體平板上,于28℃下靜置培養24 h,測菌斑直徑,測試其涌動性。實驗重復3次。用IBM SPSS Statistics 19軟件進行Student’s檢驗,=0.05作為統計學顯著性閾值。
1.2.5 細菌生物膜形成能力分析 參考Zhang等[14]方法進行。按1.2.3制備菌液,用新鮮LBS液體培養基將菌液稀釋至(600 nm) = 3.0,取50 μL菌液接種到裝有5 mL LBS液體培養基的無菌玻璃試管,于28 ℃下靜置培養48 h,加入200 μL 26 g/L的結晶紫(終質量濃度為1 g/L)染色5 min,棄菌液,并用水輕輕沖洗幾次,加入200 μL 330 mL/L冰乙酸充分溶解結晶紫,測定570 nm處光密度值(570 nm)。重復實驗3次,數據處理同1.2.4。
1.2.6 細菌胞外蛋白酶活性測試 參考Zhang等[14]方法進行。制備1.2.3的菌液,用新鮮LBS液體培養基稀釋至(600 nm) = 3.0,取3 μL平行3次點樣到含15 g/L脫脂奶粉的LBS固體平板上,于28℃下靜置培養24 h,測量蛋白質透明分解圈直徑,以指示細菌蛋白酶活性。實驗重復3次,數據處理同1.2.4。
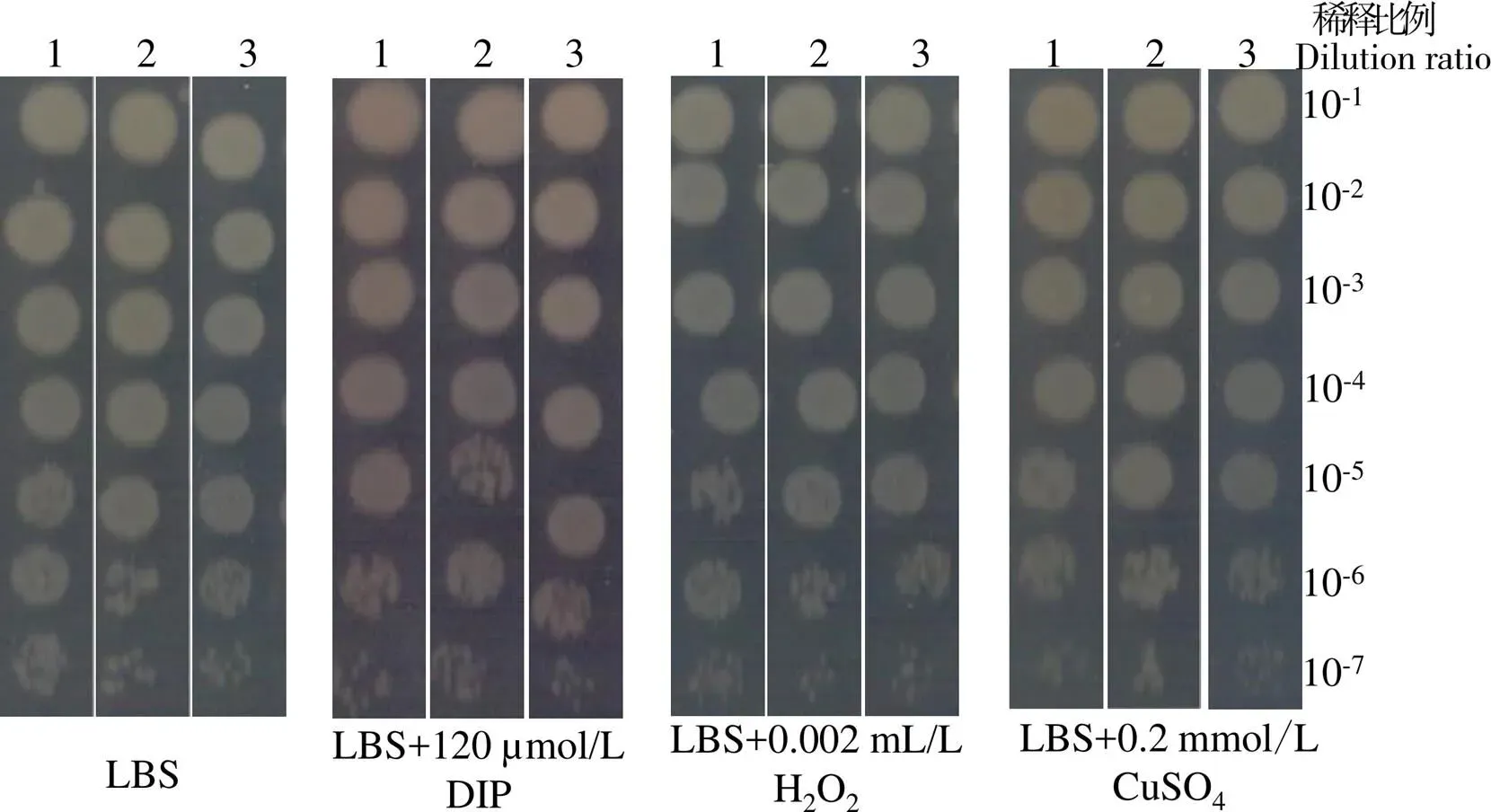
1.2.7 菌株對H2O2、Cu2+抗性以及對鐵離子的吸收能力測試 參考張亞秋[15]方法進行。按1.2.3制備菌液,用新鮮LBS液體培養基稀釋至(600 nm) = 3.0,并以10倍梯度稀釋各菌株菌液至最高稀釋倍數107,將稀釋的菌液分別取3 μL平行3次點樣到LBS平板,以及添加有0.002 mL/L H2O2或0.2 mmol/L CuSO4或120 μmol/L DIP的LBS平板上,于28℃下靜置培養24 h,觀察各菌株生長情況,實驗重復3次。
1.2.8 菌株對不同抗生素的敏感性測試 按1.2.3制備菌液,吸取600 μL菌液于10 mL無菌9 g/L生理鹽水中,傾入寬13 cm的正方形LBS平板,將培養基表面全部潤濕,棄去培養皿內多余菌液,靜置約10 min,待培養基表面菌液全部晾干,將各抗生素紙片置于平板上,于28℃下靜置培養24 h,觀察并測量抑菌圈直徑。重復實驗3次,數據處理同1.2.4。
參考吳金軍[16]方法分析菌株對抗生素的最低抑菌濃度(Minimum inhibitory concentration,MIC):用MH肉湯培養基將培養16 ~ 24 h菌液濃度調至1×106cfu/mL得上樣菌懸液。制備質量濃度為128 μg/mL抗生素母液,在無菌細胞培養板第1 ~ 10孔中加入100 μL無菌MH肉湯培養基,在第1孔中加入100 μL抗生素母液,反復吹吸,混勻,吸取100 μL至第2孔,反復吹吸,混勻,吸取100 μL至第3孔,以此稀釋至第10孔,每孔終體積為100 μL。向第1 ~ 10孔中加入上樣菌懸液,反復吹吸,充分混勻,每孔終體積為200 μL,在第11、12孔中分別加入200 μL無菌MH肉湯培養基(陰性對照)和待測菌株懸液(陽性對照),每個樣品設置3個平行。上樣后置于28℃恒溫培養箱中培養20 h,根據美國臨床和實驗室標準協會CLSI文件判讀實驗結果[17]。
1.2.9 菌株毒力測試 取花鱸240尾,于容積100 L的塑料桶中暫養2周,用氣石不間斷充氣。將菌株345-pMMB207、345Δ-pMMB207、345Δ-pMMB207、345Δ-pMMB207-com和345Δ-pMMB207-com劃線于LBS平板,于28℃下培養16 ~ 24 h,挑取單克隆分別接種至LBS玻璃斜面的固體培養基,于28℃下培養16 h,每個斜面用3 mL生理鹽水洗下菌體。野生株345-pMMB207對花鱸的半致死劑量LD50為4.49×104cfu/g[18],將345-pMMB207、345Δ-pMMB207、345Δ-pMMB207-com稀釋至8×LD50,而將345-pMMB207、345Δ-pMMB207、345Δ-pMMB207- com稀釋至10×LD50,按100 μL/尾對花鱸腹腔注射菌液,每株菌注射30尾,按10尾/桶分別養殖于3個100 L塑料桶,用氣石不間斷充氣。同時設3桶注射同劑量生理鹽水作為對照組。觀察7 d內花鱸死亡情況,比較各組花鱸死亡率差異。
2 結果
2.1 flhF和CU052_26825缺失突變株構建
擴增所得線性化自殺質粒pSW7848片段約3.3 kb(圖1(a)),上下游同源臂片段均約為1 kb(圖1(b-c)),與預期片段大小相同。重組自殺質粒PCR擴增檢測到約2.3 kb的片段(圖1(d–e)),與預期片段大小相同,表明重組自殺質粒pSW7848-Δ和pSW7848-Δcom構建成功。重組自殺質粒上的和上下游同源臂片段通過接合作用分別與哈維弧菌野生株345的和上下游同源臂片段發生2次同源交換,缺失株PCR檢測結果表明,對于基因,野生株可擴增得1 604 bp的片段,而缺失株可擴增出589 bp的片段(圖1(f)),獲得缺失突變株;對于基因,野生株可擴增得1 792 bp的片段,而缺失株可擴增出341 bp的片段(圖1(g)),獲得缺失突變株。

M1,DNA分子標準DL5000,各條帶依次為5 000、3 000、2 000、1 500、1 000、750、500、250、100 bp;M2,DNA分子標準為 DL2000,各帶依次為2 000、1 000、750、500、250、100 bp;1,pSW7848線性片段;2-3,分別為上、下游同源臂片段;4-5,分別為上、下游同源臂片段;6-7,分別為重組子pSW7848-ΔpSW7848-Δ檢測片段;8,野生株345檢測片段;9,候選突變株檢測片段;10,野生株檢測片段;11,候選突變株檢測片段;其他未標注泳道為同時跑膠的其他實驗結果。
M1, DNA Marker DL5000, and the segment size are 5 000, 3 000, 2 000, 1 500, 1 000, 750, 500, 250, 100 bp, respectively; M2, DNA Marker DL2000, and the segment size are 2 000, 1 000, 750, 500, 250, 100 bp, respectively; 1, Linearized segment of pSW7848; 2-3, upstream and downstream homologous segments of; 4-5, upstream and downstream homologous segments of; 6-7, segment of recombinant suicide vector pSW7848-Δ, pSW7848-Δ; 8, segment of345; 9, segment ofdeletion mutant; 10, segment of; 11, segment ofdeletion mutant; The rest unlabeled lanes are the results of other experiment.
圖1和缺失突變株的PCR鑒定
Fig.1 PCR identification for deletion mutants with deletedand
2.2 flhF和CU052_26825回補株構建
擴增得約7.5 kb的線性表達質粒pMMB207片段(圖2(a)),與預期片段大小相同。擴增得和的回補片段,分別為2 164、2 359 bp(圖2(b-c))。引物對com-PMMB207-check-F/R對二回補株分別擴增得2 469、2 664 bp的片段(圖2(d))。

M1,DNA 分子標準DL15 000,從上到下條帶依次為15 000、10 000、7 500、5 000、2 500、1 000 bp;M2,DNA 分子標準DL5 000,從上到下條帶依次為5 000、3 000、2 000、1 500、1 000、750、500 bp;1,pMMB207線性化片段;2,基因回補片段;3,基因回補片段;4-5,回補重組子pMMB207-compMMB207-com的檢測片段。
M1, DNA Marker DL15000, and the segment size are 15 000, 10 000, 7 500, 5 000, 2 500, 1 000 bp, respectively; M2, DNA Marker DL5 000, and the segment size are 5 000, 3 000, 2 000, 1 500, 1 000, 750, 500 bp, respectively; 1, pMMB207 linearization segment; 2, the complemented segment of; 3, the complemented segment of; 4-5, the complemented recombinant segments ofand.
圖2和的回補株PCR鑒定
Fig.2 PCR identification for complemented strain ofand
2.3 哈維弧菌flhF和CU052_26825缺失株的生長
因3次重復結果相同,選擇1次代表性結果進行分析。圖3可見,在LBS培養基中,缺失株345Δ345Δ的生長與野生株均無顯著差異(> 0.05),表明和均不影響哈維弧菌的生長。
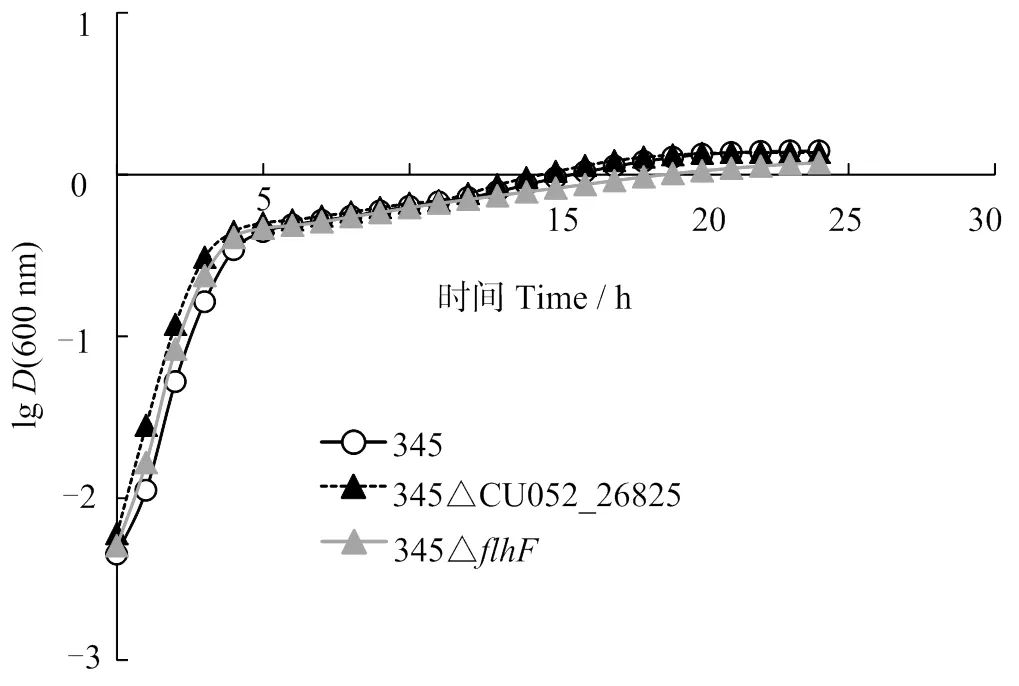
圖3 哈維弧菌345、345ΔflhF和345ΔCU052_26825在LBS培養基中的生長曲線
2.4 哈維弧菌flhF和CU052_26825缺失株的運動性
圖4(a)可見,野生株345在15 g/L瓊脂LBS平板上無涌動性,在3 g/L瓊脂LBS平板上也無游動性,且和缺失株在這兩種平板上也均未表現出涌動性和游動性。3次重復實驗的結果一致。二缺失株運動性相對野生株均無顯著差異(> 0.05,圖4(b)),表明和均不影響哈維弧菌的運動性。

圖4 哈維弧菌345、345ΔflhF和345ΔCU052_26825在15、3 g/L瓊脂LBS平板上的運動性
2.5 flhF和CU052_26825缺失對哈維弧菌胞外蛋白酶活性的影響
和缺失后,在含15 g/L脫脂奶粉LBS平板上,胞外蛋白酶分解圈直徑與野生株幾無差異(圖5(b)),3次重復實驗結果一致。統計分析表明,缺失株胞外蛋白酶活性相對野生株均無顯著差異(> 0.05,圖5(b)),表明和均不影響哈維弧菌胞外蛋白酶活性。
2.6flhF和CU052_26825缺失對哈維弧菌抗H2O2、Cu2+及吸收鐵離子的影響
在LBS平板,添加0.002 mL/L H2O2、0.2 mmol/L CuSO4、120 μmol/L DIP的LBS平板上,隨稀釋倍數增加,突變株和野生株菌落數均減少,稀釋倍數為107時,菌落數明顯變少。相對于野生株,突變株對H2O2、CuSO4抗性,鐵離子的吸收均無顯著差異(圖6)。3次重復結果一致,表明和均不影響哈維弧菌對H2O2、Cu2+的抗性,對鐵離子的吸收。

圖5 哈維弧菌345、345ΔflhF和345ΔCU052_26825在LBS+15 g/L脫脂奶粉平板上的胞外蛋白酶活性
1,345;2,345ΔflhF;3,345ΔCU052_26825
2.7 flhF和CU052_26825對哈維弧菌生物膜形成的影響
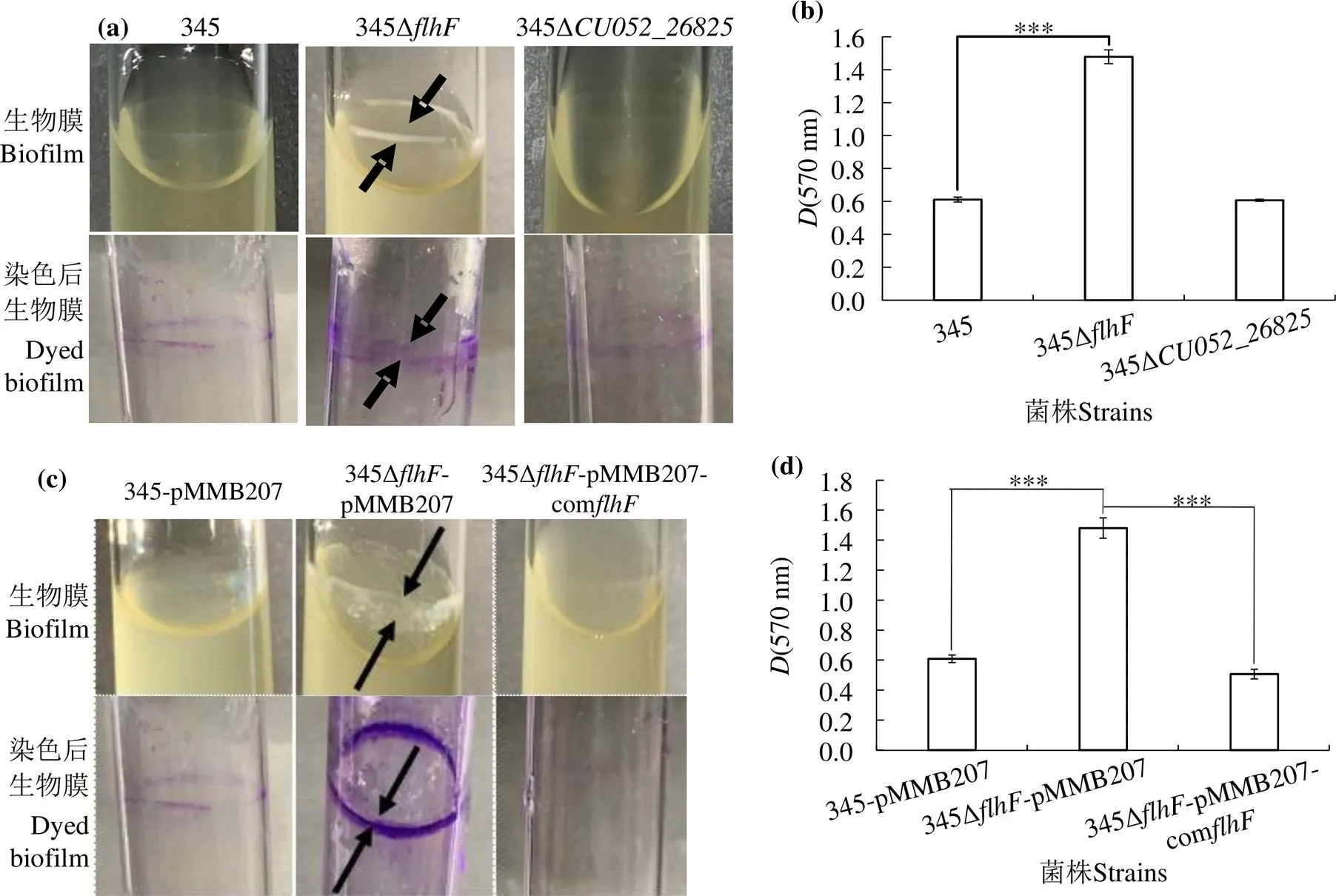
圖7(a)可見,在玻璃試管中靜置培養后,哈維弧菌野生株和突變株在管壁上僅形成極少量生物膜,而突變株在管壁上形成一層厚厚的生物膜,結晶紫染色后,管壁上呈清晰的染色圈。3次重復實驗結果一致。圖7(b)可見,突變株與野生株生物膜形成能力無顯著差異,而突變株相對野生株,生物膜形成能力極顯著增強(< 0.001)。
回補后,與哈維弧菌野生株345-pMMB207和回補株345Δ-pMMB207-com相比,突變株345Δ-pMMB207形成大量生物膜,并出現較明顯的染色圈(圖7(c))。統計分析表明,生物膜形成能力極顯著增強(< 0.001)(圖7(d)),回補株345Δ-pMMB207-com生物膜形成能力與野生株相似,無顯著差異(圖7(c、d)),表明回補株表型與野生株相似。
2.8 flhF和CU052_26825對哈維弧菌抗生素敏感性的影響
哈維弧菌野生株,和突變株均對利福平、多西環素、萬古霉素、復方新諾明和四環素等5種抗生素耐藥,對呋喃唑酮、阿莫西林、氯霉素、環丙沙星和諾氟沙星等5種抗生素敏感。雖然野生株和2個突變株對妥布霉素、慶大霉素、紅霉素和麥迪霉素的抗性不同,但是2個突變株相對野生株的抑菌圈直徑無顯著差異。而2個突變株對氟苯尼考和氯霉素更加敏感,抑菌圈直徑相對野生株菌顯著增大(< 0.05,表2)。
分析發現,野生株345,缺失株345Δ和345Δ對氯霉素MIC分別為0.5、0.125、0.125 μg/mL,對氟苯尼考的MIC分別為16、2、0.5 μg/mL(表3)。
***,差異極顯著the highly significant difference(P < 0.05)
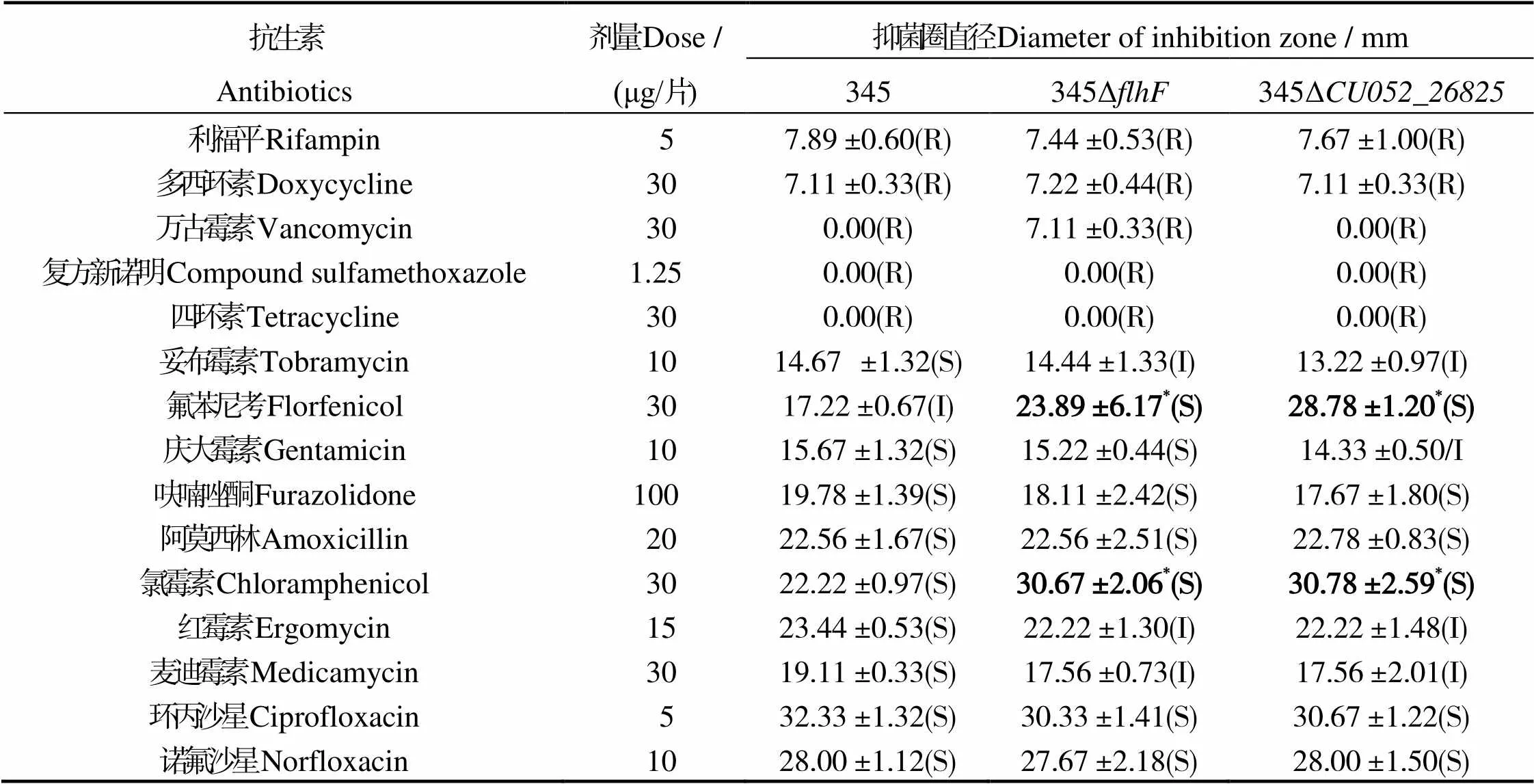
表2 哈維弧菌345、345ΔflhF以及345ΔCU052_26825對各抗生素抗性
說明:R,抗性;S,敏感;I,中介;*,與野生株345差異顯著(< 0.05)。
Notes: R, Resistance; S, Sensitivity; I, Intermediary; *, the significant difference from345 at level of 0.05.
由于回補質粒pMMB207有氯霉素抗性,因此,僅用哈維弧菌菌株345-pMMB207、345Δ-pMMB207、345Δ-pMMB207-com345Δ-pMMB207和345Δ-pMMB207-com分析氟苯尼考耐藥性的回補情況,發現這5株菌對氟苯尼考的最低抑菌濃度(MIC)分別為16、1、8、1、32 μg/mL(表3)。

表3 各菌株的最低抑菌濃度
2.9 flhF和CU052_26825對哈維弧菌毒力的影響
缺失組感染劑量為8 LD50(3.59×105cfu/g),生理鹽水組實驗期間未死魚,其他組在注射12 h后死亡率即達到8%以上,隨著注射時間的延長,死亡率逐漸升高,注射7 d后,345-pMMB207、345Δ-pMMB207和345Δ-pMMB207-com組的累積死亡率分別穩定在58.33%、62.50%、66.67%(圖8(a))。
缺失組感染劑量為10 LD50(4.49×105cfu/g),生理鹽水組實驗期間未出現死魚,其他組在注射12 h后死亡率即達到70%以上,隨著注射時間延長,死亡率逐漸升高,注射4 d后,345-pMMB207、345Δ-pMMB207、345Δ-pMMB207-com組的累積死亡率分別穩定在100.00%、96.67%、100.00%(圖8(b))。

圖8 各菌株的累積死亡率
3 討論
哈維弧菌是近十多年水產養殖業重要致病菌,可感染蝦(如對蝦的發光病)、魚(如鱸、大菱鲆的潰瘍病)和貝(如鮑潰爛病)等[19]。哈維弧菌的致病性與蛋白酶、溶血素、脂肪酶和脂多糖等胞外產物的分泌,以及發光、群體效應、形成生物膜、噬菌體感染、結合鐵的能力以及溫鹽等因素有關[19-20]。如孫鉑光[21]發現,哈維弧菌突變的VHH溶血素在大腸桿菌中重組表達后,突變的VHH溶血素S153G失去溶血活性和對大菱鲆的致病性,說明哈維弧菌的溶血素與致病性有關。郝貴杰等[22]研究大黃魚()致病株哈維弧菌GYC1108-1并證實哈維弧菌胞外蛋白酶為半胱氨酸蛋白酶,攻毒試驗顯示,該蛋白酶對大黃魚有致死作用,若該酶被熱滅活則失去毒性。因此,深入挖掘哈維弧菌潛在毒力調控基因,并研究其毒力調控機制對于哈維弧菌病害防治有重要意義。本研究表明,和基因的缺失均不影響哈維弧菌致病菌株345的生長能力,運動能力,胞外蛋白酶分泌活性,對抗H2O2、Cu2+和限鐵環境脅迫的能力,對大多數被測抗生素的抗性以及對花鱸的毒性,但是和缺失后對氯霉素和氟苯尼考兩種氯霉素類抗生素均更為敏感,缺失后生物膜形成能力顯著增強,表明和均參與正調控哈維弧菌對氯霉素類抗生素的耐藥性,還參與負調控哈維弧菌生物膜形成。這些結果為哈維弧菌基因功能研究奠定基礎。
生物膜是細菌黏附于接觸表面,分泌多糖基質、纖維蛋白、脂質蛋白等,將自身包繞其中而形成的大量細菌聚集膜樣物[23],除有助于細菌黏附宿主細胞外,還調控細菌的耐藥性、幫助細菌逃避宿主的免疫反應等[24]。鞭毛運動與細菌生物膜形成,尤其是生物膜形成早期在接觸面的定位與結合密切相關[25]。如空腸彎曲菌()鞭毛基因的插入突變顯著降低細菌運動性和食物表面形成生物膜的能力[26]。FlhF是一種信號識別粒子型的GTP酶,與弧菌(sp.)、希瓦式菌(sp.)、彎曲桿菌(sp.)、螺桿菌(sp.)和銅綠假單胞菌()鞭毛極性定位相關[27-31]。此外,FlhF還調控細菌的鞭毛數量[27]。López-Sánchez等[32]和Navarrete等[33]發現,惡臭假單胞菌()的轉座插入突變體,在生物膜形成、鞭毛合成和鞭毛運動方面均顯示重大缺陷。空腸彎曲菌()FlhF調節鞭毛合成,其缺失影響細菌定植、黏附侵襲和趨化基因的表達,進而改變細菌對宿主毒力效應[34]。溶藻弧菌()中,FlhF對極性鞭毛數量和細菌涌動群集運動有正調節作用[35]。本研究中,缺失后,哈維弧菌運動性并無顯著變化,但生物膜形成顯著增加。因此,缺失可能并不影響哈維弧菌鞭毛數量,而更多影響哈維弧菌鞭毛的定位,從而影響哈維弧菌對宿主表面的黏附和結合以及生物膜的形成。
抗生素廣泛用于預防或治療水產養殖中的細菌性疾病[3,36]。抗生素的過度使用會導致耐藥菌產生及食品安全問題。解析細菌耐藥機制是保證抗生素正確使用的前提和基礎。本研究中,和缺失后對氯霉素和氟苯尼考這兩種氯霉素類抗生素菌更為敏感,MIC分別是野生株的1/4、1/4和1/8、1/32,表明和均參與氯霉素類耐藥性的調控。
大多數臨床分離株中,細菌對氯霉素的耐藥性由質粒編碼的氯霉素乙酰轉移酶(CAT) 介導。CAT催化了氯霉素C-3位羥基的乙酰化,生成了3-乙酰氯霉素,而3-乙酰氯霉素不能與細菌的核糖體結合,從而缺乏抗菌活性[37]。基因廣泛存在于革蘭陰性菌和大多數革蘭陽性菌,可位于染色體、R質粒,甚至在可轉移因子中[37]。還發現其他與氟苯尼考和/或氯霉素耐藥相關基因。如位于質粒上的非酶抗性基因[38-39]通過主動泵出使菌體內氯霉素含量明顯減少而實現細菌耐藥[40];耐藥基因和均位于質粒上,是氯霉素和甲砜霉素共同的耐藥機制,但與氟苯尼考耐藥性均無直接關系[41];Kim等[42]從魚的巴氏桿菌質粒中發現耐氟苯尼考基因并命名為[37],隨后在沙門氏菌、大腸桿菌等病原菌中克隆到的同源基因[37]。此外,與抗生素泵出相關的基因、多重耐藥基因、外排泵基因轉錄調節因子RamA[43-44]與氯霉素和/或氟苯尼考耐藥相關。除基因位于細菌染色體外,絕大多數已知的氟苯尼考和/或氯霉素耐藥相關基因位于可移動遺傳元件。本研究發現2個位于染色體上的基因[9]——信號識別粒子型的GTP酶編碼基因和未知功能基因,二者均正調控氟苯尼考和氯霉素的耐藥性,且可能通過影響哈維弧菌的鞭毛定位,影響哈維弧菌生物膜的形成。細菌生物膜可調控細菌的耐藥性,通過滲透限制、營養限制和耐藥表型機制導致細菌耐藥[45]。滲透限制表現為生物膜中多聚糖所構成的分子屏障和電荷屏障阻止或延緩某些抗生素滲入[45]。營養限制機制與滲透限制密切相關,由于生物膜滲透限制的存在,營養物質不易通過生物膜,而使生物膜內營養缺乏,內層細菌生長減慢,處于饑餓狀態,導致細菌對抗生素的敏感性降低[46]。耐藥表型機制主要是指細菌耐藥性的形成與某些生物膜表型相關基因表達差異有關[47]。因此,可能通過其中某一機制影響細菌對氟苯尼考和氯霉素的耐藥性。而基因可能存在類似RamA轉錄調節因子的作用,通過調控其他與氟苯尼考和氯霉素耐藥直接相關基因的表達而間接影響細菌的耐藥性。但具體調控機制還需進一步研究。
4 結論
本研究成功構建哈維弧菌和缺失株,與野生株相比,二缺失株生長、運動性、胞外酶活性、抗H2O2和Cu2+壓力、吸收鐵的能力以及致病性無顯著影響,對氯霉素和氟苯尼考兩種氯霉素類抗生素更加敏感,缺失株生物膜形成能力顯著增強,表明和均參與調控哈維弧菌對氯霉素類抗生素的耐藥性,還參與調控哈維弧菌生物膜形成。本研究豐富了哈維弧菌氯霉素類耐藥性的研究,對防止氯霉素類藥物耐藥菌的產生和指導氯霉素類藥物的合理應用有重要意義。
[1] SHEN G M, SHI C Y, FAN C, et al.Isolation, identification and pathogenicity of, the causal agent of skin ulcer disease in juvenile hybrid groupers×[J].Journal of Fish Diseases, 2017, 40(10): 1351-1362.
[2] XU X D, LIU K F, WANG S F, et al.Identification of pathogenicity, investigation of virulent gene distribution and development of a virulent strain-specific detection PCR method forisolated from Hainan Province and Guangdong Province, China[J].Aquaculture, 2017, 468: 226-234.
[3] SANTOS L, RAMOS F.Antimicrobial resistance in aquaculture: Current knowledge and alternatives to tackle the problem[J].International Journal of Antimicrobial Agents, 2018, 52(2): 135-143.
[4] HE Y, JIN L L, SUN F J, et al.Antibiotic and heavy-metal resistance ofisolated from fresh shrimps in Shanghai fish markets, China[J].Environmental Science and Pollution Research, 2016, 23(15): 15033-15040.
[5] DENG Y Q, XU L W, CHEN H X, et al.Prevalence, virulence genes, and antimicrobial resistance ofspecies isolated from diseased marine fish in South China[J].Scientific Reports, 2020, 10: 14329.
[6] SADAT A, EL-SHERBINY H, ZAKARIA A, et al.Prevalence, antibiogram and virulence characterization ofisolates from fish and shellfish in Egypt: a possible zoonotic hazard to humans[J].Journal of Applied Microbiology, 2021, 131(1): 485-498.
[7] MAZZANTINI D, CELANDRONI F, SALVETTI S, et al.FlhF is required for swarming motility and full pathogenicity of[J].Frontiers in Microbiology, 2016, 7: 1644.
[8] KONKEL M E, TILLY K.Temperature-regulated expression of bacterial virulence genes[J].Microbes and Infection, 2000, 2(2): 157-166.
[9] DENG Y Q, XU H D, SU Y L, et al.Horizontal gene transfer contributes to virulence and antibiotic resistance of345 based on complete genome sequence analysis[J].BMC Genomics, 2019, 20(1): 761.
[10] VAL M E, SKOVGAARD O, DUCOS-GALAND M, et al.Genome engineering in: a feasible approach to address biological issues[J].PLoS Genetics, 2012, 8(1): e1002472.
[11] LIU J X, ZHAO Z, DENG Y Q, et al.Complete genome sequence ofLMB 29 isolated from red drum with four native megaplasmids[J].Frontiers in Microbiology, 2017, 8: 2035.
[12] LE ROUX F, BINESSE J, SAULNIER D, et al.Construction of amutant lacking the metalloprotease geneby use of a novel counterselectable suicide vector[J].Applied and Environmental Microbiology, 2007, 73(3): 777-784.
[13] NGUYEN A N, DISCONZI E, CHARRIèRE G M, et al.gene duplication drives the evolution of redundant regulatory pathways controlling expression of the major toxic secreted metalloproteases inLGP32[J].mSphere, 2018, 3(6): e00582-18.DOI:10.1128/msphere.00582-18
[14] ZHANG Y Q, DENG Y Q, FENG J, et al.CqsA inhibits the virulence ofto the pearl Gentian grouper (♀×♂)[J].Aquaculture, 2021, 535: 736346.
[15] 張亞秋, 鄧益琴, 馮娟, 等.哈維弧菌基因缺失株的構建及其相關生物學特性研究[J].南方水產科學, 2020, 16(2): 43-53.
[16] 吳金軍.華南海水魚類網箱養殖區耐藥菌和耐藥基因研究[D].上海: 上海海洋大學, 2019.
[17] CLSI.Performance standards for antimicrobial susceptibility testing[R].CLSI supplement M100.Clinical and Laboratory Standards Institute, 2019.
[18] 張亞秋.哈維弧菌假定毒力基因的篩選及功能研究[D].上海: 上海海洋大學, 2020.
[19] 李洋, 李強, 張顯昱.哈維弧菌及其主要致病因子的研究進展[J].中國農業科技導報, 2014, 16(4): 159-166.
[20] 貝蕾, 蘇友祿, 趙超, 等.哈維弧菌基因的克隆與表達[J].南方水產科學, 2018, 14(2): 75-82.
[21] 孫鉑光.哈維氏弧菌VHH溶血素作用機理的研究[D].青島: 中國海洋大學, 2009.
[22] 郝貴杰, 沈錦玉, 潘曉藝, 等.哈維氏弧菌GYC1108-1胞外蛋白酶的制備及免疫原性研究[J].漁業科學進展, 2010, 31(3): 107-112.
[23] GU H, REN D C.Materials and surface engineering to control bacterial adhesion and biofilm formation: a review of recent advances[J].Frontiers of Chemical Science and Engineering, 2014, 8(1): 20-33.
[24] MAH T F C, O’TOOLE G A.Mechanisms of biofilm resistance to antimicrobial agents[J].Trends in Microbiology, 2001, 9(1): 34-39.
[25] GUTTENPLAN S B, KEARNS D B.Regulation of flagellar motility during biofilm formation[J].FEMS Microbiology Reviews, 2013, 37(6): 849-871.
[26] KIM J S, PARK C, KIM Y J.Role of flgA for flagellar biosynthesis and biofilm formation ofNCTC11168[J].Journal of Microbiology and Biotechnology, 2015, 25(11): 1871-1879.
[27] CORREA N E, PENG F, KLOSE K E.Roles of the regulatory proteins FlhF and FlhG in theflagellar transcription hierarchy[J].Journal of Bacteriology, 2005, 187(18): 6324-6332.
[28] MURRAY T S, KAZMIERCZAK B I.FlhF is required for swimming and swarming in[J].Journal of Bacteriology, 2006, 188(19): 6995-7004.
[29] GREEN J C D, KAHRAMANOGLOU C, RAHMAN A, et al.Recruitment of the earliest component of the bacterial flagellum to the old cell division pole by a membrane-associated signal recognition particle family GTP-binding protein[J].Journal of Molecular Biology, 2009, 391(4): 679-690.
[30] GAO T, SHI M M, JU L L, et al.Investigation into FlhFG reveals distinct features of FlhF in regulating flagellum polarity in[J].Molecular Microbiology, 2015, 98(3): 571-585.
[31] BALABAN M, JOSLIN S N, HENDRIXSON D R.FlhF and its GTPase activity are required for distinct processes in flagellar gene regulation and biosynthesis in[J].Journal of Bacteriology, 2009, 191(21): 6602-6611.
[42] LóPEZ-SáNCHEZ A, LEAL-MORALES A, JIMéNEZ-DíAZ L, et al.Biofilm formation-defective mutants in[J].FEMS Microbiology Letters, 2016, 363(13): fnw127.
[33] NAVARRETE B, LEAL-MORALES A, SERRANO-RON L, et al.Transcriptional organization, regulation and functional analysis of flhF and fleN in[J].PLoS One, 2019, 14(3): e0214166.DOI:10.1371/journal.pone.0214166
[34] 任方哲.空腸彎曲菌FlhF調節鞭毛合成分子機制及其對細菌毒力的影響分析[D].揚州: 揚州大學, 2019.
[35] KUSUMOTO A, KAMISAKA K, YAKUSHI T, et al.Regulation of polar flagellar number by the flhF and flhG genes in[J].Journal of Biochemistry, 2006, 139(1): 113-121.
[36] MO W Y, CHEN Z T, LEUNG H M, et al.Application of veterinary antibiotics in China’s aquaculture industry and their potential human health risks[J].Environmental Science and Pollution Research, 2017, 24(10): 8978-8989.
[37] 杜向黨, 閻若潛, 沈建忠.氯霉素類藥物耐藥機制的研究進展[J].動物醫學進展, 2004, 25(2): 27-29.
[38] DORMAN C J, FOSTER T J, SHAW W V.Nucleotide sequence of the R26 chloramphenicol resistance determinant and identification of its gene product[J].Gene, 1986, 41(2/3): 349-353.
[39] BISSONNETTE L, CHAMPETIER S, BUISSON J P, et al.Characterization of the nonenzymatic chloramphenicol resistance () gene of the In4 integron of Tn1696: similarity of the product to transmembrane transport proteins[J].Journal of Bacteriology, 1991, 173(14): 4493-4502.
[40] GEORGE A M, HALL R M.Efflux of chloramphenicol by the CmlA1 protein[J].FEMS Microbiology Letters, 2002, 209(2): 209-213.
[41] SAMS R A.Florfenicol: Chemistry and metabolism of a novel broad-spectrum antibiotic[J].Tieraerztliche Umschau, 1995, 50(10): 703-707.
[42] KIM E, AOKI T.Sequence analysis of the florfenicol resistance gene encoded in the transferable R-plasmid of a fish pathogen,[J].Microbiology and Immunology, 1996, 40(9): 665-669.
[43] KEHRENBERG C, SCHWARZ S.fexA, a novelgene encoding resistance to florfenicol and chloramphenicol[J].Antimicrobial Agents and Chemotherapy, 2004, 48(2): 615-618.
[44] DAI L, WU C M, WANG M G, et al.First report of the multidrug resistance gene cfr and the phenicol resistance genein astrain from swine feces[J].Antimicrobial Agents and Chemotherapy, 2010, 54(9): 3953-3955.
[45] DAVIES D.Understanding biofilm resistance to antibacterial agents[J].Nature Reviews Drug Discovery, 2003, 2(2): 114-122.
[46] WALTERS M C III, ROE F, BUGNICOURT A, et al.Contributions of antibiotic penetration, oxygen limitation, and low metabolic activity to tolerance ofbiofilms to ciprofloxacin and tobramycin[J].Antimicrobial Agents and Chemotherapy, 2003, 47(1): 317-323.
[47] MIKKELSEN H, BALL G, GIRAUD C, et al.Expression ofCupD fimbrial genes is antagonistically controlled by RcsB and the EAL-containing PvrR response regulators[J].PLoS One, 2009, 4(6): e6018.DOI:10.1371/journal.pone.0006018.
Deletion Mutant Construction and Biological Characteristics of Geneandin
DENG Yi-qin1, ZHANG Ya-qiu1,3, LIN Zi-yang1,4, FENG Juan1, CHENG Chang-chang1, MA Hong-ling1, LIU Guang-xin1, SU You-lu2
(1,,,510300,; 2.,,,510225,; 3,201306,; 4.,570228,)
【Objective】 To study the effect of gene deletion of GTP binding protein geneand an unknowngeneon the biological functions of345【Method】Deletion mutant ofandof345 were constructed by homologous recombination technology.The biological characteristics including growth, motility, extracellular protease activity, and drug resistance and toxicity towere compared to the wild type strain【Result】 Neither the deletion ofnoraffected the bacterial growth, motility, extracellular protease activity, pressure sensing to H2O2and Cu2+, absorption and utilization of iron, resistance to most tested antibiotics and toxicity to.However, the deletion mutant ofandwere more sensitive to chloramphenicol and florfenicol.In addition, the ability of bacterial biofilm formation was significantly enhanced with the deletion of.【Conclusion】Theandare involved in regulating the resistance ofto chloramphenicol antibiotics, andis also involved in regulating the biofilm formation of.
;gene knockout;;; biological characteristics; chloramphenicol resistance
S94;Q933
A
1673-9159(2022)02-0001-12
10.3969/j.issn.1673-9159.2022.02.001
2021-10-07
國家自然科學基金(31902415);中國水產科學研究院中央級公益性科研院所基本科研業務費專項資金資助(2022GH03);國家重點研發計劃資助(2019YFD0900105);廣東省自然科學基金(2019A1515011833);中國水產科學研究院基本科研業務費專項資金(2020XT0407);中國水產科學研究院南海水產研究所中央級公益性科研院所基本科研業務費專項資金資助(2020TS04)
鄧益琴(1990―),女,博士,副研究員,從事魚類細菌病及防治技術研究。E-mail: yiqindd@126.com
鄧益琴,張亞秋,林梓陽,等.哈維弧菌和缺失株的構建及其生物學特性[J].廣東海洋大學學報,2022,42(2):1-12.
(責任編輯:劉慶穎)

