咖啡酸對阿霉素心肌細胞損傷的保護作用及機制研究
唐 煒,葉鵬林,劉 坤,朱楊杰,高惡斌
阿霉素(adriamycin,ADM)是一種蒽環類抗生素,抗癌效果顯著,是目前最常用最重要的抗癌藥物之一[1]。然而,長期給藥會對心臟、骨髓、腎臟造成不可逆毒性作用,嚴重阻礙其臨床應用[2]。ADM可在體內形成多種氧自由基,導致心肌細胞及亞細胞結構改變,破壞細胞膜引起鈣超載,進而引起心肌細胞凋亡。因此,深入探討ADM誘導心肌毒性的內在機制,并探究有效的心肌保護劑,對解決ADM誘導致毒問題十分必要。咖啡酸(caffeic acid,CA)是酚酸類化合物,廣泛存在于植物體內,具有抗炎、抗菌、抗病毒等藥理作用。最近有研究[3]表明,CA對心血管疾病如動脈粥樣硬化等具有保護作用。但其對ADM心肌損傷的保護作用及具體機制尚不清楚。因此,該研究通過建立ADM誘導大鼠心肌細胞損傷模型,探討CA對心肌損傷的保護作用及相關機制。
1 材料與方法
1.1 材料
1.1.1細胞與培養 實驗細胞為大鼠H9c2細胞系,江蘇大學生命科學學院中心實驗室保存。在含有10%胎牛血清(FBS)的DMEM培養基培養,置于37 ℃含5% CO2恒溫培養箱中常規傳代培養。
1.1.2藥品與試劑 CA(純度≥99%)購自美國Acros Organics公司,MTT細胞增殖及細胞毒性試劑盒購自上海碧云天生物科技有限公司,ADM、乳酸脫氫酶(lactate dehydrogenase, LDH)活性檢測試劑盒和活性氧(reactive oxygen species, ROS)檢測試劑盒購自北京索萊寶科技有限公司,JC-1線粒體膜電位檢測試劑盒購自上海翊圣生物科技有限公司,線粒體Na+-K+-ATP酶和Ca2+-ATP酶活性試劑盒購自南京建成生物科技有限公司,NF-κB和β-actin抗體購自英國Abcam公司。
1.2 方法
1.2.1細胞培養與處理 用DMEM+10%FBS培養基培養H92c心肌細胞,細胞密度至80%左右時吸取多余培養基,用PBS沖洗2次,0.25%胰酶消化3 min后加入培養基中和,輕輕吹打至細胞脫落,按照1 ∶3傳代數次至細胞狀態穩定。
取對數生長期H92c心肌細胞,按每孔5×103個細胞接種于96孔板中,每組平行設置5個復孔,待細胞貼壁后,分別加入相關藥物干預。首先進行ADM濃度的篩選。H9c2心肌細胞分別加入0(對照組)、1.0、2.0、3.0、4.0 μmol/L ADM(使DMSO 最終濃度<0.1%)作用12 h,選擇接近其半抑制濃度(half maximal inhibitory concentration,IC50)值的濃度進行后續研究。其次進行給藥模型的建立。在最適ADM濃度處理心肌細胞后,分別用0.5、1.0、2.0、4.0、8.0 μmol/L CA處理24 h,置于37 ℃、5% CO2環境中培養。設置ADM處理組為模型組(ADM組)、不同濃度CA干預組為治療組(ADM+CA組)及空白對照組(Control組)。
在處理后,每孔加入終濃度為5 mg/ml的MTT 10 μl,培養4 h后添加100 μl DMSO溶液,在450 nm處測定吸光值,每組重復3次,計算細胞存活率和IC50。
1.2.2細胞內LDH水平檢測 收集Control組、ADM組和ADM+CA組培養24 h后的H9c2細胞,按照LDH活性檢測試劑盒說明書測定上清LDH含量,并根據相關公式計算LDH活力變化。
1.2.3細胞內ROS水平檢測 分組同上所述,收集各組細胞,加入10 μmol/L DCF-DA,孵育20 min后用熒光顯微鏡觀察ROS熒光強度。熒光強度的高低反映細胞內ROS的水平。
1.2.4線粒體膜電位檢測 分組同上所述,在各組樣本中加入JC-1使其達到所需終濃度,避光,37 ℃孵育15 min,再用PBS洗去多余的染料后測定。
1.2.5線粒體Na+-K+-ATP酶、Ca2+-ATP酶活性檢測 分組同上所述,收集各組細胞后用PBS懸浮細胞并破碎,離心取上清液,測定吸光度。操作步驟嚴格按照線粒體Na+-K+-ATP酶、Ca2+-ATP酶活性檢測試劑盒進行。
1.2.6Western blot法檢測NF-κB蛋白表達情況 分組同上所述,提取各組細胞總蛋白。取50 μg蛋白樣本進行Western blot檢測,以β-actin為內參,用Multi-analyst image成像系統檢測蛋白條帶,并用Image J軟件定量。
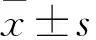
2 結果
2.1 ADM誘導H9c2心肌損傷模型的建立與Control組比較,1.0、2.0、3.0和4.0 μmol/L ADM處理都會引起H9c2心肌細胞存活率的顯著下降,并且隨處理劑量增加細胞活力顯著降低,具有劑量依賴效應。其中1.0 、2.0 μmol/L ADM處理與Control組比較差異有統計學意義(P<0.05),3.0、4.0 μmol/L ADM處理與Control組比較差異更顯著(P<0.01)。ADM對心肌細胞的損傷與濃度呈正相關,當ADM濃度為2.0 μmol/L時對細胞的損傷量約在50%,為藥物IC50,因此選擇2.0 μmol/L ADM處理作為后續實驗條件。見圖1。

圖1 不同濃度ADM處理細胞后的MTT細胞活力統計圖
2.2 CA對大鼠心肌組織損傷的保護作用不同濃度的CA對ADM誘導的心肌細胞損傷有一定保護作用,0.5 μmol/L CA即對ADM誘導的心肌損傷呈現保護效應(P<0.05),并且心肌細胞的存活率隨CA濃度增加顯著提高,具有劑量依賴性。當CA濃度為4.0 μmol/L時對H9c2保護效果最佳。因此,取2.0 μmol/L ADM和4.0 μmol/L CA作為治療組進行后續實驗。見圖2。

圖2 不同濃度CA保護損傷細胞后的MTT細胞活力統計圖
HE染色結果顯示,Control組心肌細胞排列整齊致密、細胞形態正常。與Control組比較,ADM組心肌呈片狀壞死、空泡性變性、心肌纖維增多、心肌細胞片狀溶解,心肌松散,細胞間隙增寬。而,ADM+CA組中心肌纖維化、變性等較輕,肌纖維變性減少。見圖3。

圖3 CA對H9c2心肌細胞形態的影響
2.3 CA對ADM損傷的心肌細胞內LDH水平的影響與Control組比較,ADM組中的LDH水平顯著提高;而加入CA后治療組中LDH水平明顯降低,表明CA可以抑制細胞內LDH在損傷后的顯著提高。見圖4。

圖4 各組心肌細胞上清的LDH活力水平統計圖
2.4 CA對ADM損傷的心肌細胞內活性氧水平的影響在熒光顯微鏡下觀察各組細胞內熒光強度,通過熒光強度的強弱反映ROS水平的高低。Control組內平均熒光強度為(63.110±2.223),而ADM組中的平均熒光強度為(132.098±7.117),與Con-trol組比較明顯升高。而ADM+CA組細胞內平均熒光強度為(103.582±4.992),較ADM組顯著下降;利用單因子方差分析結果顯示,各組間均差異有統計學意義(P<0.000 1,F=223.9)。結果表明,CA可以抑制ADM誘導心肌細胞中ROS激增過程。見圖5。

圖5 激光共聚焦顯微鏡下各組心肌細胞ROS水平 ×400
2.5 CA對ADM損傷的心肌細胞內線粒體膜電位的影響同樣利用熒光強弱反映線粒體膜電位的水平。與Control組比較,ADM組細胞內紅色熒光強度明顯下降,由(207.876±5.072)降為(90.918±4.649);而ADM+CA組中紅色熒光強度為(105.200±3.501)。one-way ANOVA統計分析結果顯示,各組間均差異有統計學意義(P<0.01,F=1 025)。結果表明,ADM能夠引發心肌細胞線粒體膜電位下降,而加入CA則可以改善該過程。見圖6。

圖6 熒光顯微鏡下各組細胞線粒體膜電位水平 ×200
2.6 CA對ADM損傷的心肌細胞內線粒體Na+-K+-ATP酶、Ca2+-ATP酶活性的影響與Control組比較,ADM組心肌細胞H9c2中線粒體Na+-K+-ATP酶、Ca2+-ATP酶的活性均呈現顯著降低(P<0.05);而與ADM組比較,ADM+CA組線粒體Na+-K+-ATP酶、Ca2+-ATP酶的活性則有了明顯升高(P<0.05)。表明ADM造成了心肌細胞中線粒體Na+-K+-ATP酶和Ca2+-ATP酶活性的降低,而加入CA則能改善這種損傷。見圖7。

圖7 各組心肌細胞內Na+-K+-ATP酶和Ca2+-ATP酶活性水平
2.7 CA對ADM損傷的心肌細胞內NF-κB信號通路影響Western blot結果顯示,與Control組比較,ADM組p65蛋白的表達水平明顯增高,而加入CA的治療組中,p65蛋白的表達量則有所降低。見圖8。

圖8 Western blot檢測各組心肌細胞中NF-κB p65蛋白表達量
3 討論
ADM是一種高效的蒽醌類抗腫瘤藥物,可以通過抑制腫瘤細胞DNA復制過程起到抗腫瘤作用。然而長期使用ADM會造成心肌細胞不可逆損傷[4],這嚴重限制了ADM抗腫瘤的臨床應用。目前,ADM導致心臟毒性的機制尚不明確[5],因此探尋ADM對心肌細胞的損傷機制,并開發相應的保護藥物具有重要的臨床意義。
研究表明[6],ADM會誘發心肌細胞產生大量的ROS,從而導致心肌細胞處于氧化應激狀態,本研究中,ADM誘導的損傷ADM組中ROS水平高于Control組,與前人研究結果吻合[7]。此外,心肌細胞含有較多的線粒體,線粒體內膜含有大量的Na+-K+-ATP酶和Ca2+-ATP酶,以維持電位穩定,釋放細胞正常生命活動所需要的能量。有報道稱ADM對線粒體膜具有很強的親和性,可能是通過還原性輔酶Ⅱ或內皮型一氧化氮合酶轉化為半醌ADM,并進一步轉化為C7自由基,破壞細胞膜或細胞器膜,從而導致心肌細胞的損傷[8-9]。本研究結果顯示,ADM會引起心肌細胞氧化應激水平增高、心肌細胞線粒體膜電位和線粒體Na+-K+-ATP酶、Ca2+-ATP酶活性降低,表明ADM是通過改變膜電位、影響線粒體膜的穩定性損傷心肌細胞。
NF-κB作為一種核轉錄因子,與免疫和炎癥相關。當機體受到損傷及ROS增多時,細胞內的NF-κB進入細胞核,與特異性位點結合,調控靶基因表達。NF-κB參與了ADM誘導心肌損傷的過程,能引起NF-κB p65蛋白表達增多[10-11]。因此NF-κB p65很有可能是ADM造成心肌損傷通路中的重要環節。本研究中檢測了ADM組、Control組與ADM+CA組細胞中NF-κB p65的表達量,結果表明CA能夠抑制ADM引發的NF-κB p65蛋白表達量增高過程,CA可能通過NF-κB p65通路發揮對心肌細胞的保護作用。然而本研究缺少對NF-κB 通路中其他蛋白表達水平的檢測,尚未進一步深入闡明CA在NF-κB通路中的保護機制。
CA是一類天然酚類化合物,具有強抗氧化性。CA有多種藥理作用,如抗菌、抗毒、抗炎、抗癌、抗動脈粥樣硬化、抗HIV、抗氧化等[3]。研究[12-13]表明,CA對淋巴細胞、腦、腎、肝等組織的氧化損傷也有一定的保護作用。本研究中,CA治療組中心肌細胞中ROS水平較ADM組顯著降低,表明CA可能通過清除H9c2心肌細胞內ROS發揮了保護作用。此外,本研究顯示,CA可以提高ADM誘導心肌損傷后線粒體Na+-K+-ATP酶和Ca2+-ATP酶的活性,能夠穩定線粒體膜電位,這表明除清除ROS之外,CA還有可能通過保護線粒體膜穩定性發揮其保護作用。這與CA能降低心肌細胞線粒體脂質的濃度,保護線粒體,在異丙腎上腺素誘導心肌細胞梗死模型中發揮保護作用的機制相似[14]。

