羅非魚性別控制遺傳育種研究進展
江東能,焦開智,張峻銘,彭友幸,楊空松,鄭德鋒,郭向召,石紅娟,李廣麗
羅非魚性別控制遺傳育種研究進展
江東能1,焦開智1,張峻銘1,彭友幸1,楊空松2,鄭德鋒2,郭向召2,石紅娟1,李廣麗1
(1.廣東海洋大學水產學院 / 廣東省名特優魚類生殖調控與繁育工程技術研究中心,廣東 湛江 524088;2.廣東海大集團股份有限公司畜牧水產研究中心,廣東 廣州 511400)
羅非魚全雄養殖可有效控制繁殖、提高養殖效率,遺傳全雄羅非魚(Genetically male tilapia, GMT)技術是性別控制的高效手段,但GMT技術培育的魚苗雄性率不穩定。基因組學和基因編輯等技術已廣泛應用于羅非魚研究,極大地促進了羅非魚性別決定與分化基礎理論研究。分析導致XY個體性別逆轉的可能因素,提出將來GMT技術研究的關鍵問題,探討現代基因編輯技術在羅非魚性別控制育種中可能應用。
遺傳全雄羅非魚;性別控制;性別決定;基因編輯
1 羅非魚性別控制技術發展概況
羅非魚主要有羅非魚屬()、口孵非鯽屬()和帚齒非鯽屬(),有生長快、抗逆性強、肌間刺少、易于繁殖等優點,是世界上最重要暖水性養殖魚類[1-2]。我國是羅非魚最大生產、出口國[3]。目前世界主要養殖羅非魚為尼羅羅非魚(),莫桑比克羅非魚()、紅羅非魚(spp.)、尼羅羅非魚×奧利亞羅非魚()雜交后代也占一定養殖比例[4]。口孵非鯽屬魚類雌魚有口腔孵化魚卵和保護仔魚習性,影響產卵雌魚生長,導致收獲期個體規格不齊,養殖效益低。羅非魚雄魚比雌魚生長快,全雄或高雄性率養殖還可克服雌雄混養的過度繁殖問題。因此,全雄或高雄性率苗種養殖是羅非魚產業需求[5]。目前,主要通過魚苗飼料中添加雄激素(主要為17-甲基睪酮)誘導培育全雄魚苗,該法操作簡單,雄性率可達98%[5-6]。但在歐盟成員國和美國,養殖魚類投喂激素不合法[7]。投喂激素有潛在的環境威脅,可能存在水體污染和食品安全等公共健康隱患。因此,亟需建立環境友好型羅非魚性別控制方法。尼羅羅非魚有XY性別決定系統,奧利亞羅非魚有ZW性別決定系統。ZZ奧利亞羅非魚雄魚和XX尼羅羅非魚雜交可產生全雄/高雄后代,雜種后代有雜交優勢。但該法對親本純度要求高,親本不純會導致后代雄性率高低不一[8]。通過雌激素誘導XY個體性別逆轉,再與正常XY雄魚交配,獲得YY超雄魚與正常XX雌魚交配可獲得全雄子代。用YY超雄魚培育全雄后代的技術,國內最早稱作三系配套途徑產生遺傳全雄羅非魚技術,國外稱遺傳全雄羅非魚技術(Genetically male tilapia, GMT)[5,9]。傳統GMT技術需要通過測交篩選XY偽雌魚和YY超雄魚,費時費力。通過開發性別連鎖的DNA分子標記,將GMT技術與分子標記輔助選育(Marker assistance selection, MAS)結合,可快速建立GMT技術,稱作分子標記輔助選育-遺傳全雄羅非魚技術(MAS-GMT)[10]。目前,GMT技術尚未大規模推廣應用,主要由于羅非魚性別決定系統復雜,且影響羅非魚性別的遺傳因素較多。筆者綜述GMT技術最新進展和存在問題,提出解決GMT技術瓶頸的研究方向,展望基因編輯技術在羅非魚性別控制育種應用可行性,為羅非魚性別控制育種提供參考。
2 主要養殖羅非魚性別決定類型
早期主要通過種間雜交、雌核發育、激素誘導性別逆轉和細胞核型分析等方式確定羅非魚性別決定類型[11-13]。隨著DNA分子標記技術的發展,主要通過性別連鎖分子標記確定魚類性別決定類型,包括尼羅羅非魚[14-15]。目前,尼羅羅非魚有一雄性性別決定基因——XY性別決定系統。僅較少的尼羅羅非群體性染色體位于LG1[16-19],而大部分尼羅羅非魚群體性染色體位于LG23[10,20-28],可能是群體差異導致(表1)。羅非魚性別除受主效遺傳因子決定外,也受溫度[29-30]等環境因素影響。4日齡尼羅羅非魚幼苗在水溫25℃升至35℃條件下養殖1周,雄性率從52.5%升至75.9%[31]。這種影響還與遺傳相關,通過選育,部分家系高溫處理后雄性率可提高到80%以上[32]。學界嘗試定位尼羅羅非魚溫度敏感的數量性狀位點(QTL),但尚未成功[33]。與尼羅羅非魚相比,奧利亞羅非魚、莫桑比克羅非魚和紅羅非魚性別決定類型研究相對較少,但有開發性別連鎖標記的報道,還有在雜交羅非魚開發性別連鎖分子標記的報道[34-41]。奧利亞羅非魚雄性性別決定位點位于LG1,莫桑比克羅非魚雄性性別決定位點位于LG1或LG14,其雌性決定位點位于LG3;紅羅非魚雄性位點位于LG22(曾稱LG23)[40](表1)。譚德階[41]基于奧利亞羅非魚和尼羅羅非魚基因組序列差異,開發了大量LG1的SCAR標記,證明奧利亞雄魚和尼羅羅非魚雌魚雜交后代雄性性別與LG1連鎖,這些標記同樣適用于臺灣紅羅非魚雄魚和尼羅羅非魚雌魚的雜交后代,表明不同羅非魚LG1的雄性性別決定位點可能相同[41]。
口孵非鯽屬幾種魚可種間雜交,且雜交后代可育,通過雜交實驗可判斷不同性染色體性別控制能力強弱。有ZW性別決定系統的奧利亞羅非魚和有XY性別決定系統的尼羅羅非魚的雜交F1性別顯示,幾條性染色體性別控制能力強弱順序為:Y >W >Z > X[42]。日本品系尼羅羅非魚與奧利亞羅非魚雜交結果顯示,尼羅羅非魚LG23 Y染色體的雄性位點上位于奧利亞羅非魚LG3 W染色體雌性位點[42]。而有研究發現,奧利亞羅非魚W染色體的雌性位點上位于尼羅羅非魚Y染色體雄性位點,推測這樣的尼羅羅非魚性染色體可能為LG1 Y。研究已表明,尼羅羅非魚LG1 Y的性別控制能力弱于LG23 Y[42]。奧利亞羅非魚ZZ雄魚與尼羅羅非魚XX雜交F1,表示為“ZX”雄魚,它與尼羅羅非魚XX個體回交,能產生約1∶1的性比后代,且雄性性別與LG1連鎖,證明奧利亞羅非魚雄性性別決定位點位于LG1[41]。譚德階[41]通過雜交和性別連鎖的分子標記分析,總結出尼羅羅非魚和奧利亞羅非魚性染色體的性別控制能力強弱順序為:LG23 Y > LG3 W > LG1 Z > LG23 X。但如果奧利亞羅非魚的雄性位點位于LG1,而不是LG3,那么用“ZX”表示奧利亞羅非魚和尼羅羅非魚雜交后代值得商榷,“LG1 Z>LG23 X”的表述也不夠準確,因為通常“Z”代表LG3 Z染色體,而“ZX”雜交為雄性的原因卻是LG1雄性位點的作用,用“Z”表示該雄性位點不合理。筆者建議奧利亞羅非魚LG1雄性位點暫用LG1M(M表示雄性性別決定位點)表示,而尼羅羅非魚相應等位基因表示為LG1m(m表示非雄性性別決定位點)。奧利亞羅非魚雄性位點為純合LG1MM,雄魚為LG1MMZZ,雌魚為LG1MMZW,LG1M下位于LG3 W,“ZX”雜交羅非魚基因型為LG1Mm。兩種羅非魚染色體性別控制能力強弱順序可表示為,LG23 Y >LG3 W > LG1M> LG1m或LG23 X。
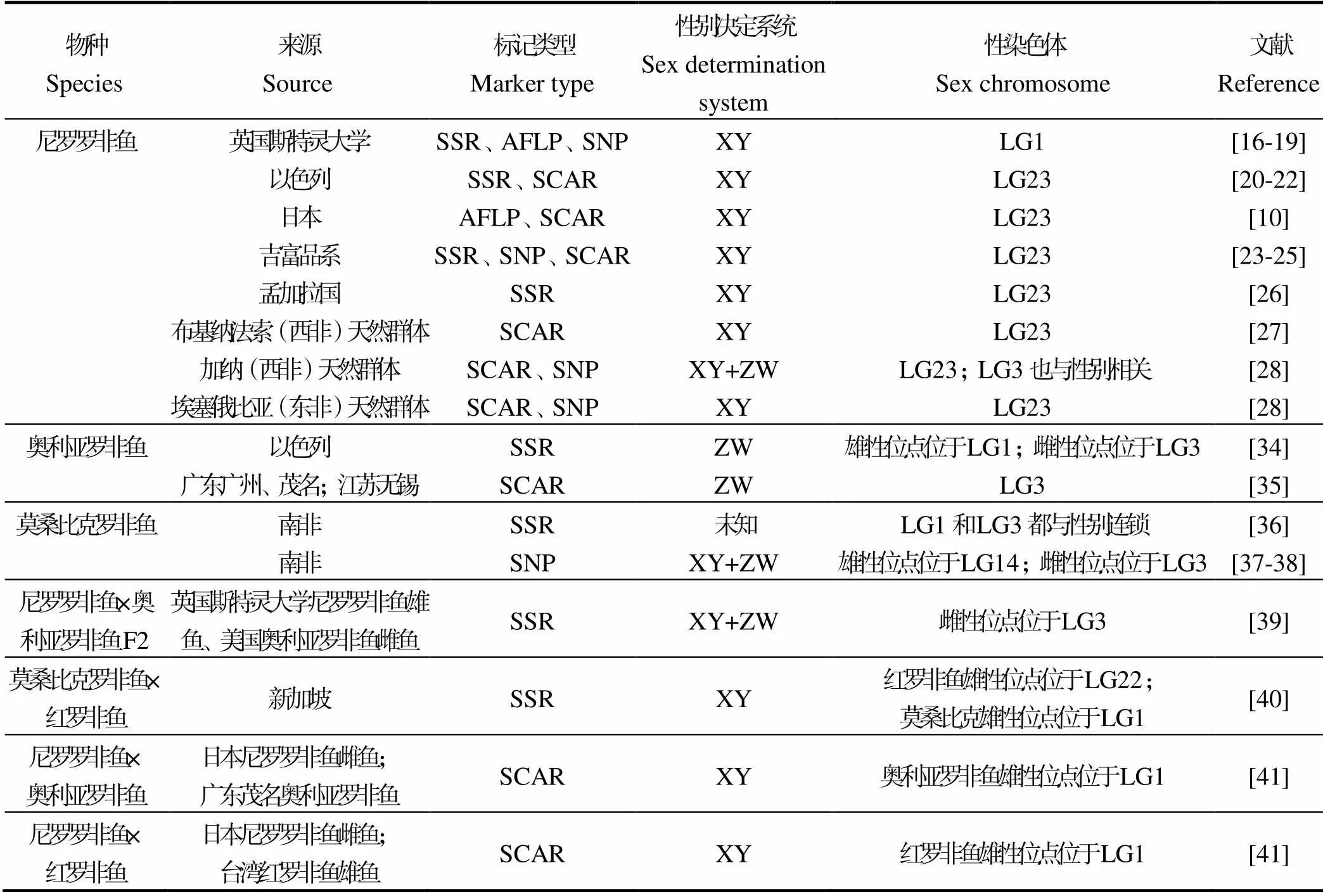
表1 不同羅非魚性別連鎖分子標記
性別連鎖分子標記是建立MAS-GMT技術的重要基礎,也是定位性別決定基因的基礎。性別決定基因與性別緊密連鎖,多種羅非魚LG1存在一雄性性別決定基因,但目前該基因仍未被克隆。定位分析顯示,不同羅非魚LG1上面的性別決定區域存在重疊,尼羅羅非魚、莫桑比克羅非魚和紅羅非魚LG1 Y染色體性別決定基因和奧利亞羅非魚LG1M可能是相同或相似基因。不同物種LG1雄性性別決定基因間的異同尚待解析。學界首先在日本品系尼羅羅非魚圖位克隆了LG23上的性別決定基因(anti-Müllerian hormone gene on the Y chromosome)。是常染色體基因串接復制而成,Y染色體座位存在兩個截短的△和正常的。進一步研究發現,XY個體單獨敲除△不導致性別逆轉,單獨敲除或同時敲除和△導致性別逆轉;另一方面,胚胎轉基因注射含有的Fosmid質粒或巨細胞病毒(Cytomegalovirus,CMV)啟動子驅動過表達的質粒均可導致XX個體性別逆轉,從獲得功能和失去功能兩方面均表明是尼羅羅非魚的性別決定基因[43]。Li等[43]發現,的一個錯義SNP(C/T)導致編碼的絲氨酸突變為亮氨酸,推測該SNP可能與的雄性性別決定功能有關[43]。跟蹤研究表明,串接復制的廣泛存在于尼羅羅非魚的養殖品系和天然群體,且在這些群體都與雄性性別連鎖[27-28,44]。某些尼羅羅非魚群體雖與雄性性別連鎖,但上述錯義SNP (C/T) 并不存在,表明該SNP不是成為雄性性別決定基因的根本原因[44]。最近發現,Amhy可通過下游Amhr2/Smad信號通路抑制雌激素合成關鍵酶芳香化酶編碼基因的表達雌激素合成受阻,導致性腺向精巢分化[45]。比較基因組發現,尼羅羅非魚LG23性別決定基因起始于基因,終止于基因,基因在二者之間,復制區域橫跨21 kb[28]。尼羅羅非魚、奧利亞羅非魚和莫桑比克羅非魚LG3是其最長染色體,分子標記顯示,奧利亞羅非魚、莫桑比克羅非魚的雌性性別決定區間均位于LG3,基因組測序組裝分析發現,LG3富含重復序列,大大增加了鑒定W染色體性別決定基因的難度[46-47]。在奧利亞羅非魚LG3 W染色體性別決定區間發現,和基因與雌性性別緊密連鎖,和均存在W特異拷貝,基因在ZW個體卵巢表達水平顯著高于ZZ個體精巢,可能是其W染色體性別決定候選基因,但目前還缺乏功能研究證據[47]。最近研究[48]表明,附近的與奧利亞羅非魚、和性別連鎖,在5日齡奧利亞羅非魚ZW個體性腺表達,而在ZZ個體性腺不表達,是這幾種魚類W染色體性別決定候選基因[48]。魚類是脊椎動物最大類群,魚類性別決定系統較哺乳類、鳥類復雜多變,性染色體常轉換,羅非魚類是研究性染色體進化的理想類群;因此,羅非魚性別決定類型和機制研究,既是水產養殖性別控制的理論基礎,也是基礎生物學關注的熱點問題[49-50]。
3 羅非魚遺傳性別控制現狀及問題
3.1 羅非魚遺傳性別控制現狀
早期GMT技術依賴傳統測交鑒定基因型,測交工作繁瑣,費時費力,難以獲得足夠數量的YY超雄魚親本,除非獲得YY雌魚,并與YY雄魚交配,如YY雌魚能正常繁殖,可建立YY維持系,大量繁殖YY親本;但前期大量測交工作仍不可避免。在開發性別特異分子標記的基礎上,人們建立了MAS-GMT技術,通過廣泛實踐,可大大降低GMT工作量,且可在3代后培育出全雄后代[10],縮短了育種年限。目前,LG1上雄性性別決定基因尚未克隆,其連鎖分子標記不適用于所有群體建立MAS-GMT技術,限制了其應用。再者,尼羅羅非魚LG1雄性位點的性別控制能力可能弱于奧利亞羅非魚LG3雌性位點W,如尼羅羅非魚群體漸滲了奧利亞羅非魚的基因,則不能保證LG1 Y有效控制子代性別。MAS-GMT主要利用LG23上的雄性性別決定基因進行羅非魚性別控制性別。無論是傳統GMT,還是MAS-GMT,雄性率均不穩定(表2)[5,9-10,21,23,26,51-58]。傳統GMT雄性率不高,可認為是親本測交鑒定的基因型不準確導致。雖然MAS-GMT可準確鑒定親本基因型,但已證實不同的尼羅羅非魚群體存在含的XY雌性個體,且有的家系這種XY雌性個體的比例較高(接近50%),但當前僅通過特異分子標記證明存在含有的XY雌魚,將來還需通過全基因組測序,確定是否存在含有和△的XY雌魚,探究是否存在某種影響功能的突變。此外,還需探究會影響XY個體性別表型的其他因素,XY個體雄性率不穩定是限制MAS-GMT技術推廣應用的瓶頸之一[59]。目前,商業養殖品種,利用LG23進行性別控制的效果不佳,如子代雄性率低于97%則不宜推廣。如何在商業品系保障高雄性率是目前GMT技術首先需解決的關鍵問題。在日本品系尼羅羅非魚,由于該群體是實驗室封閉群體,其YY魚與XX個體繁殖后代雄性率高且穩定,可能與該群體遺傳純度高有關。因此,可在遺傳純度高,且能高效控制性別的尼羅羅非魚群體建立GMT技術。
3.2 羅非魚遺傳性別控制關鍵問題:雄性率不穩定
不論是傳統的GMT技術,還是MAS-GMT均面臨雄性率不穩定的問題。表2可見,雖然LG23的是目前克隆的羅非魚雄性較強的性別決定基因,但養殖群體大量存在XY雌魚的現象[59]。目前尚不清楚LG23 XY雌魚存在的原因。可能的原因有三:首先,性別決定基因存在減弱其雄性決定效能的突變。第二,存在雌性性別決定位點上位于含的LG23 Y,這些位點可能來自其他羅非魚,如奧利亞羅非魚LG3 W染色體雌性性別決定基因,雖然目前雜交實驗表明含的LG23 Y上位于奧利亞羅非魚LG3 W,但仍然不清楚LG3 W雌性性別決定位點純合后能否上位于,不清楚LG3 W是否對于LG23 Y有隱性上位效應。當然,也不排除羅非魚群體還存在其他的雌性性別決定位點能降低性別決定的能力[42,60]。第三,羅非魚品種混雜可能導致性別控制能力減弱,尼羅羅非魚可能需要尼羅羅非魚其他基因的協助,雜交導致尼羅羅非魚某些關鍵協助基因丟失,從導致雄性性別決定能力的降低。在日本群體尼羅羅非魚和奧利亞羅非魚雜交F1后代中,“WY”個體全雄[42]。由于日本群體遺傳純度高,因此雜交F1有一半基因來自尼羅羅非魚,它們可很好地協助決定雄性性別,而在雜交F2中,由于基因位點分離、重組、交換和突變等因素影響,不能保證所有個體均有一套來自尼羅羅非魚的完整基因,失去來自尼羅羅非魚某些關鍵基因的協助,可能不能很好地控制性別,后代可能會出現含有雌魚。是轉化生長因子-β(Transforming growth factor β,TGF-) 基因家族成員,需與其特異的I和II型受體結合,方可啟動下游信號通路[61-62]。尼羅羅非魚與其他羅非魚Amhy/Amh下游受體序列可能存在物種差異,導致Amhy和不同物種受體之間親和力出現差異,這些受體變異可能導致它們不能很好地介導Amhy信號通路。在哺乳動物,Amhr2是Amh特異的II型受體[63]。在尼羅羅非魚,突變導致XY個體由雄向雌的性逆轉,表明Amhr2也可能是Amhy/Amh的II型受體,但目前尚缺乏配體受體結合實驗數據支持[43]。有些魚類(如斑馬魚)卻僅有,在基因組中已丟失[64]。通過基因編輯技術,遺傳分析表明斑馬魚Bmpr2a可能是Amh的II型受體[65]。目前,羅非魚Amhy/Amh的I型和II型受體尚待鑒定。在生產上,羅非魚種間雜交易導致品種混雜。有的羅非魚苗種場為節省養殖空間,將尼羅羅非魚和奧利亞羅非魚混養,雖然兩者間形態易于區分,但養殖人員可能會操作失誤,兩者雜交后代外觀與親本不易區分,易造成品種混雜。羅非魚種質需嚴格管理,在GMT技術建立過程中,需建立嚴格的種質管控體系,避免品種混雜導致XY個體性別逆轉。解析在不同遺傳背景羅非魚中性別控制能力是未來研究的重要問題。

表2 遺傳雄性羅非魚技術應用現狀
4 羅非魚遺傳性別控制技術未來研究方向
4.1 鑒定羅非魚LG1和LG3上的性別決定基因
針對前述的存在LG23XY雌魚的前兩種可能原因——突變和其他雌性性別決定位點的干擾,可采取如下策略應對:首先,開發LG1和LG3性別特異分子標記,圖位克隆前述的性別決定基因。利用LG1雄性性別決定位點,讓其與位點一起控制子代性別,即培育同時有LG1 Y和LG23 Y雄性基因的超雄羅非魚作為親本,可表示為LG1 YY; LG23 YY,以更充分保障子代雄性率,避免發生突變時導致XY個體性別逆轉的情況。第二,在性別控制親本群體通過分子標記移除含有LG3雌性性別決定位點的個體,避免雌性位點對和LG1雄性性別控制能力的干擾。當然,養殖群體干擾性別控制能力的雌性位點不一定來自LG3 W染色體,還可能來自其他雌性性別決定位點,這需進一步進行基因定位克隆和功能驗證。針對存在含的XY雌魚的第3種解釋——雜交導致缺乏來自尼羅羅非魚某些協助控制性別的關鍵基因,需盡量使用尼羅羅非魚純系開展性別控制。還可通過選育,選擇控制性別能力強的家系,類似于通過選育提高奧利亞羅非魚和尼羅羅非魚雜交后代雄性率[66]。含的XY個體性別逆轉為雌魚還可能是以上因素綜合作用的結果,不同羅非魚群體出現XY雌魚的原因可能不同。鑒于此,需分析不同羅非魚群體XY雌魚,解析XY雌魚產生機制,為完善GMT技術提供基礎。
4.2 建立YY維持系
為省去分子標記大量篩選鑒定YY魚的步驟,可建立YY維持系,即將YY超雄魚用雌性激素轉化成雌魚,YY雌魚與YY超雄魚交配,生產大量YY超雄魚,大部分用于生產XY全雄魚,少量用于繼續生產YY超雄魚,如此循環下去,可長期保障穩定生產大量YY魚。YY尼羅羅非魚誘導雌性化難度較大,要求雌激素處理濃度更高、處理時間更長,而高強度的雌激素處理會影響育性[60]。最近,柳興永[67]指出,通過調整雌激素誘導條件可培育出可育的YY雌魚,建立YY維持系,實現YY雄魚規模化生產。YY雌魚誘導處理仍較復雜,還需進一步解析YY超雄魚誘導難的機理,提高YY雌魚繁殖能力,建立穩定YY維持系。
4.3 在羅非魚性別控制中應用基因編輯技術
已在多種養殖魚類建立基因編輯技術,標志養殖魚類研究進入功能基因時代,尼羅羅非魚中也已建立TALENs和CRISPR/CAS9基因編輯技術[68-70]。目前,Li等[68]已利用基因編輯技術研究30余尼羅羅非魚生殖相關基因的功能,他們的養殖魚類基因功能研究處于國際領先水平。基因編輯技術不僅可研究基因功能,還可按照既定設計進行品種改良,用于生物精準育種。斑點叉尾鮰()和團頭魴()在敲除肌肉生長抑制基因后,生長加快、個體變大[71-72],為應用基因編輯技術改良水產動物生長性能提供了參考。尼羅羅非魚多個基因敲除可導致性別逆轉,如敲除、導致由雄向雌的性別逆轉,敲除、導致由雌向雄的性別逆轉[73-76]。因此,通過基因編輯可控制羅非魚性別,并可與GMT技術結合應用。如鯉(L.)敲除后,獲得-/-的XX偽雄魚,將其與正常XX雌魚交配,可以獲得全雌+/-鯉魚,建立了一種無需任何激素誘導處理的性別控制技術[77];青鳉()純合突變導致XX個體體性別逆轉為雄性,且能產生精子細胞,XX-/-雄魚理論上可與野生型雌魚(XX+/+)交配產生雌性雜合后代[78]。此外,羅非魚性別控制關鍵問題是控制雌魚過度繁殖,可利用基因編輯技術敲除一些卵巢發育和育性相關基因,從而使雌魚不育或繁殖時間推遲,這樣即使GMT未能獲得全雄后代,性別逆轉的XY雌魚因為缺乏某些育性相關基因而表現為不育,從而避免過度繁殖。目前,基因敲除技術證明,影響雌性尼羅羅非魚育性的基因有、、、和等[79-83]。最近,王德壽教授團隊還通過編輯體色相關基因,獲得不同體色的尼羅羅非魚,如將體色基因編輯與GMT技術結合,可培育消費者喜愛體色的全雄羅非魚[84]。基因編輯技術可按照人們的設計改變魚類性狀,將來在羅非魚育種中有廣闊的應用前景。
綜上,GMT技術是一項有發展潛力的羅非魚遺傳性別控制育種技術,40多a來,學界在性別連鎖標記開發、性別決定基因克隆等方面取得不少階段性成果。羅非魚性別決定機制復雜,GMT技術培育的魚苗雄性率不穩定,制約了GMT技術推廣應用。筆者分析了導致XY個體性別逆轉的可能因素,提出了將來GMT技術研究的關鍵問題,探討了現代基因編輯技術在羅非魚性別控制育種中可能的應用。我國是羅非魚養殖大國,大量羅非魚苗種依賴激素處理,需通過技術革新,建立綠色高效的性控方法。攻克羅非魚性別控制育種的技術難題,還可為其他水產動物性別控制育種提供參考。
西南大學王德壽教授詳細審閱本文,謹致謝忱。
[1] FAO.Food and Agriculture Organization of the United Nations (FAO).Cultured aquatic species information programme,(Linnaeus, 1758) [EB/OL].(2006-05-19) [2021-10-10].http://www.fao.org/ fishery/culturedspecies/Oreochromis_niloticus/en.
[2] FAO.Food and Agriculture Organization of the United Nations (FAO).The state of world fisheries and aquaculture 2020.Sustainability in action[EB/OL].[2021-10-10].https://doi.org/10.4060/ca9229zh.
[3] 代云云, 袁永明, 袁媛, 等.中國羅非魚產業供求分析[J].中國農學通報, 2021, 37(7): 144-149.
[4] Yá?EZ J M, JOSHI R, YOSHIDA G M.Genomics to accelerate genetic improvement in tilapia[J].Animal Genetics, 2020, 51(5): 658-674.
[5] MAIR G C, ABUCAY J S, BEARDMORE J A, et al.Growth performance trials of genetically male tilapia (GMT) derived from YY-males inL.: on station comparisons with mixed sex and sex reversed male populations[J].Aquaculture, 1995, 137(1/2/3/4): 313-323.
[6] SINGH A K.Introduction of modern endocrine techniques for the production of monosex population of fishes[J].General and Comparative Endocrinology, 2013, 181: 146-155.
[7] MEGBOWON I, MOJEKWU T O.Tilapia sex reversal using methyl testosterone (MT) and its effect on fish, man and environment[J].Biotechnology(Faisalabad), 2014, 13(5): 213-216.
[8] LOZANO C A, GJERDE B, ?DEG?RD J, et al.Heritability estimates for male proportion in hybrids between Nile tilapia females () and blue tilapia males ()[J].Aquaculture, 2014, 430: 66-73.
[9] 楊永銓, 張中英, 林克宏, 等.應用三系配套途徑產生遺傳上全雄莫桑比克羅非魚[J].遺傳學報, 1980, 7(3): 241-246.
[10] SUN Y L, JIANG D N, ZENG S, et al.Screening and characterization of sex-linked DNA markers and marker-assisted selection in the Nile tilapia ()[J].Aquaculture, 2014, 433: 19-27.
[11] AVTALION R R, DON J.Sex-determining genes in tilapia: a model of genetic recombination emerging from sex ratio results of three generations of diploid gynogenetic[J].Journal of Fish Biology, 1990, 37(1): 167-173.
[12] MAIR G C, SCOTT A G, PENMAN D J, et al.Sex determination in the genus1.Sex reversal, gynogenesis and triploidy in(L.) [J].Theoretical and Applied Genetics, 1991, 82(2): 144-152.
[13] HARVEY S C, BOONPHAKDEE C, CAMPOS-RAMOS R, et al.Analysis of repetitive DNA sequences in the sex chromosomes of[J].Cytogenetic and Genome Research, 2003, 101(3/4): 314-319.
[14] 梅潔, 桂建芳.魚類性別異形和性別決定的遺傳基礎及其生物技術操控[J].中國科學: 生命科學, 2014, 44(12): 1198-1212.
[15] BARDAKCI F.The use of random amplified polymorphic DNA (RAPD) markers in sex discrimination in Nile Tilapia,(Pisces: Cichlidae)[J].Turkish Journal of Biology, 2000, 24(2):169-176.
[16] LEE B Y, PENMAN D J, KOCHER T D.Identification of a sex-determining region in Nile tilapia () using bulked segregant analysis[J].Animal Genetics, 2003, 34(5): 379-383.
[17] LEE B Y, COUTANCEAU J P, OZOUF-COSTAZ C, et al.Genetic and physical mapping of sex-linked AFLP markers in Nile tilapia ()[J].Marine Biotechnology (New York), 2011, 13(3): 557-562.
[18] EZAZ M T, HARVEY S C, BOONPHAKDEE C, et al.Isolation and physical mapping of sex-linked AFLP markers in Nile tilapia (L.)[J].Marine Biotechnology (New York), 2004, 6(5): 435-445.
[19] PALAIOKOSTAS C, BEKAERT M, KHAN M G Q, et al.Mapping and validation of the major sex-determining region in Nile tilapia (L.) using RAD sequencing[J].PLoS One, 2013, 8(7): e68389.
[20] ESHEL O, SHIRAK A, WELLER J I, et al.Fine-mapping of a locus on linkage group 23 for sex determination in Nile tilapia ()[J].Animal Genetics, 2011, 42(2): 222-224.
[21] ESHEL O, SHIRAK A, WELLER J I, et al.Linkage and physical mapping of sex region on LG23 of Nile tilapia ()[J].G3 Genes|Genomes|Genetics, 2012, 2(1): 35-42.
[22] ESHEL O, SHIRAK A, DOR L, et al.Identification of male-specific amh duplication, sexually differentially expressed genes and microRNAs at early embryonic development of Nile tilapia ()[J].BMC Genomics, 2014, 15(1): 774.
[23] CHEN C H, LI B J, GU X H, et al.Marker-assisted selection of YY supermales from a genetically improved farmed tilapia-derived strain[J].Zoological Research, 2019, 40(2): 108-112.
[24] CáCERES G, LóPEZ M E, CáDIZ M I, et al.Fine mapping using whole-genome sequencing confirms anti-müllerian hormone as a major gene for sex determination in farmed Nile tilapia (L.)[J].G3Genes|Genomes|Genetics,2019,9(10): 3213-3223.
[25] TASLIMA K, WEHNER S, TAGGART J B, et al.Sex determination in the GIFT strain of tilapia is controlled by a locus in linkage group 23[J].BMC Genetics, 2020, 21(1): 49.
[26] SULTANA N, KHAN M G Q, HOSSAIN M A R, et al.Allelic segregation of sex-linked microsatellite markers in Nile tilapia () and validation of inheritance in YY population[J].Aquaculture Research, 2020, 51(5): 1923-1932.
[27] SISSAO R, D'COTTA H, BAROILLER J F, et al.Mismatches between the genetic and phenotypic sex in the wild Kou population of Nile tilapia[J].PeerJ, 2019, 7: e7709.
[28] TRIAY C, CONTE M A, BAROILLER J F, et al.Structure and sequence of the sex determining locus in two wild populations of Nile tilapia[J].Genes, 2020, 11(9): 1017.
[29] BAROILLER J F, D'COTTA H, BEZAULT E, et al.Tilapia sex determination: where temperature and genetics meet[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 153(1): 30-38.
[30] ZHAO Y, CHEN H J, WANG Y Y, et al.Gonad development examination of high-temperature-treated genetically female Nile tilapia[J].Aquaculture, 2020, 515: 734535.
[31] KHATER E S G, ALI S A, MOHAMED W E.Effect of water temperature on masculinization and growth of Nile tilapia fish[J].Journal of Aquaculture Research & Development, 2017, 8(9): 507.
[32] WESSELS S, H?RSTGEN-SCHWARK G.Selection experiments to increase the proportion of males in Nile tilapia () by means of temperature treatment[J].Aquaculture, 2007, 272: S80-S87.
[33] LüHMANN L M, KNORR C, H?RSTGEN-SCHWARK G, et al.First evidence for family-specific QTL for tempe- rature-dependent sex reversal in Nile tilapia ()[J].Sexual Development, 2012, 6(5): 247-256.
[34] LEE B Y, HULATA G, KOCHER T D.Two unlinked loci controlling the sex of blue tilapia ()[J].Heredity, 2004, 92(6): 543-549.
[35] WU X, ZHAO L, FAN Z, et al.Screening and characterization of sex-linked DNA markers and marker-assisted selection in blue tilapia ()[J].Aquaculture, 2021, 530: 735934.https://doi.org/10.1016/j.aquaculture.2020.735934
[36] CNAANI A, LEE B Y, ZILBERMAN N, et al.Genetics of sex determination in tilapiine species[J].Sexual Development, 2008, 2(1): 43-54.
[37] GAMMERDINGER W J, CONTE M A, SANDKAM B A, et al.Characterization of sex chromosomes in three deeply diverged species of Pseudocrenilabrinae (Teleostei: Cichlidae)[J].Hydrobiologia, 2019, 832(1): 397-408.
[38] TAO W J, CAO J M, XIAO H S, et al.A chromosome-level genome assembly of Mozambique tilapia () reveals the structure of sex determining regions[J].Frontiers in Genetics, 2021, 12: 796211.https://doi.org/10.3389/fgene.2021.796211
[39] LEE B Y, LEE W J, STREELMAN J T, et al.A second-generation genetic linkage map of tilapia (spp.)[J].Genetics, 2005, 170(1): 237-244.
[40] LIU F, SUN F, LI J, et al.A microsatellite-based linkage map of salt tolerant tilapia (×spp.) and mapping of sex-determining loci[J].BMC Genomics, 2013, 14: 58.
[41] 譚德階.羅非魚近緣種雜交系的建立及其性別連鎖分子標記的篩選[D].重慶: 西南大學, 2018.
[42] CHEN J L, FAN Z, TAN D J, et al.A review of genetic advances related to sex control and manipulation in tilapia[J].Journal of the World Aquaculture Society, 2018, 49(2): 277-291.
[43] LI M H, SUN Y L, ZHAO J E, et al.A tandem duplicate of anti-Müllerian hormone with a missense SNP on the Y chromosome is essential for male sex determination in Nile tilapia,[J].PLoS Genetics, 2015, 11(11): e1005678.
[44] CURZON A Y, SHIRAK A, DOR L, et al.A duplication of the Anti-Müllerian hormone gene is associated with genetic sex determination of differentstrains[J].Heredity, 2020, 125(5): 317-327.
[45] LIU X, DAI S, WU J, et al..Roles of anti-Müllerian hormone and its duplicates in sex determination and germ cell proliferation of Nile tilapia.Genetics, 2021, iyab237.https://doi.org/10.1093/genetics/iyab237
[46] CONTE M A, CLARK F E, ROBERTS R B, et al.Origin of a giant sex chromosome[J].Molecular Biology and Evolution, 2021, 38(4): 1554-1569.
[47] TAO W J, XU L H, ZHAO L, et al.High-quality chromosome-level genomes of two tilapia species reveal their evolution of repeat sequences and sex chromosomes[J].Molecular Ecology Resources, 2021, 21(2): 543-560.
[48] CURZON A Y, SHIRAK A, BENET-PERLBERG A, et al.Gene variant of barrier to autointegration factor 2 (Banf2w) is concordant with female determination in cichlids[J].International Journal of Molecular Sciences, 2021, 22(13): 7073.
[49] BACHTROG D, MANK J E, PEICHEL C L, et al.Sex determination: why so many ways of doing it? [J].PLoS Biology, 2014, 12(7): e1001899.
[50] TAO W J, CONTE M A, WANG D S, et al.Network architecture and sex chromosome turnovers: do epistatic interactions shape patterns of sex chromosome replacement? [J].BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, 2020, 43(3): e2000161.
[51] MAIR G C, ABUCAY J S, ABELLA T A, et al.Genetic manipulation of sex ratio for the large-scale production of all-male tilapia[J].Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(2): 396-404.
[52] EZAZ M T, MYERS J M, POWELL S F, et al.Sex ratios in the progeny of androgenetic and gynogenetic YY male Nile tilapia,L[J].Aquaculture, 2004, 232(1/2/3/4): 205-214.
[53] GENNOTTE V, MAFWILA KINKELA P, ULYSSE B, et al.Brief exposure of embryos to steroids or aromatase inhibitor induces sex reversal in Nile tilapia ()[J].Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2015, 323(1): 31-38.
[54] 陳榮華, 蔡添財, 劉富光.超雄性 (YY) 尼羅吳郭魚之選育及單雄性魚苗量產的應用[J].水產研究, 2013, 21(2): 69-82.
[55] 楊永銓, 張海明, 陳遠生, 等.尼羅羅非魚新品種“鷺雄1號”的制種研究[J].淡水漁業, 2013, 43(2): 92-95.
[56] 羅非魚“粵閩1號”[J].中國水產, 2021(4): 92-96.
[57] SALIRROSAS D, LEON J, ARQUEROS-AVALOS M, et al.YY super males have better spermatic quality than XY males in red tilapia[J].Scientia Agropecuaria, 2017, 8(4): 349-355.
[58] 江東能, 彭友幸, 黃遠青, 等.基于天然XY雌魚培育YY超雄尼羅羅非魚的新方法[J].水產學報, 2020, 44(11): 1862-1872.
[59] JIANG D N, KUANG Z Y, YANG K S, et al.Polymorphism in a sex-linked DNA marker located on LG23 in Hainan strain of Nile tilapia ()[J].Journal of the World Aquaculture Society, 2022, 53(1): 205-223.
[60] 江東能.Gsdf和Wt1在羅非魚性別分化和性腺發育中的功能研究[D].重慶: 西南大學, 2016.
[61] ZHENG S Q, LONG J, LIU Z L, et al.Identification and evolution of TGF-β signaling pathway members in twenty-four animal species and expression in tilapia[J].International Journal of Molecular Sciences, 2018, 19(4): 1154.
[62] 龍娟, 鄭樹清, 王曉雙, 等.TGF-β信號通路在魚類性別決定與分化中的作用[J].水產學報, 2020, 44(1): 166-177.
[63] JOSSO N, DI CLEMENTE N, GOUéDARD L.Anti-Müllerian hormone and its receptors[J].Molecular and Cellular Endocrinology, 2001, 179(1/2): 25-32.
[64] YAN Y L, BATZEL P, TITUS T, et al.A hormone that lost its receptor: anti-müllerian hormone (AMH) in zebrafish gonad development and sex determination[J].Genetics, 2019, 213(2): 529-553.
[65] ZHANG Z W, WU K, REN Z Q, et al.Genetic evidence for Amh modulation of gonadotropin actions to control gonadal homeostasis and gametogenesis in zebrafish and its noncanonical signaling through Bmpr2a receptor[J].Development (Cambridge, England), 2020, 147(22): dev189811.
[66] CURZON A Y, SHIRAK A, ZAK T, et al.All-male production by marker-assisted selection for sex determining loci of admixedandstocks[J].Animal Genetics, 2021, 52(3): 361-364.
[67] 柳興永.Amh/Amhy在羅非魚生殖中的功能研究與可育YY偽雌魚的培育[D].重慶: 西南大學, 2020.
[68] LI M H, DAI S F, LIU X Y, et al.A detailed procedure for CRISPR/Cas9-mediated gene editing in tilapia[J].Hydrobiologia, 2021, 848(16): 3865-3881..
[69] LI M H, YANG H H, LI M R, et al.Antagonistic roles of Dmrt1 and Foxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs[J].Endocrinology, 2013, 154(12): 4814-4825.
[70] LI M H, YANG H H, ZHAO J E, et al.Efficient and heritable gene targeting in tilapia by CRISPR/Cas9[J].Genetics, 2014, 197(2): 591-599.
[71] KHALIL K, ELAYAT M, KHALIFA E, et al.Generation of myostatin gene-edited channel catfish () via zygote injection of CRISPR/Cas9 system[J].Scientific Reports, 2017, 7: 7301.
[72] SUN Y, ZHENG G D, NISSA M, et al.Disruption ofandgene through CRISPR/Cas9 leads to elevated muscle mass in blunt snout bream ()[J].Aquaculture, 2020, 528: 735597.
[73] JIANG D N, YANG H H, LI M H, et al.Gsdf is a downstream gene ofthat functions in the male sex determination pathway of the Nile tilapia[J].Molecular Reproduction and Development, 2016, 83(6): 497-508.
[74] ZHANG X B, LI M R, MA H, et al.Mutation of foxl2 or cyp19a1a results in female to male sex reversal in XX Nile tilapia[J].Endocrinology, 2017, 158(8): 2634-2647.
[75] LI M H, SUN L N, WANG D S.Roles of estrogens in fish sexual plasticity and sex differentiation[J].General and Comparative Endocrinology, 2019, 277: 9-16.
[76] DAI S F, QI S S, WEI X Y, et al.Germline sexual fate is determined by the antagonistic action of dmrt1 and foxl3/foxl2 in tilapia[J].Development (Cambridge, England), 2021, 148(8): dev199380.https://doi.org/10.1242/ dev.199380.
[77] ZHAI G, SHU T T, CHEN K X, et al.Successful production of an all-female common carp (L.) population using cyp17a1-deficient neomale carp[J].Engineering, 2021.DOI:10.1016/j.eng.2021.03.026.
[78] 周運迪, 吳星星, 趙海萍, 等.青鳉基因敲除突變體的構建與表型分析[J].廣東海洋大學學報, 2019, 39(2): 20-30.
[79] 陳錦霖.翻譯延伸因子eEF1A1b和42Sp50在羅非魚配子發生中的功能研究[D].重慶: 西南大學, 2018.
[80] LIU X Y, XIAO H S, JIE M M, et al.Amh regulate female folliculogenesis and fertility in a dose-dependent manner through Amhr2 in Nile tilapia[J].Molecular and Cellular Endocrinology, 2020, 499: 110593.
[81] YAN L X, FENG H W, WANG F L, et al.Establishment of three estrogen receptors (esr1, esr2a, esr2b) knockout lines for functional study in Nile tilapia[J].The Journal of Steroid Biochemistry and Molecular Biology, 2019, 191: 105379.
[82] TAO W J, SHI H J, YANG J, et al.Homozygous mutation of foxh1 arrests oogenesis causing infertility in female Nile tilapia[J].Biology of Reproduction, 2019, 102(3): 758-769.
[83] JIANG D N, PENG Y X, LIU X Y, et al.Homozygous mutation of gsdf causes infertility in female Nile tilapia ()[J].Frontiers in Endocrinology, 2022.https://doi.org/10.3389/fendo.2022.813320.
[84] WANG C X, LU B Y, LI T, et al.Nile tilapia: a model for studying teleost color patterns[J].Journal of Heredity, 2021, 112(5): 469-484.
A Review of on Genetic Sex Control Breeding of Tilapia
JIANG Dong-neng1, JIAO Kai-zhi1, ZHANG Jun-ming1, PENG You-xing1, YANG Kong-song2, ZHENG De-feng2, GUO Xiang-zhao2, SHI Hong-juan1, LI Guang-li1
(1.,,524088,; 2.,,511400,)
Tilapia is a worldwide aquaculture fish.Since the male is growing faster than the female, all-male culture is preferable in tilapia aquaculture,to avoid unwanted reproduction before harvest and increase culture efficiency.Genetically male tilapia (GMT) technology is an efficient method of sex control, which has a history of more than 40 years.This paper reviews the progress and existing problems of GMT technology.In recent years, genomics and gene editing techniques have been widely used in tilapia research, which has greatly promoted the fundamental theoretical research of tilapia sex determination and differentiation.However, sex differetiation of tilapia is affected by many genetic and environmental factors, and GMT technology is difficult to guarantee the male rate in commercial strains limiting the large-scale application of this technology.Analyzing the reason for the existence of XY females will promote the development of GMT technology.The improvement of GMT technology will boost the aquaculture industry to develop healthily and provide references for sex control breeding of other aquatic animals.
Genetically Male Tilapia (GMT); sex control; sex determination; gene editing
S965.125;Q953+.3
A
1673-9159(2022)02-0148-09
10.3969/j.issn.1673-9159.2022.02.019
2021-10-12
國家自然科學基金(31702326和32002367);中國博士后科學基金(2019M652829)
江東能(1987―),男,副教授,博士,主要從事水產動物繁殖生物學研究。E-mail: dnjiang@gdou.edu.cn
李廣麗(1967―),女,教授,博士,主要從事水產動物生理學研究。E-mail: ligl@gdou.edu.cn
江東能,焦開智,張峻銘,等.羅非魚性別控制遺傳育種研究進展[J].廣東海洋大學學報,2022,42(2):148-156.
(責任編輯:劉慶穎)

