分散溶劑對PEMFC催化層中超薄Nafion離聚物質子傳導的影響
韓愛娣,閆曉暉,陳俊任,程曉靜,章俊良
上海交通大學,教育部動力與機械工程重點實驗室,機械與動力工程學院,燃料電池研究所,上海 200240
1 引言
雖然質子交換膜燃料電池(PEMFC)是一種清潔高效的新型能源技術,優勢突出且技術水平已達到實用要求,但是貴金屬鉑(Pt)所帶來的高成本限制了這項技術的大規模產業化應用1。降低燃料電池成本的關鍵在于降低貴金屬催化劑的載量、提升催化劑的利用率2,并保證超低催化劑載量下電池性能不損失。研究者們經過多年的研究,開發出了很多種類的高質量比活性的Pt基催化劑,主要包括Pt-M (M為過渡金屬,如Fe、Co、Ni等)合金催化劑3-5、形貌可控的Pt催化劑6,7及形貌可控的Pt-M合金催化劑8,9。而電池在運行過程造成的損失問題仍然沒有得到很好的解決,限制了PEMFC的進一步發展。此外,催化劑利用率低的問題也沒有得到解決,主要是由于三相界面構建規則尚未明確。
在我們之前的研究工作中發現10,由于催化層中的離聚物薄膜處于納米尺度,薄膜的質子電導率相比微米尺度的體相膜要低一個數量級以上,可能導致PEMFC催化層中嚴重的質子傳導問題,并且隨著超低Pt催化劑的開發和商業應用這個問題會更加凸顯。而PEMFC催化層中的質子傳導問題長期以來一直被忽略。由于超薄Nafion離聚物的質子傳導能力是由薄膜微觀結構以及宏觀環境條件決定的,因此,繼續研究并尋找可以改善Nafion薄膜結構使其擁有更高的質子傳導能力,為解決催化層的質子傳導問題提供有效的途徑有指導意義。
追溯PEMFC膜電極的制備過程,催化層是通過靜電噴涂的手段將催化劑油墨噴涂在質子交換膜或者其他基底上,經溶液揮發、熱壓后制備成表面平整的膜電極并裝配進電池中。催化劑油墨由Pt/C催化劑顆粒、Nafion離聚物、溶劑經充分的球磨分散而成,因此成型后催化層中的Nafion離聚物薄膜的微觀結構可能會由于碳載體、溶劑的不同而不同。有研究表明Nafion懸濁液中的Nafion離聚物是以直徑3-5 nm、長度20 nm左右的棒狀膠束形式存在的,首先形成較小尺寸(~1 μm)的初級聚集體再形成較大的聚集體(~10 μm)11。Welch等12發現,Nafion分散在不同的溶劑中,表現出不同的形態:在甘油和乙二醇混合溶液中形成均勻的圓柱形分散體,在水和異丙醇混合物中形成高度溶劑化的大顆粒(> 200 nm),在N-甲基-2-吡咯烷酮中表現為真溶液行為。Rajkamal等13,14針對異丙醇(IPA)/水混合溶液中Nafion的膠體結構進行了進一步的分析,發現Nafion離聚物的流體力學直徑(Dh)隨著IPA含量的減少而降低,小角中子散射(SANS)強度分布圖表明隨著IPA相對含量從70%下降到10%,離聚物的直徑逐漸增大。
Nafion在不同的溶液中表現出不同的分散形態,在催化層制備過程中Nafion主要是通過自組裝的過程成膜,那么我們有理由推測溶液中膠體形態對成膜后的Nafion結構產生影響,進而影響Nafion薄膜的質子傳導行為。因此,我們在本文的研究中將建立Nafion在溶液中的形態與Nafion成膜后的形態的聯系,進而探討通過改變溶劑的種類,對改善超薄Nafion膜質子電導率的可能性。
2 實驗部分
2.1 薄膜制備
由于催化層自身結構非常復雜且催化層中包含電子、質子、反應氣體、水的多種傳輸行為,難以對質子傳導行為進行分析。因此需要模擬催化層中Nafion薄膜的形成過程,對Nafion薄膜進行單獨的研究,以期得到更詳細的質子傳導行為信息。本文將采用分子自組裝的方法制備厚度可控的超薄Nafion膜15,16。分子自組裝過程很好的模擬了催化層中Nafion包覆Pt/C團簇的形成過程,并將復雜的催化層結構簡化為模型基底上的平面結構,為后續薄膜的質子傳導研究及微觀結構研究提供便利。
用不同的溶劑(正丁醇、正丙醇、異丙醇等)稀釋質量分數為20.0% (w)、EW-1000的Nafion濃溶液,以獲得濃度為0.5% (w)的Nafion稀溶液。將稀釋的Nafion溶液超聲處理5 min,使Nafion分子在溶劑中充分分散,然后平衡靜置至少24 h使Nafion達到比較低的聚集狀態。將尺寸為1 cm × 1 cm表面生長有200 nm SiO2薄層的硅晶片用作模型基底,如圖1所示。在基底上用光刻刻蝕技術制造叉指(Interdigital Array,IDA)微電極,用以進行納米級薄膜的電導率測試。IDA的寬度為10 μm,長度為5 mm,齒數為45,齒間距離為100 μm。圖1a所示為叉指電極的三維模型圖,圖1b所示為叉指電極的二維結構圖。自組裝方法15,16制備Nafion超薄膜的步驟如下:將基底放置于濃度為0.5% (w)的Nafion溶液中,自組裝24 h;從溶液中小心移除長有薄膜的基底后,用氮氣吹去薄膜表面附著的溶液,然后在30 °C的真空干燥箱中做進一步干燥。
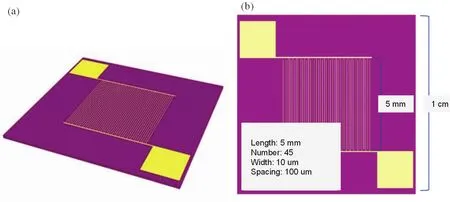
圖1 制備有金叉指電極的硅基底的結構示意圖Fig. 1 Schematic diagram of the structure of interdigital array microelectrode substrate.
2.2 Nafion在溶液中的膠束形態表征
將濃度為0.5% (w)溶劑分別為正丁醇、異丙醇、正丙醇的Naifon溶液放入樣品皿中,采用Zetasizer Nano S型納米粒度分析儀基于動態光散射(DLS)原理,根據顆粒在液體中做布朗運動的速度測定顆粒的大小。每個樣品測量三次取平均值。
將濃度為1.0% (w)溶劑分別為正丁醇、異丙醇、正丙醇的Naifon溶液與氘代甲醇進行質量比為1 : 1混合,制成濃度分別為0.5% (w)的溶劑分別為正丁醇/氘代甲醇、異丙醇/氘代甲醇、正丙醇/氘代甲醇的Nafion溶液。采用700 MHz核磁共振波譜儀進行19F核磁共振譜(NMR)表征。通過分析19F譜的峰值強度信息,判斷Nafion的主鏈、側鏈遷移率。
2.3 Nafion薄膜形態表征
用刀片在薄膜上畫一條劃痕使SiO2基底暴露在表面,通過原子力顯微鏡(AFM)在敲擊模式下進行薄膜表面形貌及薄膜厚度的掃描,確定薄膜表面是否平整且連續并測量薄膜的厚度。
利用Autolab PGSTAT204電化學工作站進行超薄Nafion電化學阻抗譜(EIS)的測量,擾動電壓設定為0.1 V,掃描頻率設定為106-1 Hz,通過對阻抗譜的分析得出薄膜電阻和薄膜的質子電導率。在電導率測試過程中,將樣品放置在恒溫恒濕箱內,所有測試均在98%的相對濕度(Relative Humidity,RH)下進行,以確保Nafion離聚物完全水合。薄膜質子電導率的計算公式為:

式中,σ,質子電導率(S·m-1);Rf,薄膜的電阻(Ω);d,叉指電極齒與齒的間距(m);l,叉指電極齒的長度(m);N,叉指電極齒的數量;δ,Nafion薄膜的厚度(m)。
3 結果與討論
溶劑的介電常數(Dielectric Constant)是指將相反電荷在溶液中分開的能力,它反映了溶劑分子的極性大小。介電常數大的溶劑極性大,介電常數小的極性小。介電常數通常采用電容測定儀測定溶劑的電容值C求得,如下式所示。

式中,C0為電容器在真空時的電容值,常以空氣為介質測得的電容值代替,通常測得的空氣的介電常數接近于1。
由于Nafion分子由非極性的PTFE骨架和極性的~SO3H支鏈組成。Nafion在極性的有機溶劑中,非極性的PTFE骨架聚集成核,極性的~SO3H支鏈分布在表面,形成具有一定直徑和長度尺寸的棒狀膠束。由于溶劑介電常數不同而導致的Nafion主鏈在溶劑中的溶解性不同以及Nafion分子骨架和支鏈之間不同的相互作用,可能會導致Nafion膠束的形態呈現出一定的規律性,因此我們按照溶劑介電常數從小到大排序選取常用溶劑(乙酸丁酯、乙酸乙酯、正丁醇、異丙醇、正丙醇、乙醇、甲醇、N-甲基-2-吡咯烷酮、二甲基亞砜、水),對Nafion在溶劑中的分散形態進行分析。
3.1 Nafion在溶劑中以及Nafion成膜后的形態
將濃度為20.0% (w)的Nafion溶液分別用乙酸丁酯、乙酸乙酯、正丁醇、異丙醇、正丙醇、乙醇、甲醇、N-甲基-2-吡咯烷酮、二甲基亞砜、水稀釋到0.5% (w),經超聲靜止后觀察Nafion在溶劑中的形態。
使用介電常數較小的乙酸丁酯、乙酸乙酯分散的Nafion中產生明顯沉淀,說明Nafion分子在極性小的溶劑中大量聚集,無法形成穩定的分散體系,因而也無法進行薄膜的自組裝過程。在極性較大的正丁醇、異丙醇、正丙醇、乙醇、甲醇、N-甲基-2-吡咯烷酮、二甲基亞砜、水中,Nafion均呈現出良好的分散性,且靜止24 h后分散系仍舊穩定。
將Si基底置于分散性良好的正丁醇、異丙醇、正丙醇、乙醇、甲醇、N-甲基-2-吡咯烷酮、二甲基亞砜、水的Nafion分散系中,進行24 h自組裝過程,取出并干燥后觀察Si基底表面Nafion離聚物的成膜狀態。我們發現,使用極性較大的N-甲基-2-吡咯烷酮、二甲基亞砜、水作為溶劑稀釋的Nafion,經24 h自組裝過程后,Si基底表面并未形成穩定的Nafion薄膜,或者形成薄膜后,由于溶劑較大的表面張力,在吹干的過程中,薄膜重新溶入基底表面殘留的溶劑中,被帶走。而用介電常數位于20左右的幾種醇類稀釋的Nafion溶液進行薄膜的自組裝過程,可以形成表面連續且厚度均一的薄膜。詳細的Nafion在溶劑中的分散狀態與Nafion的成膜狀態如表1所示。
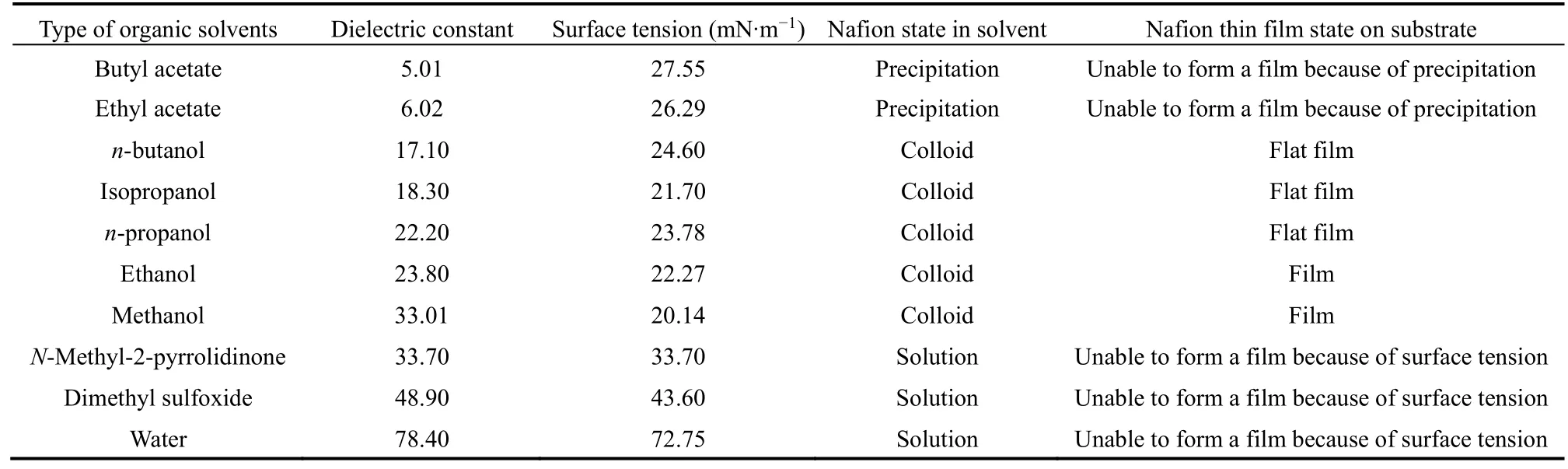
表1 常用有機溶劑的介電常數表及Nafion在基底上的成膜狀態Table 1 Dielectric constant of commonly used organic solvents and state of Nafion thin film on substrate.
溶劑種類對Nafion薄膜的影響首先表現在自組裝速率上,當我們采用質量分數為1.0% (w)的Nafion溶液進行24 h的自組裝后,Si基底上薄膜的厚度隨溶劑的介電常數呈規律性變化。如圖2所示,溶劑的介電常數越大,溶劑中Nafion分子的自組裝速率越快,經過相同的自組裝時間后,得到薄膜的厚度越大。例如,在相同的自組裝時間和Nafion濃度下,介電常數為33.7的甲醇體系制備出厚度為95 nm的薄膜,介電常數為22的正丙醇體系制備出厚度為70 nm的薄膜,介電常數為17.1的正丁醇體系制備出厚度為50 nm的薄膜。薄膜厚度呈現出的規律性可能反映了介電常數對溶液膠束形態影響的規律性,Nafion在介電常數較大的溶劑中更容易形成有利于Nafion沉降的條件;此外,還說明Nafion膠束與基底的靜電作用里更強,使得Nafion在介電常數較大的溶劑中,有更快的組裝速率。關于這方面的論述還需要更精細的表征結果進行驗證,我們將在后文詳細討論。

圖2 有機溶劑對Nafion薄膜自組裝厚度的影響Fig. 2 Effects of solvents on the self-assembly thickness of Nafion films.
為了探究單變量因素(溶劑)對Nafion成膜后的質子電導率的影響,我們通過調整不同溶劑的自組裝時間,使得基于不同溶劑制備出的Nafion薄膜厚度保持一致。制備出厚度均為40 nm左右的薄膜,所使用的溶劑為正丁醇、異丙醇、正丙醇三種。三種溶劑均可制備出厚度均一的薄膜,其中丁醇所制成的薄膜的AFM的表面表征結果及厚度測量結果如圖3所示。制備而成的薄膜樣品在微觀上有大約1 nm左右的粗糙度,宏觀上呈現均勻平整的狀態。

圖3 AFM的測試得到的40 nm Nafion薄膜的表征結果Fig. 3 Characterization results of 40 nm Nafion film obtained by AFM test.
3.2 Nafion薄膜的電導率測試結果
圖4a所示Nafion在保證質量分數相同但使用不同種類有機溶劑稀釋的條件下,通過自組裝時間的方法制備而成的40 nm薄膜的電導率的測試結果,與前文所述的測量方法相同,均通過EIS在96%濕度下得到薄膜的質子阻抗,而后通過公式轉化成質子電導率的結果。圖4b所示為根據薄膜在不同溫度下的電導率結果繪制而成的阿倫尼烏斯圖,每個樣品在阿倫尼蘇斯圖中直線的斜率大小可以表示樣品活化能的高低。容易觀察到40 nm厚的Nafion膜的質子電導率隨著所用溶劑的不同而不同。其中使用丁醇作為稀釋溶劑的Nafion薄膜質子電導率最高,所對應的活化能最小為15.19 kJ·mol-1,稀釋溶劑為異丙醇的薄膜質子電導率次之,所對應的活化能略高為17.04 kJ·mol-1,稀釋溶劑為正丙醇的薄膜質子電導率最低,所對應的活化能最大為18.83 kJ·mol-1。雖在三種溶劑中,使用丁醇稀釋的Nafion薄膜電導率最高,但仍遠小于體相膜的質子電導率(圖中虛線所示)。更換溶劑并未完全克服由于限域效應造成的質子電導率降低的問題。但可以預見的是丁醇使Nafion離聚物在成膜的過程中形成了更有利于質子傳導的通道,因而得到了更高的質子電導率。
電導率的測試結果可以看出,采取不同的稀釋溶劑可以改變Nafion薄膜的質子傳導能力,且隨著所使用的溶劑的介電常數降低,所制備出的薄膜的活化能也降低,如表2所示。介電常數和活化能表現出的相關性表明Nafion在溶液中的狀態以及Nafion薄膜的結構與溶劑的物理性質有相關性,溶劑與Nafion分子的相互作用使Nafion成膜過程中產生或促進或抑制質子傳導能力的結構。

表2 有機醇溶劑(相對濕度96%)稀釋的40 nm薄膜的活化能結果Table 2 Activation energy results of 40 nm films diluted with organic alcohol solvents (Relative humidity: 96%).
3.3 機理分析
為了進一步解釋所使用的稀釋溶劑的不同對Nafion薄膜結構以及質子電導率的影響,我們還進行了動態光散射(DLS)、核磁共振(NMR)、接觸角以及表面能的測試。
圖5所示為利用納米粒度分析儀進行動態光散射表征所測得的Nafion在正丁醇、異丙醇和正丙醇的粒徑分布圖。由于溶液中顆粒的粒徑大小與其布朗運動有相關性,動態光散射就是通過分析溶液中顆粒由于布朗運動所引起的隨時間波動的散射光信息來判斷溶液中顆粒的粒徑大小。布朗運動與溶劑的粘度有關,散射光的分布與溶劑的折射率有關,測試過程中用到的溶劑的物理參數(粘度、折射率)在表3中列出,多次測量計算得到的Nafion懸浮液中的Nafion分子的平均流體力學直徑也在表3中列出。其中,Nafion在正丁醇溶劑中的流體力學直徑最大,達到1508.59 nm,在異丙醇中形成的膠束流體力學直徑次之,為1233.57 nm,在正丙醇中形成的膠束的流體力學直徑最小,為445.96 nm。這表明在正丁醇溶劑中,Nafion分子通過二次聚集形成了更大的膠束鏈。從介電常數的角度來分析,由于正丁醇溶劑的介電常數較小,Nafion分子中PTFE主鏈在溶劑中的溶解度更好,因此Nafion分子在溶劑中可以呈現更舒展的分子狀態,分子之間更容易在溶劑中形成的非極性主鏈為核,極性的磺酸基團側鏈向外伸展的結構,且分子更容易向縱長方向發展。而在介電常數較大的正丙醇溶劑中,非極性主鏈溶解度更低,Nafion分子則為了達到穩定的膠束結構,傾向于通過Nafion分子的折曲,使分子上的磺酸基團更多的暴露在外面,更難發展成較大的膠束體。

表3 有機醇溶劑稀釋的0.5% (w)Nafion溶液的流體力學直徑Table 3 Hydrodynamic diameter of 0.5% (w)Nafion diluted with organic alcohol solvent.
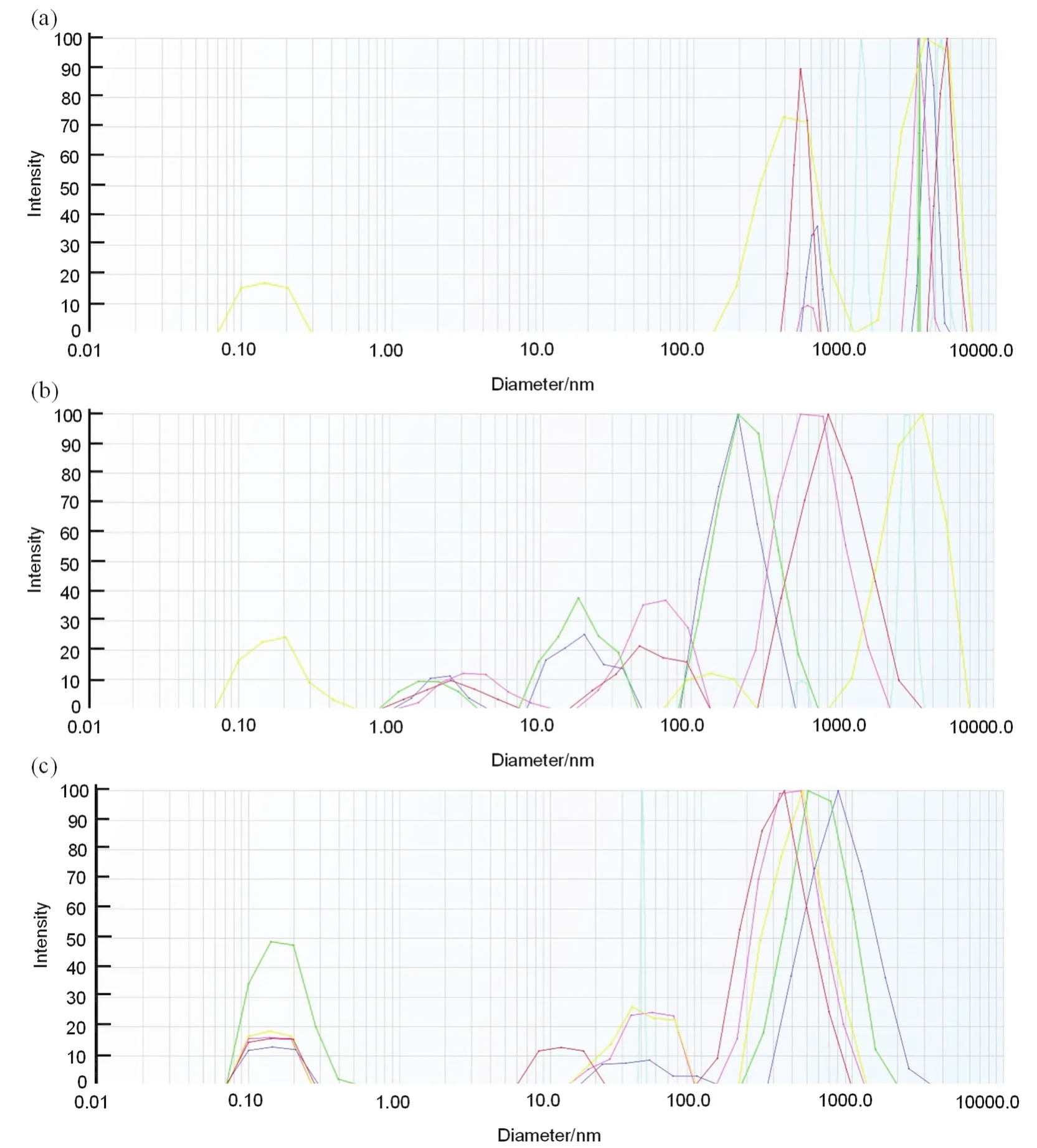
圖5 不同溶劑中Nafion的粒徑分布Fig. 5 Nafion aggregates distribution in different solvents.
如圖6所示為采用700 MHz核磁共振波譜儀測得的Nafion在正丁醇、異丙醇、正丙醇中的19F NMR譜圖。根據F元素所處環境的不同,將F元素分成a,b,c,d,e,f,g等七種。參考Welch12以及Takasaki17等分析的Nafion在溶液中19F峰的位移,位于-80、-117、-138.5和-144.5處的19F峰是由于Nafion側鏈中的19F引起的,而位于-122處的19F峰是由于主鏈中的-CF2-基團引起的。在三種分散體系中Nafion均表現出明顯的主鏈峰和側鏈峰,表明主鏈和側鏈均具有較高的鏈遷移率。而比較三個分散體中主鏈峰和側鏈峰的強度發現,隨著溶劑介電常數的降低,主鏈峰和側鏈峰的強度均有所下降。在三種分散體系中,正丁醇的鏈遷移率最低。Kim等18認為Nafion鏈遷移率的高低代表了Nafion膠束與溶劑之間相互作用的程度,當Nafion在溶劑中的遷移率較高時,Nafion分子傾向于分散在溶劑中,而當Nafion在溶劑中的遷移率較低時,Nafion分子傾向于形成聚集的膠束結構。因此在Nafion在遷移率低的正丁醇溶劑中傾向于形成聚集度更大的膠束,在遷移率較高的正丙醇溶劑中傾向于形成聚集度相對低的膠束,如圖7所示,這一點與DLS的表征結果相一致。

圖7 Nafion在溶劑中的膠束形態Fig. 7 Nafion aggregates morphology in a solvent.
為了表征成型后薄膜的表面結構,利用接觸角分析儀進行了薄膜與水和二碘甲烷的接觸角的測量。測得的分別由正丁醇和異丙醇稀釋的Nafion溶液制備而成的40 nm薄膜的接觸角如表4所示,表中每個數據均為三次測量結果的平均值數據。從表中可以看出,兩種分散體系制備出的40 nm薄膜表面呈現約95°左右的接觸角,介于親水與疏水之間。由正丁醇稀釋Nafion溶劑制備而成的Nafion薄膜表面與水(極性液體)的接觸角略小于由異丙醇稀釋的Nafion溶劑制備而成的Nafion薄膜表面的接觸角。通過測量兩種已知極性液體(水、二碘甲烷)與Nafion薄膜的接觸角,計算得到薄膜表面的表面能。對比結果發現由正丁醇稀釋Nafion溶劑制備而成的Nafion薄膜表面的表面能略高于由異丙醇稀釋的Nafion溶劑制備而成的Nafion薄膜表面的表面能(分別為25.73 mN·m-1和19.98 mN·m-1)。表明正丁醇使Nafion薄膜表面極性較強,這種較高極性可以歸因于在表面上存在更多數量的親水性磺酸鹽基團。

表4 40 nm薄膜接觸角和表面能結果Table 4 Contact angle and surface energy results of 40 nm Nafion film.
基于對40 nm厚Nafion薄膜接觸角和表面能的分析以及Nafion在三種溶劑中的膠束形態,我們預測由三種溶劑稀釋的Nafion溶液制備而成的薄膜結構如圖8所示。正丁醇薄膜中由較大的Nafion膠束堆疊而成,異丙醇和正丙醇薄膜中由依次減小的Nafion膠束堆疊而成。且隨著自組裝過程中厚度的增加在薄膜表面膠束不完全與基底平行,而是呈現出與基底有一定角度的狀態,相比于正丙醇和異丙醇體系,正丁醇體系表面聚集了更多的磺酸基團。由于正丁醇體系中,Nafion在溶劑中更好的聚集成棒狀膠束,因此自組裝而成的薄膜在水合后更容易形成連續的水分子通道,而隨著溶劑極性的增強,在異丙醇和正丙醇體系中Nafion形成較小的棒狀膠束,使水合后形成的水分子通道的連貫性受阻。因此正丁醇體系制備出的40 nm薄膜具有更好的質子電導率。此外,由于正丙醇體系薄膜成膜速率高于正丁醇體系,說明正丙醇體系中膠束與基底有更強的結合力,而在正丁醇中基底的結合力相對較弱。也就是說在靠近基底附近,正丙醇體系薄膜中有更大比例的磺酸基團限制在基底表面,無法進行水合作用傳導質子,導致輸水通道的進一步降低。因而,使用正丁醇作為Nafion的稀釋溶劑,有利于提高Nafion薄膜的質子電導率。
正丁醇溶劑可以有效的提高Nafion薄膜的質子電導率,但正丁醇分散體中較低的Nafion分子遷移率可能導致當正丁醇應用于催化層催化劑油墨的制備時,Pt/C催化劑顆粒難以在Nafion/正丁醇分散體中很好的分散,導致制備出的膜電極三相界面的不充分建立和較低的催化劑利用率,最終導致電池性能的下降。因此,盡管正丁醇有利于催化層Nafion薄膜的質子傳導行為,但可能導致催化劑利用率低的問題,在使用時需要綜合考慮。
4 結論
本文主要研究了不同的有機溶劑對Nafion膠束形態的影響,以及對Nafion成膜后結構以及質子電導率的影響,嘗試建立Nafion在溶液中的形態與Nafion成膜后的形態的聯系,進而探討通過改變溶劑的種類,改善超薄Nafion膜質子電導率的可能性。
以介電常數依次提高的正丁醇、異丙醇、正丙醇為研究對象,研究Nafion溶液的質量分數為0.5% (w)時,三種溶劑分散體系中Nafion膠束的沉降速率、流體力學直徑、主鏈和側鏈的遷移率,以及制備成40 nm薄膜后表面的接觸角、表面能和質子電導率的關系。
研究發現在質量分數相同時相較于正丙醇和異丙醇的溶劑體系,Nafion在正丁醇溶劑中有較大的流體力學直徑和較低的遷移率,因此可以更好的形成Nafion膠束,使制備成的Nafion薄膜在水合后形成更連貫的質子傳輸通道,提高薄膜的質子電導率。
- 物理化學學報的其它文章
- Seeding and Cross-Seeding Aggregations of Aβ40 and hIAPP in Solution and on Surface
- High-Performance Palladium-Based Catalyst Boosted by Thin-layered Carbon Nitride for Hydrogen Generation from Formic Acid
- Eu(III)在蒙脫石上的吸附及碳酸根和磷酸根對其吸附的影響
- 鋯合金初始氧化行為的原位近常壓XPS研究
- Methanol Synthesis by COx Hydrogenation over Cu/ZnO/Al2O3 Catalyst via Hydrotalcite-Like Precursors: the Role of CO in the Reactant Mixture
- 自交聯共軛亞油酸囊泡基熒光納米點的構筑及其熒光特性

