甘蔗線條花葉病毒P1蛋白基因原核表達及抗血清制備
徐小偉 陳雯 丁詩文 甘海鋒 張坤 賀振
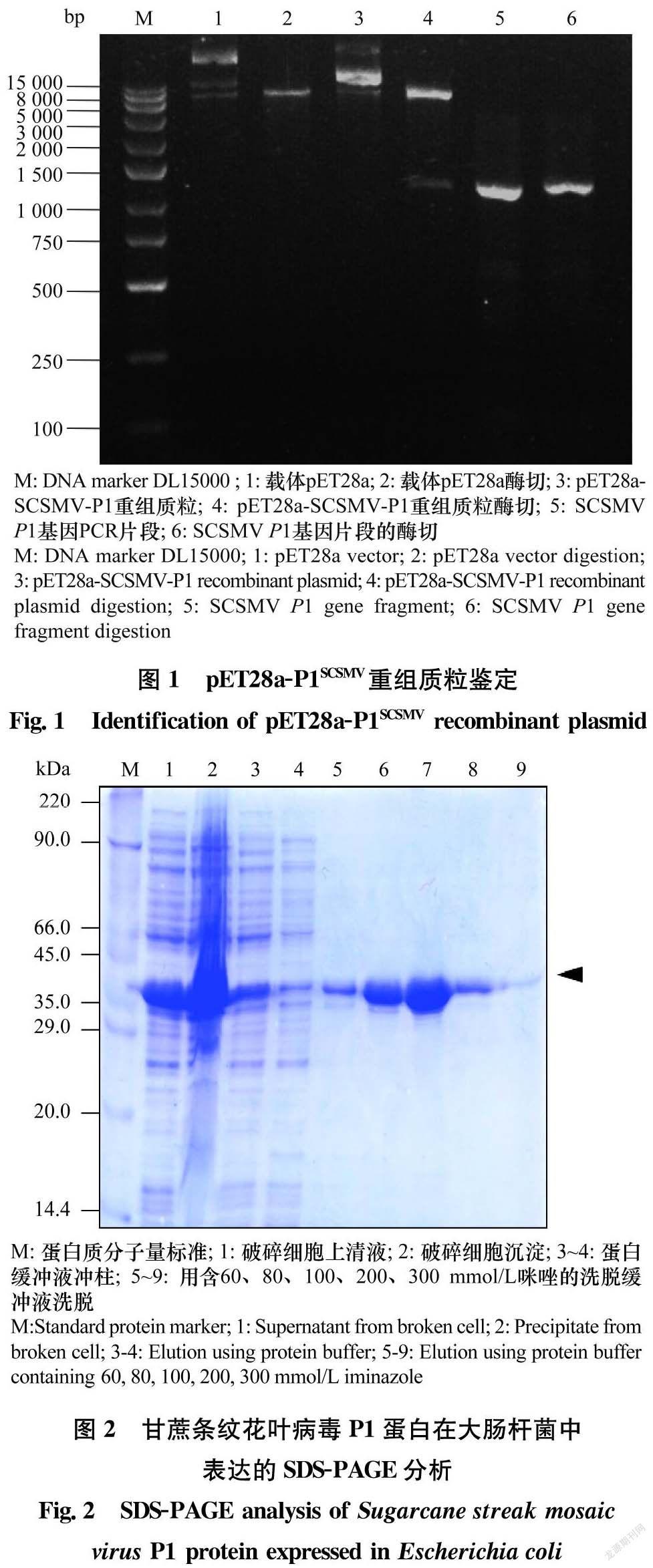


摘要 甘蔗線條花葉病毒Sugarcane streak mosaic virus(SCSMV)是引起甘蔗花葉病的主要病原之一,在世界各大蔗區普遍發生,嚴重威脅甘蔗產業的發展。建立快速有效的檢測方法對于SCSMV的防控有著重要意義。本研究依據SCSMV P1基因序列合成一對引物,擴增獲得1 074 bp的目的基因,將目的基因與原核表達載體pET28a連接,獲得pET28a-P1SCSMV。將連接正確的重組質粒轉化大腸桿菌Rosetta菌株,經IPTG誘導后,SDS-PAGE電泳檢測顯示在分子量約為42 kDa處有目的蛋白帶,與預期的SCSMV P1大小一致。融合蛋白主要是以可溶性蛋白的形式存在。利用鎳柱親和純化重組的SCSMV P1蛋白,并免疫健康新西蘭大白兔,制備兔抗血清。Western blot分析顯示,在對多個樣品進行檢測時制備的抗血清能特異性地識別SCSMV的P1蛋白,在受SCSMV侵染的甘蔗植株中能檢測到P1蛋白的表達,而在健康植株中檢測不到P1蛋白的表達。制備的抗血清稀釋至1∶20 000時仍能特異地檢測到目的蛋白條帶,說明通過大腸桿菌表達P1制備的SCSMV抗血清特異性強,效價高。本研究為SCSMV的快速檢測提供了有效方法。
關鍵詞 甘蔗線條花葉病毒; P1蛋白; 原核表達; 抗血清
中圖分類號: S435.661
文獻標識碼: A
DOI: 10.16688/j.zwbh.2021042
Abstract Sugarcane streak mosaic virus (SCSMV) is one of the main pathogens that cause sugarcane mosaic disease. It occurs in major sugarcane-growing regions around the world and seriously threatens the development of the sugarcane industry. The establishment of rapid and effective detection methods to prevent and control SCSMV is of great significance. In this study, a pair of primers were synthesized based on the SCSMV P1 gene sequence, and the target gene with a size of 1 074 bp was amplified. The target gene was connected with the prokaryotic expression vector pET28a to obtain pET28a-P1SCSMV. The correct recombinant plasmid was transformed into Escherichia coli Rosetta strain. After induction by IPTG, SDS-PAGE electrophoresis showed that there was a band of the target protein at a molecular weight of about 42 kDa, which was consistent with the expected size of SCSMV P1. Fusion protein mainly existed in the form of soluble protein. The recombinant SCSMV P1 protein was obtained by affinity purification with a Ni2+-NTA column and healthy New Zealand white rabbits was immunized with recombinant SCSMV P1 protein to prepare rabbit antiserum. Western blot analysis showed that the prepared antiserum could specifically recognize the SCSMV P1 protein when testing multiple samples. The expression of P1 protein could be detected in sugarcane plants infected by SCSMV, but not in healthy plants. When the prepared antiserum was diluted to 1∶20 000, the target protein band could still be detected specifically. This suggested that the SCSMV antiserum prepared by expressing P1 in E.coli had strong specificity and high titer, which provides favorable conditions for rapid detection of SCSMV.
Key words Sugarcane streak mosaic virus; P1 protein; prokaryotic expression; antiserum
甘蔗線條花葉病毒Sugarcane streak mosaic virus(SCSMV)屬于馬鈴薯Y病毒科Potyviridae禾草病毒屬Poacevirus,是引起甘蔗花葉病的主要病原之一[1]。SCSMV病毒于1978年由Gillaspie等在美國引自巴基斯坦的甘蔗種質上首次檢測到[2]。2008年-2011年,李世訪研究員團隊首次發現SCSMV在我國云南省甘蔗產區發生,后續調查發現SCSMV在云南省的主要甘蔗產區發生較為頻繁,并且在某些地區出現了流行趨勢,對中國甘蔗產業構成嚴重威脅[3]。……

