微小RNA在肺動脈高壓PASMCs表型轉化中的研究進展
張衛芳,徐 菲,2,陶澤穎,2,刁 倩,2,謝珊珊,李 娟,3,徐睿來
(1.南昌大學第二附屬醫院藥學部,江西 南昌 330006;2.南昌大學醫學院,江西 南昌 330031;3.南昌大學醫學院藥學部,江西 南昌 330031)
肺動脈高壓(pulmonary hypertension,PH)是動脈性肺動脈高壓(pulmonary arterial hypertension,PAH)、左心臟病變肺動脈高壓、肺疾病及血氧不足肺動脈高壓(hypoxic PH,HPH)、慢性栓塞或梗塞肺動脈高壓以及混合性肺動脈高壓的總稱[1]。主要病因是肺小動脈原發病變而導致肺動脈阻力增加,最終可導致患者右心衰竭而死亡。自1891年Romberg博士報告了第一例PH病例,至2011年估計全球被診斷PH的患者已多達1億。PH起病隱匿,無特異性臨床表現,除傳統的吸氧、強心、利尿、抗凝、擴血管(對于急性肺血管反應實驗陰性的患者效果不佳)的綜合治療外,臨床上近年來更多地開始使用靶向藥物,包括電壓門控L型鈣離子通道阻滯劑(如硝苯地平、氨氯地平)、5型磷酸二酯酶抑制劑(如西地那非、他達拉非、利奧西呱)、內皮素受體拮抗劑(如波生坦、安貝生坦、馬西替坦)和前列環素類似物(如依前列醇、伊洛前列素、曲前列環、賽樂西帕)等,同時也有一些新藥如Rho激酶抑制劑、受體酪氨酸激酶抑制劑等正在研究中。但是,目前臨床用藥只能調控血管功能,無法直接改善肺血管重構異常,無法逆轉PH進程,治療效果依然有限,患者的平均存活期僅有7年[2]。肺血管收縮、細胞增殖和血栓栓塞的形成被認為是PH發病機制的中心環節。業已證明,肺血管重構是所有PH的共同病理特征,主要表現為肺動脈內膜增生、中膜平滑肌細胞增生與肥大、外膜成纖維細胞增殖、細胞外基質增多、原位血栓、不同程度的炎癥以及叢狀動脈樣改變,從而導致肺動脈管壁增厚和管腔狹窄[1]。其中,肺動脈平滑肌細胞(pulmonary arterial smooth muscle cells,PASMCs)增殖/凋亡平衡破壞,以及表型轉化所致的PASMCs過度增殖是導致PH時肺血管重構的主要原因[1]。
微小RNA(microRNA,miRNA)是一類進化上高度保守的單鏈非編碼小分子RNA,長度約為18~22個核苷酸,主要通過結合靶信使RNA(messenger RNA,mRNA)的3′非翻譯區(3′-UTR)直接降解mRNA或抑制靶mRNA翻譯。miRNA與靶mRNA的結合方式有完全結合和不完全結合兩種方式[3],一般在植物體中通過完全互補結合,導致mRNA降解。在動物中主要通過不完全互補結合,這種結合方式一般不影響mRNA的穩定,但可影響其翻譯。據估計,miRNA可直接調控人類基因組中至少30%的基因,因此被認為參與幾乎所有的生理和病理過程,在胚胎發育、器官建成、組織形成等多種生理過程及癌癥發生、血管增生和炎癥發生等許多病理進程中發揮重要功能[3]。近年來,越來越多的學者發現,miRNA可通過調控PASMCs表型轉化,在PH的發生發展中發揮重要作用,有望成為預防和治療PH的潛在靶點。本文就調控PASMCs表型轉化的miRNA相關研究進展進行綜述。
1 PASMCs表型轉化
血管平滑肌細胞(vascular smooth muscle cells,vSMCs)的表型具有多樣性和可變性特點。在胚胎發育過程中,vSMC由未分化表型(合成型)逐漸分化具有成年特征的分化表型(收縮型)。當血管受到損傷或各種因子刺激時,vSMC又從收縮型轉化為合成型,表現為平滑肌標志基因表達下調,合成和分泌能力增強,重新獲得增殖和遷移能力,稱為表型轉化[4]。如Fig 1所示,一般來說收縮型比合成型體積更小,為拉長的紡錘形,含有豐富的肌絲,收縮能力強但DNA合成活性低,合成細胞外基質 (extracellular matrix,ECM)能力差,因此,收縮型vSMC增殖速度十分緩慢且不會發生遷移。合成型的vSMC呈菱形的單倍體樣,體積較大,肌絲含量極少,無收縮性但能大量合成ECM、膠原蛋白和骨橋蛋白,細胞增殖能力增強,同時可以發生遷移[4]。vSMC發生表型轉化時,SM-特異基因(如α-SMA、SM-MHC、SM22α、h1-calponin等)表達下調,而合成型標志基因(如TM4、SMEMB、OPN、MGP、TSP等)則表達上調。
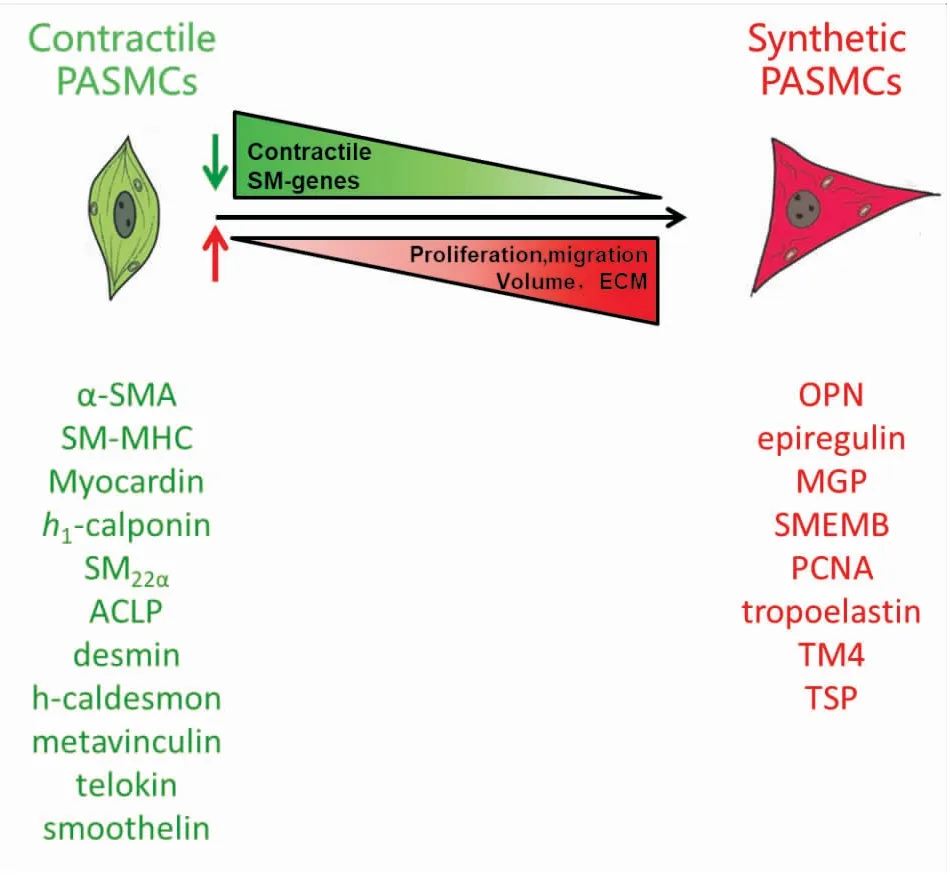
Fig 1 Schematic diagram of PASMCs phenotypic modulation
心肌素(myocardin,MYOCD)是迄今為止發現的最為關鍵的抑制vSMCs表型轉化的轉錄因子,其同家族成員還包括心肌素相關轉錄因子(myocardin-related transcription factors,MRTF)-A和MRTF-B。 MYOCD 和MRTF-A/B作為轉錄因子共激活因子,主要通過與血清反應因子(serum response factor,SRF)結合,形成MYOCD/MRTF-A/B-SRF三元復合物(ternary complex factors,TCFs),促進SM-特異蛋白基因轉錄。另一方面,Elk1、KLF-4或KLF-5等也可作為TCFs的共激活因子,與SRF結合則可促進生長因子基因轉錄[5]。筆者及其他學者研究均發現,PH時,生長因子或低氧可通過影響多個信號通路(包括miRNA),最終影響三元復合物的成分,調控PASMCs表型轉化[4](Fig 2)。目前已有報道一些miRNA可影響PASMCs表型轉化,這些miRNA的表達大多由于生長因子或低氧刺激而改變,我們將其分為生長因子相關miRNA和低氧相關miRNA。
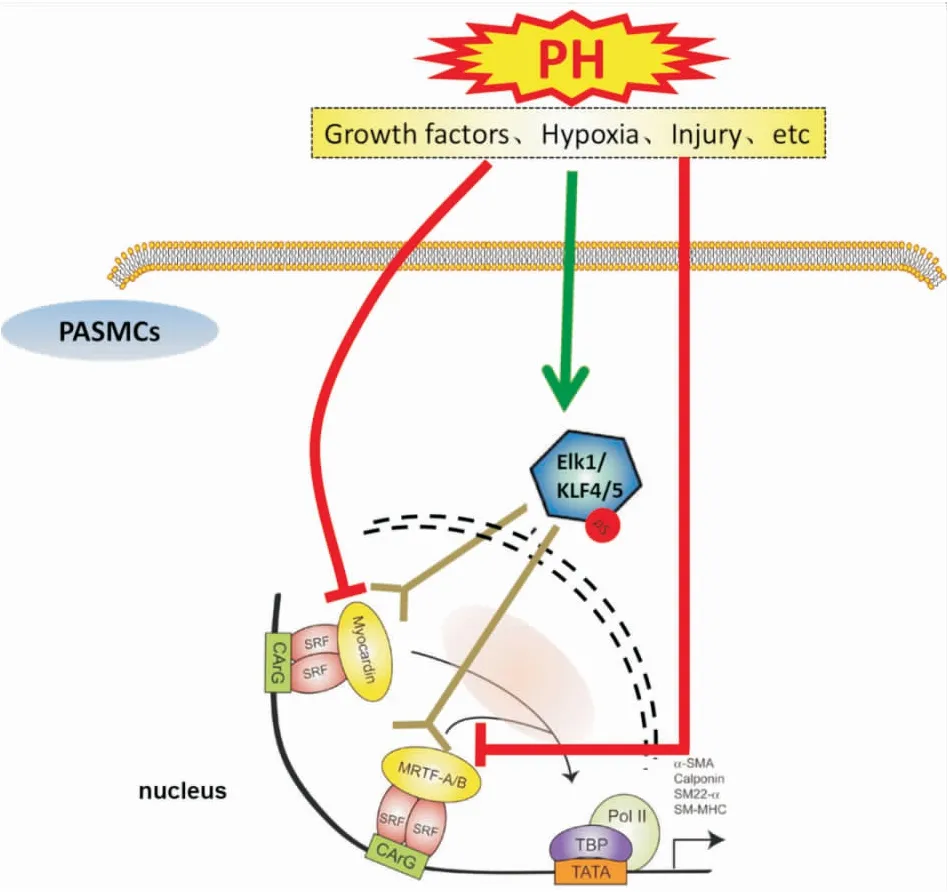
Fig 2 Signaling pathways of PASMCs phenotypic modulation
2 生長因子相關miRNA
血小板源性生長因子(platelet-derived growth factor,PDGF)是一類刺激細胞增殖的肽類生長因子,目前認為是促進vSMC表型轉化最強的生長因子。PH時,肺動脈內皮細胞(pulmonary arterial endothelial cells,PAECs)分泌的PDGF顯著增加。據報道,PDGF處理PASMCs可顯著上調miR-221[6],miR-24[7],miR-15b[8]等miRNA,并下調miR-21[9]表達水平,最終導致細胞表型轉化。普遍認為骨形成蛋白 (bone morphogenetic protein,BMP)信號可促進vSMC收縮表型,而BMP通路激活可顯著下調miR-96[10]的表達。PDGF調控miRNA表達變化的機制可能與拮抗BMP信號通路有關[9]。
2.1 促表型轉化生長因子相關miRNAmiR-221在多種腫瘤增生中呈現高表達,可通過調節血管生成、促進vSMCs表型轉化等過程導致動脈粥樣硬化時主動脈血管重構。在PH中,miR-221可通過下調靶基因c-Kit促進PASMCs表型轉化。已知c-kit在細胞內可通過與cArG盒基因結合促進SM-特異基因表達,使細胞保持收縮型[6]。miR-96在膀胱癌、乳腺癌等多種腫瘤增殖和遷移以及胚胎干細胞的多能性維持中發揮作用,此外,還可以通過靶向anillin(ANLN)降低心肌梗死后新生血管生成潛能,下調miR-96表達可以改善心臟內皮細胞生成潛能。肺動脈中,miR-96通過負向調控其靶點Tribbles-like protein 3(Trb3),從而導致Smad蛋白表達減少,進而促進PASMCs表型轉化[10]。Trb3表達的下調又可抑制BMP途徑,可能反過來上調miR-96,因此,在PASMCs中miR-96和Trb3之間可能存在負反饋調節。有趣的是,PDGF-BB刺激vSMC后,miR-96表達無顯著變化,因此,BMP對miR-96的調節機制是特異性的。miR-24廣泛參與急性心肌梗死后心肌細胞凋亡、心肌纖維化及心臟重構等病理進程。PDGF-BB處理誘導miR-24表達,miR-24同樣通過靶向Trb3后Smad蛋白表達減少以及TGFβ/BMP信號抑制,促進PASMCs的合成表型[7]。miR-15b的靶基因涉及細胞周期增殖(cyclin)、凋亡(Bcl-2)、侵襲和血管形成(NRP-2、VEGFR-2)等。PDGF刺激PASMCs僅4 h,miR-15b 表達量就變成了原來的兩倍[8]。既往研究發現,miR-15b可促進vSMC表型轉化,生理狀態下直接抑制miR-15b的表達可促進細胞合成α-SMA,vSMC保持收縮表型。該課題組進一步發現miR-15b還介導PASMCs表型轉化[8],但具體機制尚不清楚。
2.2 抑制表型轉化生長因子相關miRNA一直以來,miR-21在腫瘤、心血管及肺部疾病等方面的作用受到人們的重視,也是PH血管重構中研究的最多的一個miRNA。但miR-21在PH中不同研究的結果相互矛盾。有學者系統的研究了miR-21,發現無論是PH大鼠肺組織,還是IPAH患者的肺組織及血漿,miR-21表達均下調。在培養的PASMCs,PDGF可顯著下調miR-21表達[9,11]。BMP4刺激則可顯著上調miR-21的表達[9]。BMP4信號通路在維持PASMCs收縮表型中起著至關重要的作用。BMP受體基因的不表達或滅活突變可導致PASMCs發生表型轉化。Kang等[9]發現在PASMCs中,幾乎所有胞質分裂作用因子(dedicator of cytokinesis,DOCK)都為miR-21的靶點,BMP4上調miR-21后可通過抑制DOCK4、-5和-7,促使PASMCs維持收縮表型,抑制遷移。PDGF刺激則可通過miR-21/DOCK信號通路促進PASMCs表型轉化。已經發現miR-21可作為部分腫瘤的生物標記物,調節其功能也可以用作一種心臟保護策略,那么是否也參與了PH時右心衰竭,也值得我們進一步探討。
miR-132被認為在中樞神經系統和心血管系統的發育中發揮重要作用。在包括心肌肥厚、高血壓、動脈粥樣硬化等多種心血管疾病中表達上調。2019年,有學者發現[12],miR-132在野百合堿誘導的PAH大鼠和PDGF誘導的PASMCs中表達也上調,并可通過靶向磷酸酯酶與張力蛋白同源物(phosphatase and tensin homologues,PTEN)抑制PASMCs增殖,維持PASMCs收縮表型,同時促進細胞遷移。在PH中,miR-132的促遷移作用有助于叢狀病變的形成,但它在體內的抗增殖和分化作用似乎與體外研究結果相矛盾。可能是因為PASMCs的增殖是由其他關鍵因素誘導的,也可能是因為miR-132的分化作用可能促進SMC和SMC樣細胞的形成。而抑制miR-132能否預防和逆轉PAH的進展仍需進一步研究。
miR-182在腫瘤性疾病、神經系統和免疫系統疾病、心血管疾病中都有重要作用。大多證據支持miR-182在細胞增殖、血管生成和侵襲及癌癥遠處轉移中發揮促進作用,在癌癥臨床診斷、病情評估、治療和預測癌癥預后中具有應用潛力。有報道miR-182在大鼠主動脈平滑肌細胞中有抑制表型轉化的作用,同時還參與調節神經細胞表型轉化。最近,哈爾濱醫科大學徐教授團隊[13]在離體PASMCs實驗中發現miR-182還可通過靶向成纖維生長因子9(fibroblast growth factor 9,FGF9),抑制PASMCs表型轉化,但無論從網絡生物信息學分析還是在體實驗,尚未直接證明miR-182在PH血管重構中的作用。
3 低氧相關miRNA
缺氧導致miRNA表達變化的機制可通過低氧誘導因子-1(hypoxia inducible factors-1,HIF-1)依賴途徑和HIF-1非依賴途徑介導。據報道低氧誘導PASMCs表型轉化的同時,miR-23a[14]、miR-9[15]、miR-214[16]、miR-20a[17]表達均上調,而miR-449[18]、miR-206[19]、miR-124[20]、miR-30c[21]和miR-140[22-23]表達均下調。
3.1 促表型轉化低氧相關miRNAHIF-1是調節氧穩態的重要介質,是在低氧狀態下能夠發揮活性的核轉錄因子。HIF-1由α和β兩個亞基組成,HIF-1α亞基被稱為HIF-1的活性亞基,是它所特有的。HIF-1的生理活性主要取決于α亞基的功能和表達。許多研究證實,HIF-1在多種類型PH,尤其是HPH時表達顯著上調并發揮了重要作用[15]。缺氧開始時,HIF水平的升高可啟動100多個基因的轉錄,這些基因影響和調節多種肺血管功能,如活性氧生成/氧化應激、血管生成、血管細胞遷移、代謝、增殖、生存和表型轉化。其中,HIF-1α可上調miR-23a[14]和miR-9[15]的水平促進PASMCs表型轉化。miR-23a參與多種癌癥發展,并促進心臟肥大和拮抗肌肉萎縮,但miR-23a抑制SM-特異蛋白表達的下游作用靶點目前還未發現。miR-9隨細胞類型特異性發揮促進或拮抗增殖的作用,并可靶向人類ACAT1基因,減少巨噬細胞泡沫細胞形成,參與動脈粥樣硬化過程的調節,MYOCD是miR-9的直接下游靶點,miR-9抑制MYOCD后可直接抑制SM-特異蛋白的基因轉錄[15]。
同miR-9類似,在HPH時,miR-214[16]和miR-20a[17]均表達上調,miR-214參與多種癌癥進程,并是肝、腎、心肌等纖維化的重要調節劑,在心肌肥厚或衰竭心臟中發揮促肥厚調節性作用。miR-20a的表達失調參與多種癌癥發展,并可能通過靶向調控CNN1影響血管內皮生長因子活性和遷移以及VEGF的表達,影響動脈粥樣硬化斑塊的形成和發展。兩者通過負向調控MYCOD信號通路促進PASMCs表型轉化,但它們的調控MYCOD的機制各不相同。miR-214通過抑制直接下游靶點MEF2C直接抑制MYCOD-LMOD1信號通路,而miR-20a則是通過靶向結合PKG1,促使Elk-1活化,競爭MYOCD與SRF結合位點,最終導致MYOCD-SRF復合物解離,SM-特異基因表達程序中止。
3.2 抑制表型轉化低氧相關miRNAmiR-449[18]、miR-206[19]、miR-124[20]、miR-30c[21]和miR-140[22-23]在低氧誘導的PH動物模型的肺血管或PASMCs細胞模型中均表達下調,且通過各自靶點可抑制PASMCs表型轉化。
miR-449簇位于癌癥易感位點,通過作用多種信號因子(包括Notch通路、VEGF、p53等)抑制腫瘤的生長、入侵和轉移,并促進細胞凋亡和分化。有學者對HPH大鼠肺血管進行了全基因組miRNA測序分析,發現miR-449下調[18]。 miR-449抑制PSAMCs表型轉化的作用通過直接靶向調控c-Myc,促使SM-特異蛋白(SM-22α、myosin和calponin)表達來介導[18]。此外,miR-449通過靶點c-Myc調控PASMCs線粒體功能[18]。
miR-206在胃癌、乳腺癌、肝癌、肺癌等組織中異常表達,是許多癌癥的轉移抑制因子,同時研究發現,miR-206通過靶向Notch3基因來調控骨骼肌細胞的增殖和細胞周期阻滯。小鼠低氧6周后分離PASMCs進行miRNA檢測,發現miR-206表達顯著下降,給予miR-206可顯著通過抑制Notch3通路提高PASMCs中SM-特異蛋白(α-SMA、calponin)的表達[19]。
miR-124是大腦中一種豐富的miRNA,在正常組織中呈現高表達,而在許多癌癥中(如結直腸癌、乳腺癌、胃癌、胰腺癌等)表達下調。在帕金森病、亨廷頓舞蹈癥、缺血性中風和PH等疾病中,miR-124表達水平也下調。在體上調miR-124可以延緩上述疾病進程。活化T細胞核因子(nuclear factor of activated T cells,NFAT)信號通路為miR-124的直接下游靶點,而每個NFAT成員(NFATc1、NFATc2和NFATc3)的過度表達導致α-SMA顯著減少,表明miR-124可通過調控靶點NFAT抑制PASMCs表型轉化[20]。
miR-30c在人類多種腫瘤組織中呈低表達,是前列腺癌、乳腺癌及膀胱癌等的潛在生物標志物,提示miR-30c在診斷和治療方面有開發前景。低氧刺激PASMCs可顯著下調miR-30c的表達。進一步研究其機制發現,miR-30c可直接結合到PDGFRβmRNA的3′-UTR來減少PDGFRβ表達,并發揮抑制PASMCs表型轉化的作用。有趣的是,miR-30c介導PDGFR的表達變化只發生在低氧,而不是在PDGF刺激的細胞中[21]。此外,miR-30c還可通過靶向XBP1、TGF-β1、CTGF等影響心肌凋亡、氧化應激和炎癥,參與心室重塑,那是否也可參與PH時右心室重塑呢?
miR-140被發現在乳腺癌、非小細胞肺癌以及骨關節炎等疾病中發揮重要作用,也可作為冠心病發生的預測因子。有研究發現miR-140在先天性PH[22]和PAH患者[23]肺組織中表達顯著下調。先天性PH患者中,肺動脈壓力越高的患者miR-140表達量越低[22]。使用脂質體將miR-140送入肺部治療的PH大鼠血流動力學指標降低、肺血管重構降低[24],進一步研究發現miR-140靶點為Smurf11,根據這一靶點研制的選擇性Smurf11抑制劑可能是PH的新療法。體外對PASMCs低氧也可顯著下調miR-140的水平。上調miR-140可增加SM-特異蛋白,如α-SMA、SM22和calponin表達顯著增加,表明miR-140是維持PASMCs表型所必需的miRNA。已知Wnt-1和Dnmt1均為miR-140直接靶點,Wnt-1介導了缺氧誘導的PASMCs增殖遷移,并且可以抑制SM-特異蛋白的表達。Dnmt1也可通過抑制SOD2促進低氧誘導的PASMCs表型轉化[23]。PH時,miR-140下調介導的PASMCs表型轉化可能與這兩個靶點有關。
miR-17~92簇包含miR-19a/b和miR-17/20a,miR-17~92在IPAH和其他類型的PAH患者的PASMCs中均下調[25]。miR-17~92在HPH小鼠早期表達上調,但在晚期表達則下調[25]。通過平滑肌特異性敲除miR-17~92可顯著改善小鼠HPH進程,降低肺動脈壓力,在這些小鼠額外給予重組miR-17~92后則抵消了敲除的改善效果。有趣的是,體外結果發現,miR-17~92具有同時促進PASMCs增殖和分化兩種功能。其調控PASMCs表型轉化的機制與myocardin通路無關,但依賴TGF-β信號,但額外給予正常小鼠miR-17~92卻不足以誘發小鼠發生PH。提示PASMCs中的miR-17~92是PH病理發生發展過程中一個重要的參與者,但不是絕對控制者。已證實miR-17~92的直接下游靶點有纖溶酶原激活物抑制物1(PAI-1)、PDLIM5(PDZ and LIM domain 5)和PHD2(prolyl hydroxylases 2)。其中,miR-19a/b可通過抑制PAI-1后激活TGF-β/Smad2/calponin信號通路,進而促進SM-特異蛋白表達增加[25]。而miR-17/20a則可通過抑制PDLIM5激活TGF-β3/Smad3信號通路促進SM-特異蛋白表達增加[25]。此外,miR-17/20a還可通過調控PDLIM5間接抑制PAI-1。體內外研究相矛盾的結果提示,miR-17~92促進PH病理生理進程主要是通過除表型轉化以外的其他機制,如PAECs和PASMCs增殖[25]來實現的。miR-17-92在PH進展中的確切作用有待進一步研究。
miR-let-7在心血管系統中表達豐富,在許多心血管疾病如心肌肥大、心肌纖維化、心肌梗死、血管生成、動脈粥樣硬化以及高血壓中表達異常,我們團隊運用miRNAs網絡藥理學發現let-7家族同時參與了TGF-β/ BMP、低氧和炎癥3個功能通路[26],還發現let-7g在低氧PH大鼠中表達下調,它可以通過靶向c-Myc抑制低氧誘導的PASMCs增殖[27],而miR-449正是以c-Myc為靶點,促進SM特異性蛋白的表達,抑制PASMCs的表型轉化[18],let-7g是否也可以通過靶向c-Myc抑制PASMCs的表型轉化,值得探究。另外,我們進一步還發現let-7g在PH時可負向調控靶點LOX-1[28],LOX-1又可通過ERK1/2-Elk-1/MRTF-A-SRF信號通路促進PASMCs表型轉化[4]。不僅如此,眾所周知,MAPK通路激活后,TCFs被激活,TCFs可通過重塑含CArG box啟動子的染色質、分離SRF和降低肌鈣蛋白表達來促進vSMCs發生表型轉化。我們團隊通過生物信息學預測發現let-7g可與MEKK1靶向結合,從而調控MAPK通路。基于以上發現我們推測,let-7g很可能也具有抑制PASMCs表型轉化的作用,而這也是我們未來的研究方向。
4 總結與展望
PH是一種進行性疾病,預后差且無有效的治療手段。全球學者一直致力于探討其發病機制,為PH的防治提供新的靶點。近十幾年來國際上對miRNA的研究突飛猛進,miRNA的發現開辟了疾病發生發展機制研究的新領域。目前對miRNA的研究仍多聚焦在腫瘤領域,發現許多miRNA可以作為腫瘤的生物標志物,參與腫瘤的診斷、治療和預后評估。近年來逐漸發現,miRNA參與體內許多病理生理過程,近期研究表明miRNA與PH的關系非常密切[3],并根據信號通路將其分為生長因子相關miRNA、炎癥相關miRNA和低氧相關miRNA[29]。研究PH相關miRNA有重大意義,增強對PH相關miRNA的研究有助于闡明發病機制、研發更有效的靶向藥物以及輔助早期診斷。
同其他的領域相比,miRNA在PH發生發展這一領域的研究相對滯后,發現的miRNA相對較少,且miRNA對PAECs和PASMCs離子通道影響的研究幾乎是空白。但是,這對我們來說,也是一個難得的機遇。目前臨床治療中主要應用的藥物僅能減輕癥狀,無法逆轉疾病進程、直接改善重構異常。因此,研發新的藥物迫在眉睫。由于miRNA分子結構簡單,分子量小,易于合成和修飾等特點,必將成為新一代治療PH的分子藥物。本文綜述了miRNA通過調控表型轉化在PH肺血管重構中的作用,并歸納了潛在的作用靶點(Tab 1),有望以PASMCs表型轉化為中心,為研究者揭示miRNA在PH發生發展中的全新作用。一些動物實驗已經證明,一些靶向調控miRNA的藥物可以延緩甚至逆轉PH進程,如在野百合堿誘導的大鼠PAH模型中,氣道霧化miR-140-5p模擬物或miR-223模擬物可改善PAH。但是如何讓miRNA精準進入肺組織的同時避免進入其他組織產生不良反應,以及如何在細胞中保持穩定性,還需要進一步研究。同時,miRNA在體內作用復雜,可能有多個靶點,相互構成網絡,影響目標miRNA是否會帶來其他影響還需要仔細驗證,從這個角度講,一些對其他器官影響較小而在PH中作用效果明顯的miRNA或許更有研究價值。此外,對于只在細胞層面探究了對PASMCs表型轉化的影響的miRNA(如miR-15b、miR-182),還需要進一步通過動物實驗確證其在PH中的變化及對血管重構的影響。
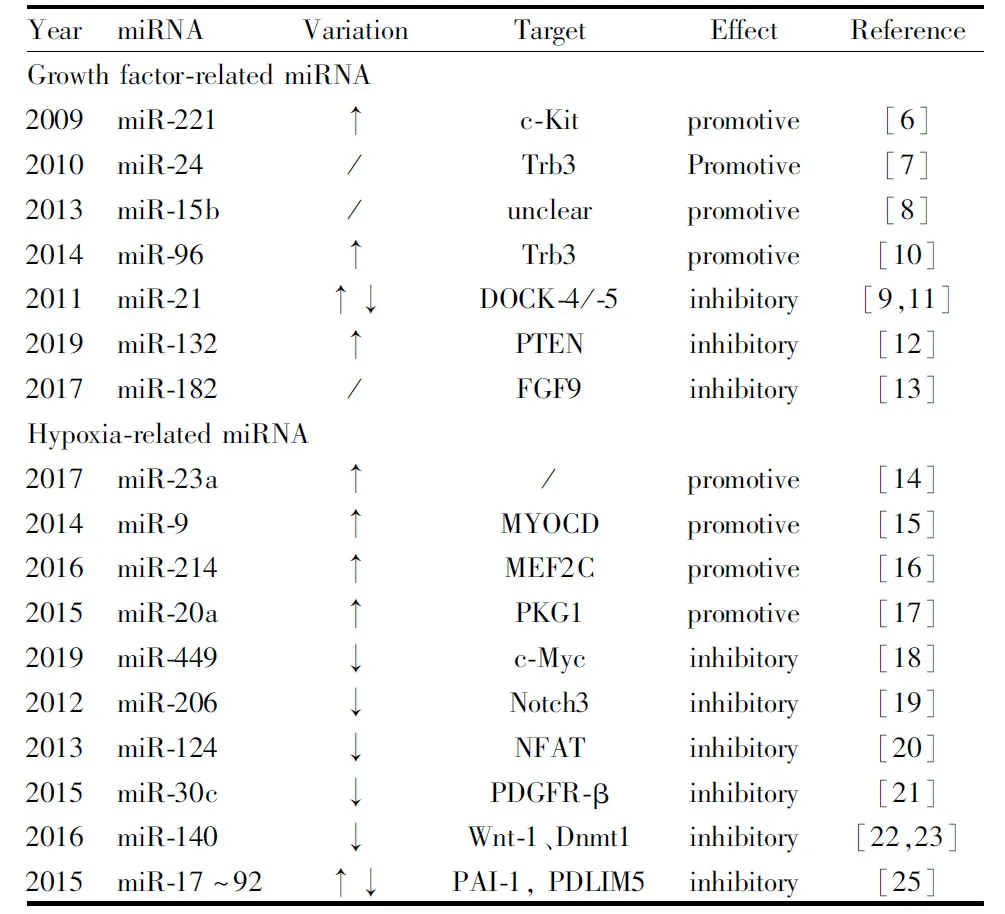
Tab 1 miRNA influencing PASMCs phenotypic switching
目前,PH臨床診斷中沒有明確的生物標志物,而最近的報道表明,細胞外miRNA與蛋白質復合物結合,因此,它們在循環中不容易被RNase降解,表達穩定且豐富,可作為PH診斷或早期檢測的潛在生物標志物。但也要注意,有些特異性不高的miRNA并不適合作為生物標志物。如miR-21已被超過29種疾病稱為特定的預測或預后生物標志物[30],因此,miR-21的變化不能很好的指示PH疾病診斷及進程。尋找與PH疾病相關且特異的miRNA也是未來我們需要努力的方向。