響應面優化酵母發酵法提取香菇多糖飼料添加劑工藝研究
賀 瑩, 王雪菲
(呂梁學院生命科學系,山西呂梁 033000)
香菇,也被稱為花菇、冬菇、香菌等,其兼具食用和藥用功能,是含有豐富營養的真菌(蔣敏等,2018)。研究表明,香菇多糖具有提高免疫力、降血糖血脂、抗輻射、抗病毒和抗氧化等廣泛的醫療保健功效,不僅對動物的疾病防治有重要作用,而且可以促進動物生長,提高飼料報酬,是一種天然綠色飼料添加劑(王秀文等,2021;雷莉輝,2017)。
酵母發酵法屬于較為新型的生物提取方法,提取過程中主要用到酵母菌、酶等。香菇中所含有的氨基酸等部分有機物可作為發酵過程中酵母菌生長所需的養料, 在其生長過程中消耗了發酵原料中多余的有機物, 目標產物多糖的含量并不會減少,導致產物粗多糖中雜質的含量降低,能夠提升產物多糖分離效率, 有利于原料的利用 (戚愛華,2018;萬茜淋等,2018)。目前,與其他傳統提取工藝相比,酵母發酵法提取香菇多糖還鮮見報道,因此,本試驗選取香菇多糖為評價指標,通過響應面試驗優化提取工藝條件, 以期為畜禽生產上香菇多糖飼料添加劑提取研究提供參考 (湯強等,2020;鄯來平,2018)。
1 材料與方法
1.1 材料與試劑 香菇: 購買于呂梁農貿市場;無水葡萄糖(分析純):天津市凱通化學試劑有限公司;無蒽酮(分析純):上海化學試劑采購供應五聯化工廠;蔗糖(分析純):天津市福晨化學試劑廠;纖維素酶(生化試劑):浙江仁和生物科技有限公司;中性蛋白酶(生化試劑):南京都萊生物技術有限公司。
1.2 儀器與設備 UV-1601 紫外可見分光光度計:北京瑞利分析儀器有限公司;L550 型臺式低速大容量離心機: 湖南湘儀實驗室儀器開發有限公司;SPX-250 生化培養箱: 上海躍進醫療器械有限公司;RE-5298 旋轉蒸發儀:上海亞榮生化儀器廠。
1.3 試驗方法
1.3.1 酵母菌的活化 稱取酵母粉5 g, 置于錐形瓶,向其中加入25 mL 蒸餾水,漩渦混合均勻,酵母粉于水中溶解均勻后,加入一定體積的濃度為5%的蔗糖溶液,再次振蕩混勻后,置于150 r/min、30 ℃的條件下恒溫振蕩培養30 min(付麗娜等,2019)。
1.3.2 香菇多糖的提取及含量測定 將香菇置于恒溫干燥箱中進行干燥, 烘干完成后用高速粉碎機進行粉碎,過40 目篩制得香菇粉。 取4 g 粉末于錐形瓶中,加入48 mL 蒸餾水,材料與液體的比例為1:12, 再向其中分別加入纖維素酶和中性蛋白酶0.02 g,混合均勻,于30 ℃環境中恒溫存放8 h,對香菇原料進行酶解,隨即在高溫下對兩種酶進行滅活,將滅活后的混合液冷卻至室溫。向混合液中添加一定量已活化的酵母液,置于30 ℃條件下進行恒溫發酵16 h,發酵完成后,進行抽濾,用旋轉蒸發儀將濾液進行濃縮,向其中加入適量的無水乙醇,使乙醇濃度最終達到85%。醇沉后離心,收集沉淀物,再次真空干燥最終制得香菇粗多糖(聶小寶,2012;涂明鋒等,2018)。 采用蒽酮-硫酸法測定香菇多糖溶液在265 nm 處的吸光度,將其代入葡萄糖標準曲線方程:Y=10.517X+0.0321 R2=0.9969,計算出香菇多糖的量,并根據公式:香菇多糖得率/%=(香菇粗多糖中多糖量/香菇的干重)×100,計算出香菇多糖得率。
1.3.3 香菇多糖提取工藝優化單因素試驗
1.3.3.1 蔗糖添加量對香菇多糖得率的影響 設置蔗糖添加量為 3.0、6.0、9.0、12.0、15.0 mg/mL 五個因素水平。 采用酵母添加量0.75 mg/mL,設置發酵液 pH 為 6, 在 30 ℃環境中進行 16 h 的發酵,在此條件下對香菇多糖進行提取,探究不同蔗糖添加量對香菇多糖得率的影響 (勞超等,2017;牛天增,2016)。
1.3.3.2 發酵液pH 對香菇多糖得率的影響 設置發酵液 pH 為 4、5、6、7、8 五個因素水平。 采用酵母添加量0.75 mg/mL,蔗糖添加量9.0 mg/mL,在30 ℃環境中進行16 h 的發酵, 在此條件下對香菇多糖進行提取, 探究不同發酵液pH 對香菇多糖得率的影響(陳文寧等,2021;李鑫,2018)。
1.3.3.3 酵母添加量對香菇多糖得率的影響 設置酵母添加量為 0.25、0.50、0.75、1.00、1.25 mg/mL五個因素水平。 采用蔗糖添加量9.0 mg/mL,設置發酵液 pH 為 6, 在 30 ℃環境中進行 16 h 的發酵,在此條件下對香菇多糖進行提取,探究不同酵母添加量對香菇多糖得率的影響 (王振吉等,2019;郭毓菲,2018)。
1.3.4 響應面分析法優化多糖提取工藝設計 從蔗糖添加量、發酵液pH 和酵母添加量三個因素對酵母發酵法提取香菇多糖工藝的影響進行研究。針對各因素對香菇多糖得率不同程度的影響,進行單因素試驗, 最終結果采用Design Expert 軟件進行試驗設計, 并分析得出最優提取工藝 (沈曉麗,2008;張潔媛等,2018),因素水平設置見表1。
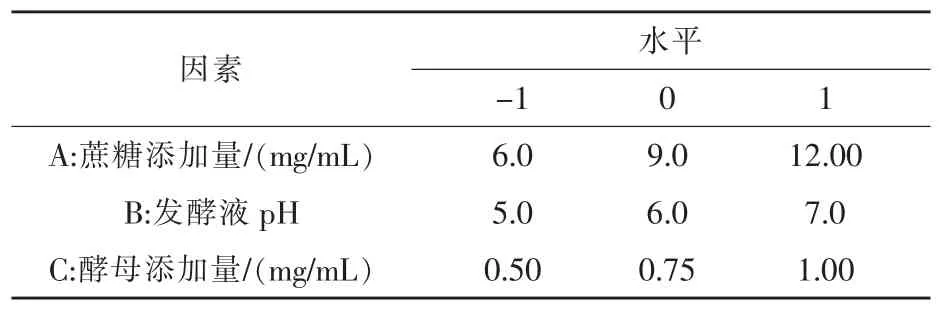
表1 試驗因素水平及編碼
1.4 數據處理 每組試驗樣品平行做三次,數據使用origin 9.0 作出折線圖, 采用Design-Expert 8.0.6.1 進行響應面試驗數據處理 (李順峰,2020;趙詩雨等,2020)。
2 結果與分析
2.1 酵母發酵法提取香菇多糖的單因素分析
2.1.1 蔗糖添加量對香菇多糖得率的影響 由圖1 可知, 香菇多糖的得率隨著蔗糖添加量的增加而增加,在蔗糖添加量為9.0 mg/mL 時,曲線產生最高點,表明此時香菇多糖的提取率達到最大,繼續添加蔗糖,其得率反而下降。 由此可得出香菇多糖提取最佳蔗糖添加量為9.0 mg/mL。
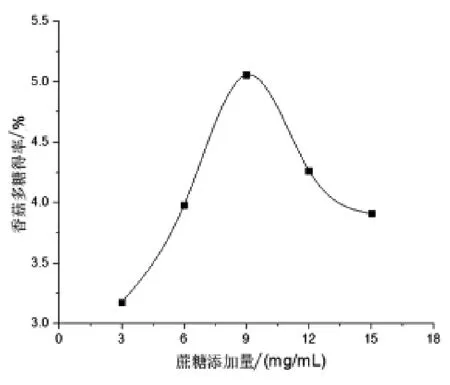
圖1 蔗糖添加量對香菇多糖得率的影響
2.1.2 發酵液pH 對香菇多糖得率的影響 由圖2 可知,香菇多糖的得率隨著發酵液pH 的增加而增加,在發酵液pH 為6 時取得最高點,此時香菇多糖的提取率達到最大, 隨著發酵液pH 的繼續升高,其得率反而下降。由此可得出香菇多糖提取最佳發酵液pH 為6。
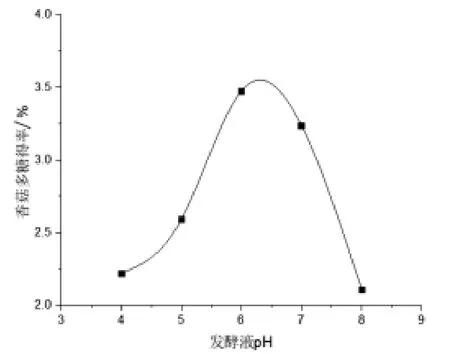
圖2 發酵液pH 對香菇多糖得率的影響
2.1.3 酵母添加量對香菇多糖得率的影響 由圖3 可知, 香菇多糖的得率隨著酵母添加量的增加先增加,在酵母添加量為0.75 mg/mL 時取得最高點,此時香菇多糖的提取率達到最大,繼續添加酵母其得率反而下降。 由此可得出香菇多糖提取最佳酵母添加量為0.75 mg/mL。
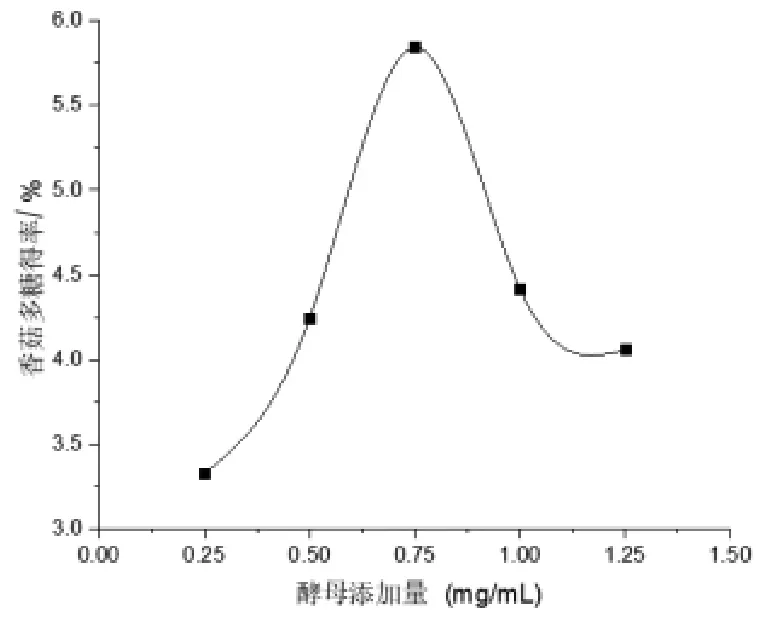
圖3 酵母添加量對香菇多糖得率的影響
2.2 響應面分析法優化香菇多糖提取工藝 響應面試驗設計及結果見表2。
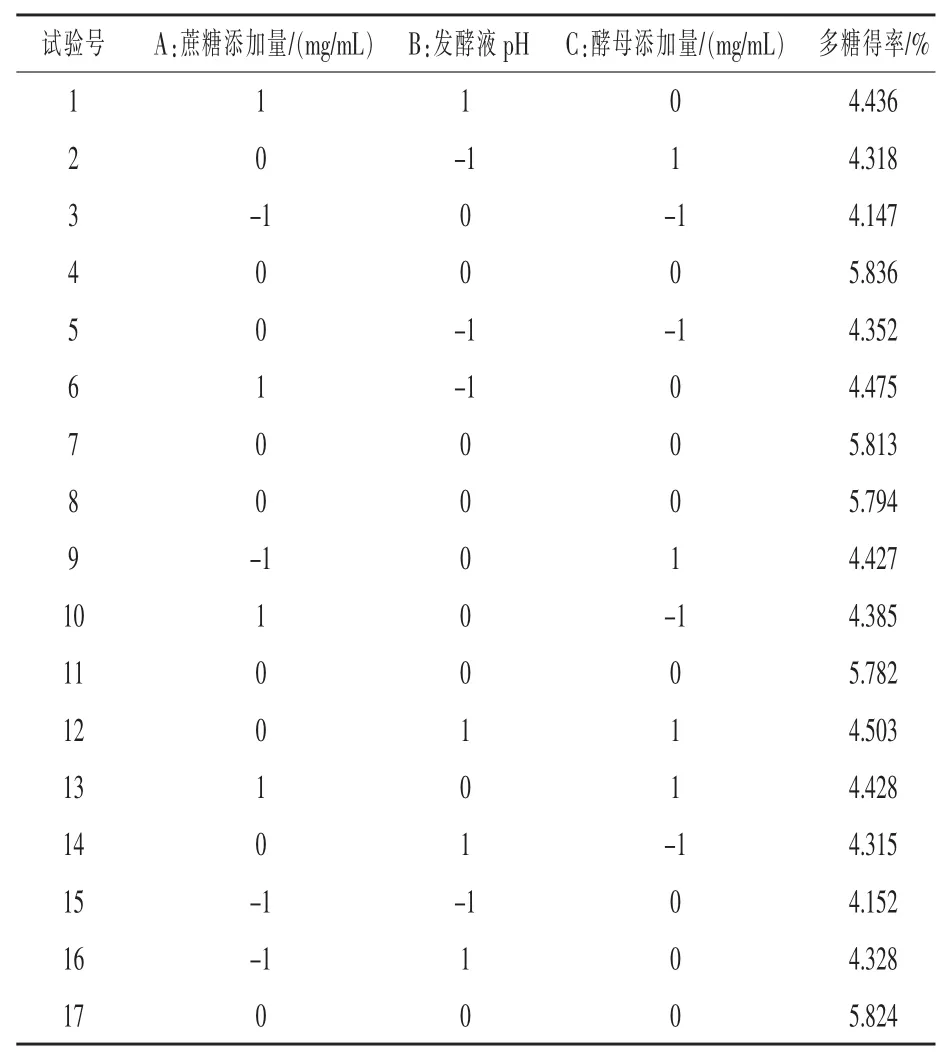
表2 響應面試驗設計及結果
2.2.1 提取條件優化分析 運用Design Expert軟件得出二次回歸方程: 香菇多糖得率=5.81+0.084A +0.036B +0.060C -0 .054AB -0.059AC +0.056BC-0.74A2-0.72B2-0.72C2。
回歸模型顯著性檢驗及方差分析見表3。 由表 3 可知,A、C、A2、B2、C2的 “Pr>F” 值均小于0.01, 故對香菇多糖提取率都有極顯著影響,B、AB、AC、BC 的“Pr>F”值均小于 0.05,對香菇粗多糖得率有顯著的影響,各因素之間交互作用較好。模型的“Pr>F”值小于 0.0001,且失擬檢驗“Pr>F”值大于0.05,不顯著,由此說明該回歸方程模型擬合程度較好,試驗誤差小。
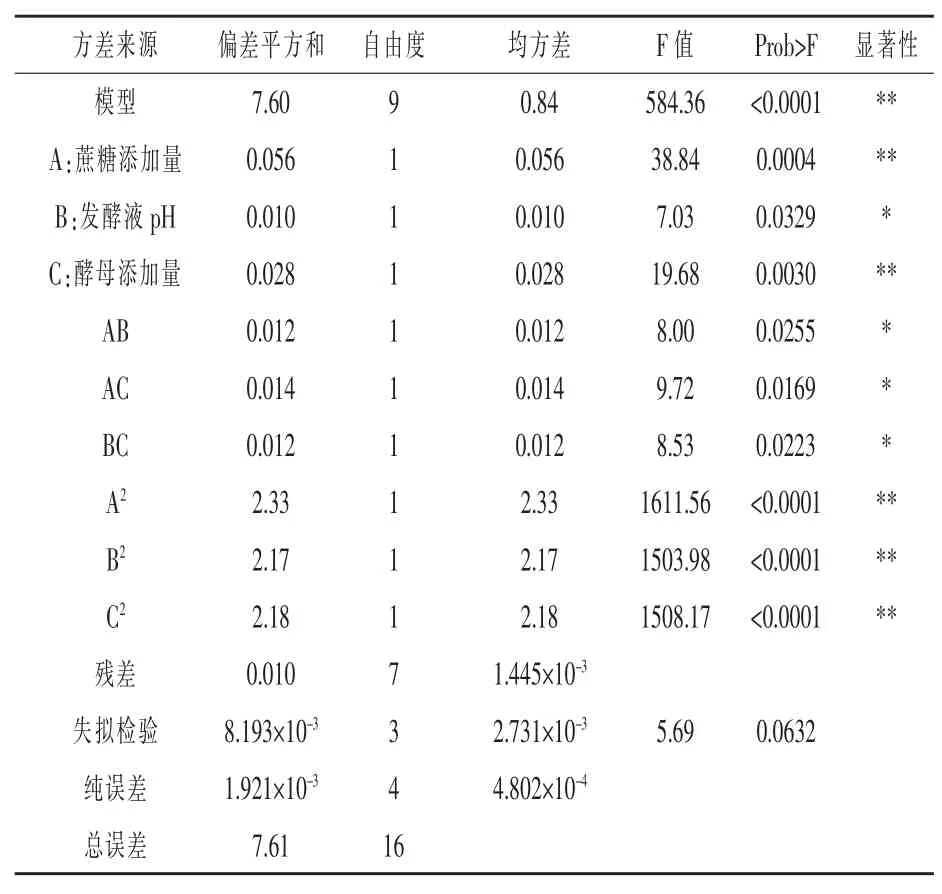
表3 回歸模擬性顯著性檢驗及方差分析
2.2.2 響應面分析 由圖4 可知, 隨著蔗糖添加量、發酵液pH 的升高,香菇多糖提取量呈現逐漸升高后降低的趨勢。 由圖5 可知, 隨著蔗糖添加量、酵母添加量的增加,香菇多糖提取量呈現逐漸升高再降低的趨勢。 由圖6 可知,隨著發酵液pH、酵母添加量的升高, 香菇多糖提取量呈現逐漸升高再降低的趨勢。隨著蔗糖添加量、酵母添加量增加,響應曲面越陡峭,表明蔗糖添加量、酵母添加量因素作用對香菇多糖的提取影響較大。從圖4 ~圖6 可知,每組等高線近似橢圓,可以得出各組兩個交互因素的相互作用對多糖得率的影響較大,蔗糖添加量與酵母添加量交互作用、 發酵液pH與酵母添加量交互作用及蔗糖添加量與發酵液pH 交互作用強。
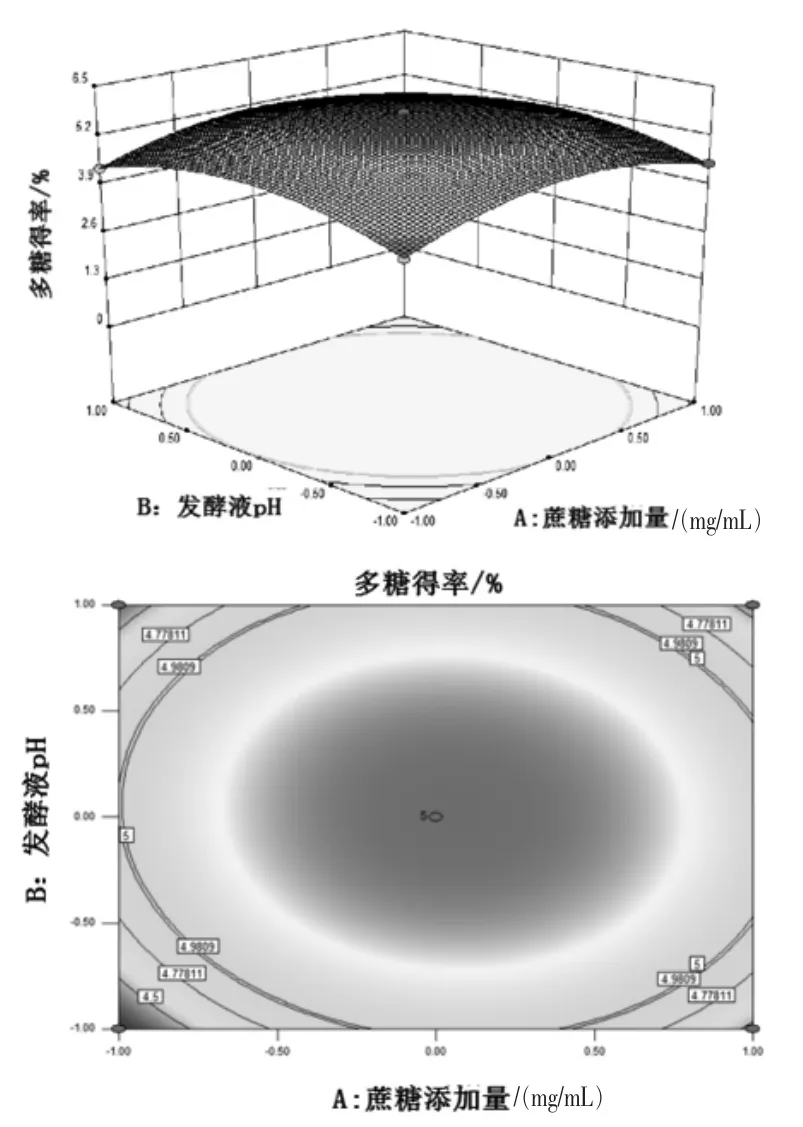
圖4 蔗糖添加量與發酵液pH交互作用的響應面與等高線
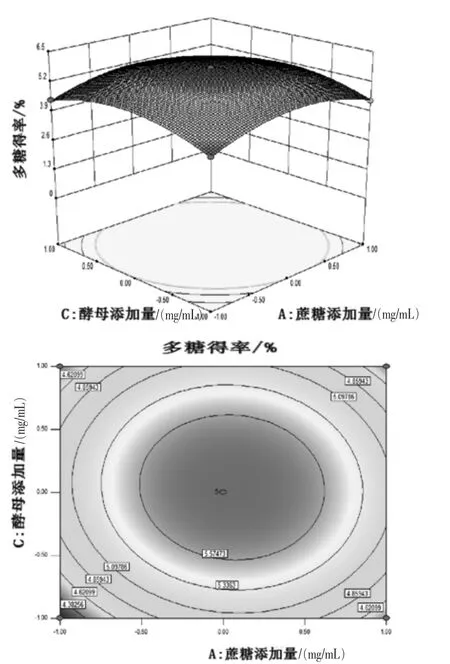
圖5 蔗糖添加量與酵母添加量交互作用的響應面與等高線

圖6 發酵液pH 與酵母添加量交互作用的響應面與等高線
2.3 最佳工藝條件的確定及驗證試驗 經過Designer Expert 軟件的數據分析,可以得出酵母發酵法提取香菇多糖的最佳工藝條件為: 蔗糖添加量9.16 mg/mL,發酵液pH 6.02,酵母添加量0.76 mg/mL。在此最優條件下香菇多糖理論得率為5.814%。對以上最優條件進行驗證試驗, 在上述條件下進行三次香菇多糖的提取, 多糖得率依次是5.791%、5.837%、5.783%, 計算得出三次提取結果的平均多糖提取率為5.804%, 與理論值的誤差較小,相差0.010%。 因此表明,響應面法分析得到的此最優工藝較為可靠。
3 結論
利用響應面分析法優化香菇多糖的提取工藝,結果表明,酵母發酵法提取香菇多糖的最優工藝為:蔗糖添加量9.16 mg/mL,發酵液pH 6.02,酵母添加量0.76 mg/mL, 在此條件下香菇多糖理論得率為5.814%。 通過試驗驗證, 香菇多糖得率為5.804%,與軟件給出的理論值相近,表明模型擬合度良好,該工藝條件具有一定的參考性與可行性,可為后續飼料添加劑的開發和利用提供一定理論基礎,具有很大的發展前景。

