肝細胞腺瘤常規超聲及超聲造影特征分析:單中心回顧性研究
陳凱玲 朱宇莉 董 怡 李翠仙 包靜文 汪瀚滔 王文平△
(1復旦大學附屬中山醫院超聲科 上海 200032;2上海市影像醫學研究所 上海 200032)
肝細胞腺瘤(hepatocellular adenoma,HCA)是罕見的肝臟良性上皮腫瘤[1]。HCA的確切發病率及致病因素尚不明確,已有研究表明其在亞洲人群的發病率低于西方國家,并與雌激素攝入、糖原累積癥、代謝綜合征、肝血管疾病等存在一定的相關性[2-5]。HCA具有高度異質性,根據基因突變及臨床病理特征分為4種類型:肝細胞因子失活型HCA(HNF1α-inactivated HCA,H-HCA)、β-鏈蛋白激活型HCA(β-catenin-activated HCA,B-HCA)、炎癥型HCA(inflammatory HCA,I-HCA)及 未 分 類 型HCA(unclassified HCA,U-HCA)[4]。由于HCA發病率低而且不同分型之間影像學表現差異較大,其術前診斷仍是臨床工作中的挑戰。常規超聲(Bmodel ultrasound,BMUS)是肝臟局灶性病變(focal liver lesions,FLLs)的首選影像學檢查方法,超聲造影(contrast-enhanced ultrasound,CEUS)對FLLs的定性診斷具有較高的靈敏度和特異性,但目前關于HCA的CEUS特征的報道較少而且多為基于小樣本量的研究[5-8]。本文通過總結近年來在復旦大學附屬中山醫院確診為HCA病灶的BMUS及CEUS表現并結合分子分型進行分析,旨在提高HCA的術前診斷率。
資料和方法
研究對象回顧性分析2010年6月—2020年12月在我院經手術或穿刺后病理確診為HCA的103例共103個病灶的超聲圖像特征及臨床病理資料,其中男性59例,女性44例,年齡19~83歲,平均(35.16±15.27)歲,103例患者均行BMUS檢查,其中65例行CEUS檢查;85例為單發病灶,18例為多發病灶,多發病灶僅計入最大者。本研究經復旦大學附屬中山醫院倫理委員會批準(編號:B2021-051),豁免知情同意。
納入標準:經病理明確診斷為HCA;超聲檢查前未行任何治療;BMUS可清晰顯示肝臟病灶;BMUS及CEUS圖像資料保存完整。排除標準:BMUS肝臟病灶顯示不清;CEUS動態圖像存儲時間短等因素所致無法分析。
儀器與方法使用PHILPS IU 22、EPIQ7、GE LOGIQ E9等超聲診斷儀,配備凸陣探頭頻率2.5~5.0 MHz,機械 指 數(mechanical index,MI)<1.0。患者檢查時呈仰臥位或左側臥位,BMUS掃查病灶的位置、大小、內部回聲、回聲均勻性、邊界、形態;彩色多普勒血流成像(color doppler flow imaging,CDFI)檢測病灶的血流信號并測量阻力指數(resistance index,RI);在顯示病灶最大切面時切換至CEUS模式,通過頭靜脈注射對比劑聲諾維(SonoVue?,意大利Bracco公司)1.5~2.4 mL,隨后使用5 mL無菌生理鹽水沖管,觀察時間至少5 min。重復注射時,間隔時間>15 min。
圖像分析由兩名具有5年以上腹部超聲檢查經驗的醫師在不知病理結果的情況下單獨分析,意見不一致時經協商達成共識。分析病灶在BMUS的位置(左葉/右葉)、大小、內部回聲(高/等/低/混合回聲)、回聲均勻性(均勻/不均勻)、邊界(清晰、不清晰)及形態(規則/不規則);根據2020年世界醫學生物學超聲聯合會(World Federation of Ultrasound in Medicine and Biology,WFUMB)肝臟超聲造影指南[9],評估HCA在動脈期(10~45 s)增強方式(整體、向心性、離心性增強)、門脈期(45~120 s)和延遲期(120~300 s)的增強程度(高、等、低增強)、包膜下增強血管影以及病灶內部灌注缺損區。
統計學分析使用SPSS 23.0統計學軟件進行分析,符合正態分布的定量資料用x±s表示,組間比較采用t檢驗;不符合正態分布的定量資料采用M(IQR)表示,組間比較采用秩和檢驗。定性資料以例數或占比(%)表示,組間比較采用χ2或Fisher精確檢驗,組內兩兩比較采用χ2檢驗,P值用Boferroni法進行校正。P<0.05為差異有統計學意義。
結 果
HCA病灶的BMUS特征HCA病灶在BMUS主要表現為低回聲(68.9%,71/103)、內回聲不均勻(55.3%,57/103)、邊界清晰(73.8%,81/103)、形態規則(78.6%,81/103),13.6%(14/103)的病灶內部見斑片狀高回聲,3.9%(4/103)內見點狀鈣化,4.9%(5/103)見無回聲區,12.6%(13/103)的病灶周邊見暗環。79.6%(82/103)的病灶可測及血流信號,阻力指數0.40~0.82,平均0.62±0.17,血流信號分布以周邊型(62.1%,64/1063)最為常見,血流形態分別為點狀(25.2%,26/103)、短線狀(27.2%,28/103)、半環狀或環狀(25.2%,26/103)。
103例患者中59例行免疫組化檢查進行分子分型,包括38例I-HCA,14例H-HCA,3例B-HCA,4例U-HCA納入研究。因B-HCA及U-HCA的病例數較少,本研究僅比較I-HCA與H-HCA之間的BMUS特征差異。其中I-HCA主要表現為低回聲(68.4%,26/38),但H-HCA以高回聲為主要表現(78.6%,11/14,P<0.001)。52.6%(20/38)的IHCA合并脂肪肝背景而85.7%(12/14)的H-HCA肝實質背景正常(P=0.025)。I-HCA病灶半環形或環形血流信號的顯示率高于H-HCA(分別為50.0%和14.3%,P=0.030),兩者在病灶內部回聲均勻性、邊界清晰度等方面無顯著差異,見表1。I-HCA的BMUS圖像見圖1。

圖1 炎癥型肝細胞腺瘤BMUS圖像Fig 1 BMUSimageof inflammatory hepatocellular adenoma
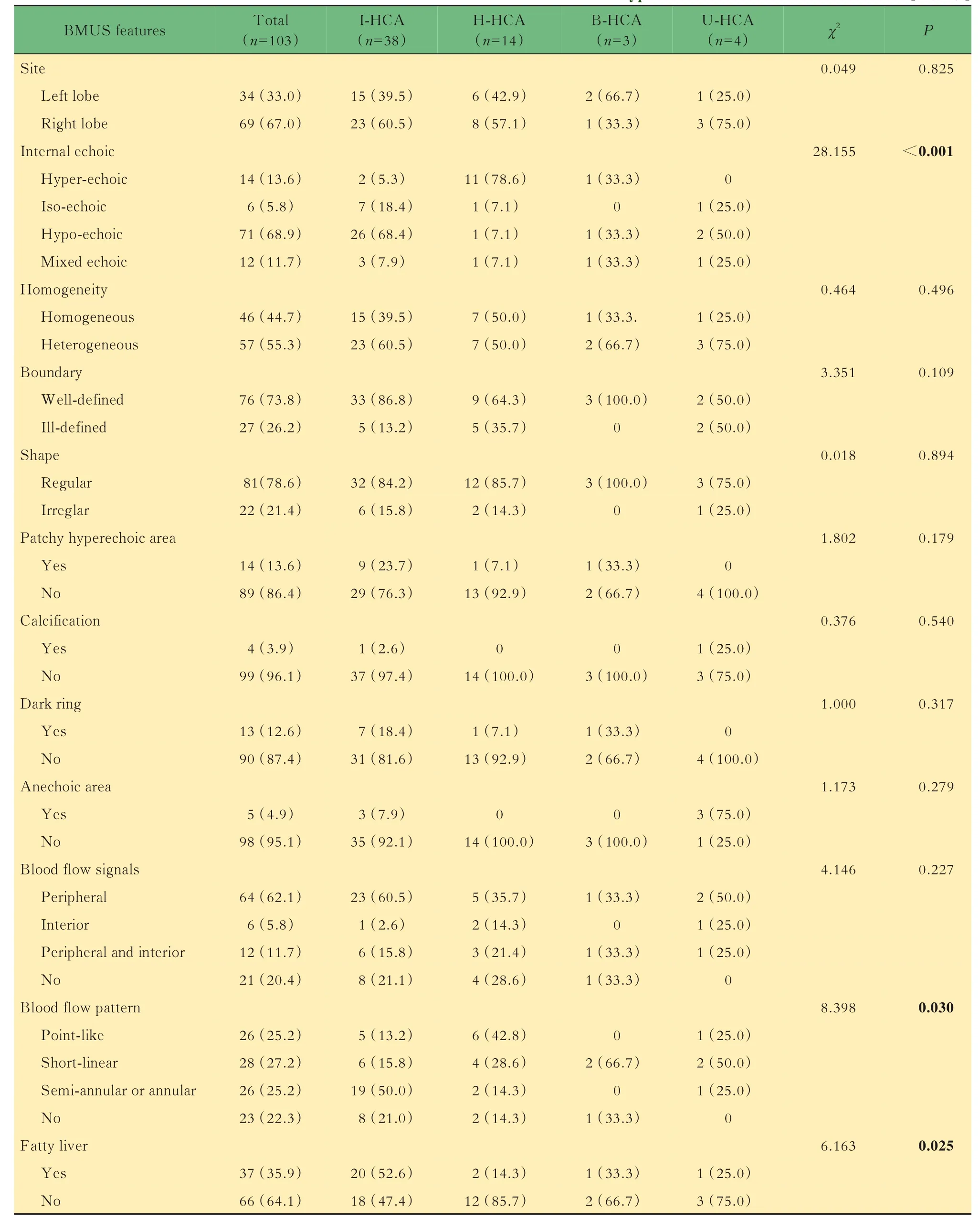
表1 不同分子分型HCA的BMUS特征Tab 1 BMUSfeatures of different molecular subtypes of HCA [n(%)]
HCA病灶的CEUS特征65例HCA患者完成CEUS檢查,其中37例患者行免疫組化檢查進行分子分型,24例為I-HCA,8例為H-HCA,2例為BHCA,3例為U-HCA。所有HCA病灶在動脈期表現為高增強,18.5%(12/65)呈向心性增強,7.7%(5/65)呈離心性增強,73.8%(48/65)呈整體增強,達峰時86.2%(56/65)呈均勻增強,13.8%(9/65)呈不均勻增強。門脈期15.4%(10/65)呈低增強,延遲期40.0%(26/65)呈低增強。另有50.8%(33/65)的病灶見包膜下增強血管影,6.2%(4/65)內部見始終未增強區。通過兩兩比較,在延遲期I-HCA呈低增強的比例高于H-HCA,兩者差異具有統計學意義(P=0.019),且I-HCA病灶包膜下增強血管影的顯示率高于H-HCA(分別為54.2%和12.5%,P=0.040),見表2。具體圖像見圖2、圖3。
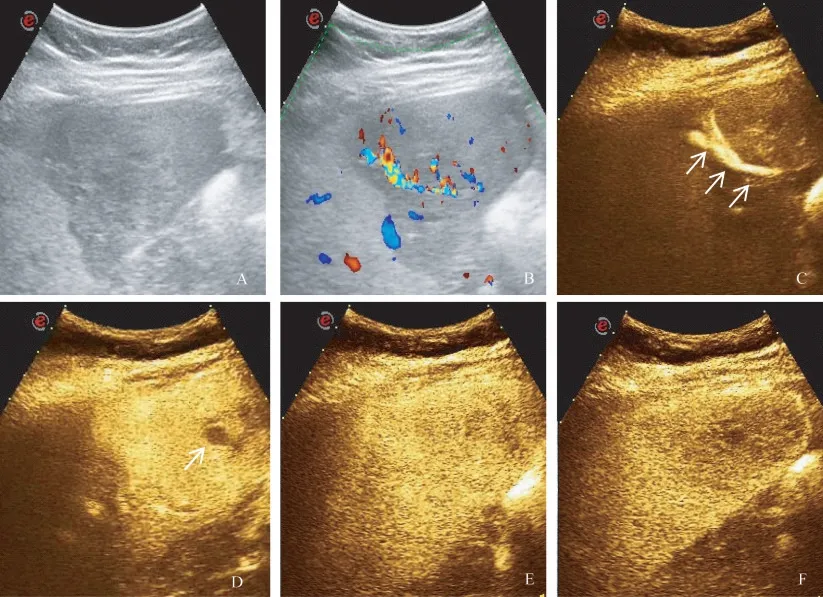
圖2 炎癥型肝細胞腺瘤CEUS圖像Fig 2 CEUSimage of inflammatory hepatocellular adenoma
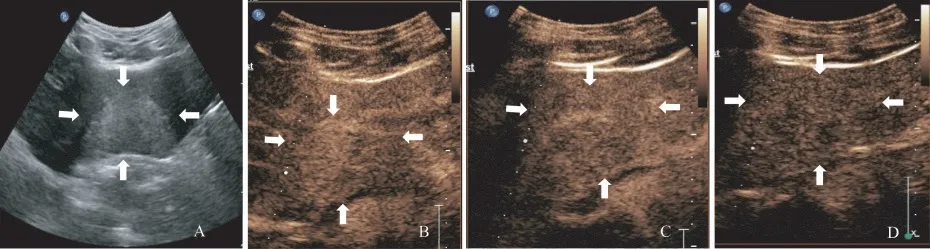
圖3 HNF-1a失活型肝細胞腺瘤CEUS圖像Fig 3 CEUSimage of HNF-1αinactivated hepatocellular adenoma
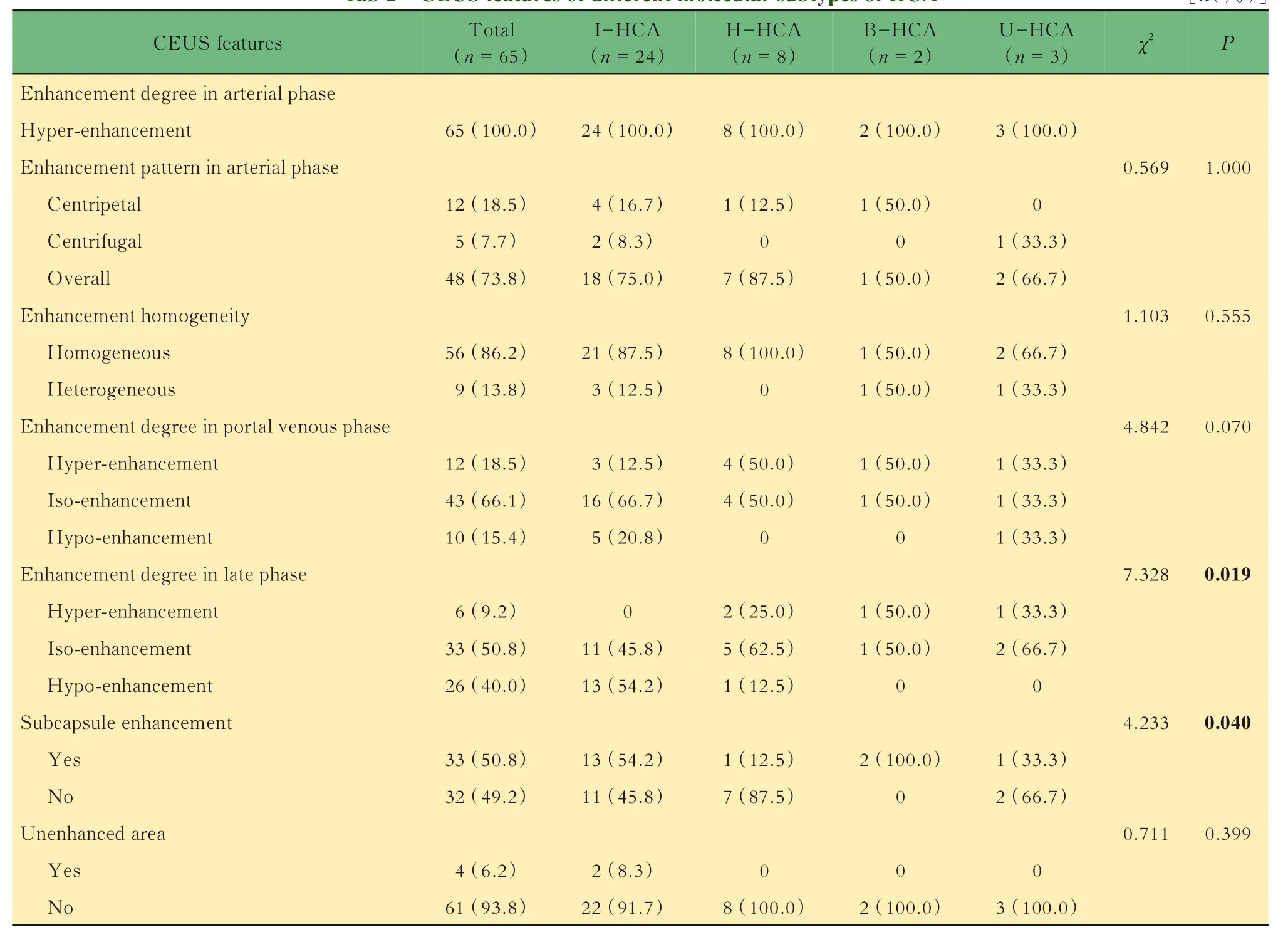
表2 不同分子分型HCA的CEUS特征Tab 2 CEUSfeatures of different molecular subtypes of HCA [n(%)]
BMUS及CEUS對不同分子分型HCA的診斷率具有“CEUS動脈期高增強、門脈期及延遲期不減退”及“包膜下增強血管影”特征的HCA病灶占50.7%。以“BMUS高回聲、CEUS動脈期均勻高增強、延遲期等增強或高增強”為特征診斷H-HCA,靈敏度、特異性、陰性預測值、陽性預測值、準確性分別為0.500、0.962、0.750、0.895、0.877,與病理結果對照的四格表見表3。
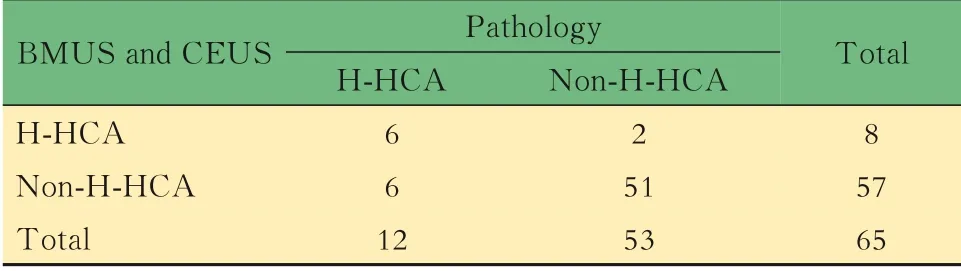
表3 BMUS及CEUS診斷H-HCA的四格表Tab 3 Fourfold table of BMUSand CEUSfor diagnosis of H-HCA (n)
以“BMUS低回聲伴脂肪肝背景、CDFI環狀或半環狀血流信號、CEUS動脈期高增強、包膜下增強血管影”為特征診斷I-HCA,靈敏度、特異性、陰性預測值、陽性預測值、準確性分別為0.545、0.875、0.818、0.651、0.708,與 病 理 結 果 對 照 的 四 格 表見表4。

表4 BMUS及CEUS診斷I-HCA的四格表Tab 4 Fourfold table of BMUSand CEUSfor diagnosis of I-HCA (n)
討 論
HCA是肝細胞增生引起的良性腫瘤,因其缺乏明顯臨床癥狀且具有高度異質性,與肝細胞來源的常見良惡性腫瘤如肝細胞癌(hepatocellularcarcinoma,HCC)、肝臟局灶性結節性增生(focal nodular hyperplasia,FNH)等難以鑒別[6,10]。既往研究認為HCA具有惡變潛能及出血破裂的風險,確診后應手術切除;近年來隨著分子病理的發展和個性化診療方案的提出,HCA的分子分型已被2016年歐洲肝臟病學會(European Association for the Study of the Liver,EASL)《肝臟良性腫瘤管理指南》推薦為治療方案選擇的重要參考因素,因此術前明確診斷HCA并預測其分子分型也成為對影像醫師的更高要求[11-12]。本研究通過回顧近十年復旦大學附屬中山醫院診治的HCA患者的超聲影像資料,觀察到HCA在BMUS主要表現為低回聲(68.9,71/103)、內部回聲不均勻(55.3%,57/103)、邊界清晰(73.8%,76/103)、形態規則(78.6%,81/103)等良性FLLs的特征,且因脂肪含量、血竇擴張不同及假匯管區形成等因素表現為內部回聲不均勻[13]。分別有13.6%(14/103)病灶內見斑片狀高回聲及3.9%(4/103)見點狀鈣化,可能與腫瘤組織內出血壞死誘發炎癥反應并吸收有關[7]。另有4.9%(5/103)的HCA因出血見無回聲區[14]。本研究還觀察到78.6%(11/14)的H-HCA表現為高回聲,可能由腫瘤細胞脂肪變性所致[13]。I-HCA病灶中呈“低回聲且合并脂肪肝背景”的比例高于H-HCA,與Broker等[15]的研究結果一致。CDFI顯示血流信號主要分布于病灶周邊及內部,約25.2%(26/103)形態為半環狀或環狀血流,平均阻力指數<0.60。盡管常規超聲在病灶大小、內部回聲及無回聲區方面可提示HCA出血等特征,但在顯示病灶微循環灌注方面價值有限。
注射對比劑后,本組HCA在CEUS動脈期主要表現為整體高增強73.8%(48/65),僅有少部分病灶表現為向心性增強(18.5%,12/65)或離心性增強(7.7%,5/65)。而Dong等[7]觀察到46.2%的病灶呈向心性增強,Garcovich等[5]報道89%的HCA表現為向心性增強,與本研究結果不同。Dietrich等[16]認為HCA動脈期的增強方式因病灶大小、血竇擴張、病理類型及炎性浸潤程度而異。部分研究者報道H-HCA呈整體增強,向心性增強是I-HCA的特征性表現(特異性約91%)[5,17]。而本組病例中兩者增強方式無顯著差異,可能與H-HCA的樣本量較少有關,我們在接下來的研究中將增加樣本量進一步探索不同類型HCA的CEUS特征差異。
門脈期84.6%(55/65)的HCA呈持續高增強或等增強,而延遲期僅約60.0%(39/65)呈持續增強,文獻報道約37%~53%的HCA在延遲期減退[5,16,18]。門脈期或延遲期出現減退的HCA病灶與HCC等惡性腫瘤表現相似,但在減退時間上HCC通常較早(在門脈期減退),而HCA減退時間較晚(出現在延遲期)。“延遲期減退”也被認為是HCA的特征之一[7,19]。值得關注的是,在延遲期12.5%(1/8)的H-HCA和54.2%(13/24)的I-HCA呈低增強,組內兩兩比較顯示兩者差異具有統計學意義。Garcovich等[5]的研究納入14例I-HCA,其中50%(7/14)呈持續增強,21.4%(3/14)和28.6%(4/14)分別在門脈期或延遲期減退。Laumonier等[17]的研究中也觀察到類似結果。曾有研究報道B-HCA的增強減退模式與HCC類似[20],本組2例B-HCA在門脈期及延遲期均未減退,但因B-HCA樣本量過小尚不能定論,U-HCA也如此。
包膜下增強血管影是HCA的另一重要特征性,本組HCA病例中檢出率為50.8%(33/65),與文獻報道相符[7,9]。Laumonier等[17]認為包膜下血管是快速向心性高增強的原因,也是I-HCA的特征性表現,而我們觀察到包膜下增強血管影在各種類型HCA中均能檢出,并且在I-HCA與H-HCA之間差異無統計學意義。此外,既往研究報道I-HCA自發性出血風險高于其他亞型,約5.6%~22%[5,14],而本組病例中僅2例I-HCA見始終未增強區,可能因為部分以破裂出血為首發癥狀的患者行急診手術而未行CEUS檢查。
以“BMUS高回聲、CEUS動脈期均勻高增強、延遲期等增強或高增強”為特征診斷H-HCA,雖然靈敏度較低,但特異性及陽性預測值均較高,由于H-HCA無須手術治療,上述特征有助于識別HHCA患者并避免不必要的手術切除。以“BMUS低回聲伴脂肪肝背景、CDFI環狀或半環狀血流信號、CEUS動脈期高增強、包膜下增強血管影”為特征診斷I-HCA,特異性和陽性預測值可分別達87.5%和81.8%。因I-HCA是發病率最高的亞型且具有破裂出血和惡變風險,BMUS結合CEUS特征有助于HCA患者的危險分層,對疑似I-HCA的患者及時手術治療或可改善預后。
本研究也存在一定的局限性,B-HCA和UHCA因病例數較少而未比較其超聲特征與HHCA、I-HCA的差異,但本研究也是目前發表文獻中[5,7-8]納入樣本量最多的研究。
綜上,HCA的BMUS特征包括低回聲、內部回聲不均勻、邊界清晰、形態規則、RI<0.6,CEUS特征主要包括動脈期整體均勻增強、包膜下增強血管影和部分延遲期減退。H-HCA的特征為BMUS高回聲、CEUS動脈期整體高增強、門脈期及延遲期持續增強;而I-HCA的特征為BMUS低回聲伴脂肪肝背景、CDFI環狀或半環狀血流信號、CEUS動脈期高增強、包膜下增強血管影部分門脈期及延遲期低增強。常規超聲及超聲造影對HCA的術前診斷及分型具有一定的提示作用。
作者貢獻聲明陳凱玲 收集數據,統計分析,撰寫論文。朱宇莉 論文修訂,可行性分析。董怡 論文構思及修訂。李翠仙 文獻調研,可行性分析。包靜文 數據收集、整理與保存。汪瀚滔 數據收集,可行性分析。王文平 獲取資助,論文指導及修訂。
利益沖突聲明所有作者均聲明不存在利益沖突。

