剖析線性化處理后的化學(xué)平衡常數(shù)與溫度關(guān)系
晏雄
(湖南省瀏陽市第一中學(xué))
1 問題的提出
化學(xué)反應(yīng)原理中最核心的物理量是化學(xué)平衡常數(shù),可用來定量描述可逆反應(yīng)的程度.化學(xué)平衡常數(shù)只受溫度影響,由于升高溫度平衡向吸熱反應(yīng)方向移動,故升高溫度吸熱反應(yīng)的平衡常數(shù)增大,放熱反應(yīng)的平衡常數(shù)減小.
其實(shí)化學(xué)平衡常數(shù)與溫度也存在定量關(guān)系,由范特霍夫等溫方程ΔG=ΔG?+RTlnK?與吉布斯-亥姆霍茲方程ΔG?=ΔH-TΔS可知,平衡時ΔG=0,即有RTlnK?=-ΔH+TΔS,兩邊同除以T變形可得RlnK?=-+ΔS,假定ΔS不受溫度影響,可視為常數(shù)(K?為相對分壓表示的平衡常數(shù)).在高考試題中常以信息形式給出lnK?或lgK?與的線性關(guān)系,或者給出線性方程:
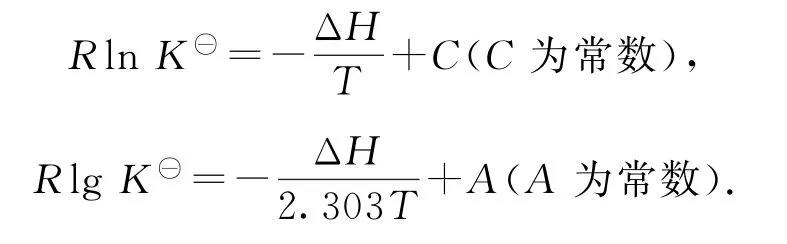
如果將K?換成分壓表示的平衡常數(shù)Kp或物質(zhì)的量分?jǐn)?shù)表示的平衡常數(shù)Kx,也依然存在線性關(guān)系.這類試題信息量大,對數(shù)理邏輯能力要求較高.
2 由線性方程判斷ΔH 的符號與相對大小
例1(2021 年廣東卷,有刪改)我國力爭于2030年前做到碳達(dá)峰,2060年前實(shí)現(xiàn)碳中和.CH4與CO2重整是CO2利用的研究熱點(diǎn)之一.該重整反應(yīng)體系主要涉及以下反應(yīng):
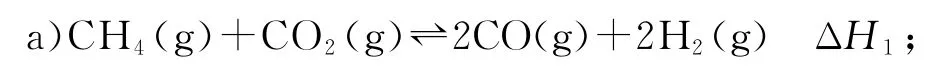
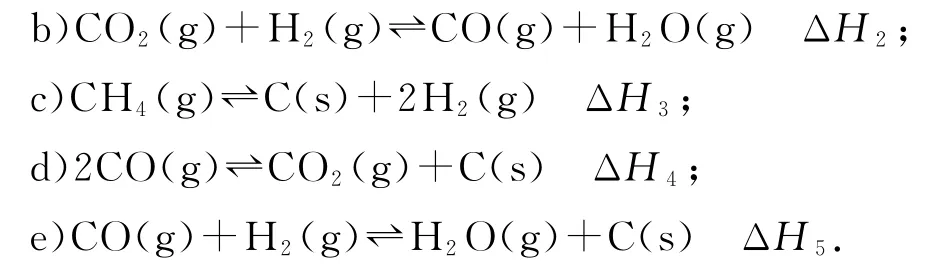
設(shè)為相對壓力平衡常數(shù),其表達(dá)式寫法:在濃度平衡常數(shù)表達(dá)式中,用相對分壓代替濃度.氣體的相對分壓等于其分壓(單位為kPa)除以p0(p0=100kPa).反應(yīng)a、c、e的ln(溫度的倒數(shù))的變化如圖1 所示.反應(yīng)a、c、e中,屬于吸熱反應(yīng)的有_________(填字母).
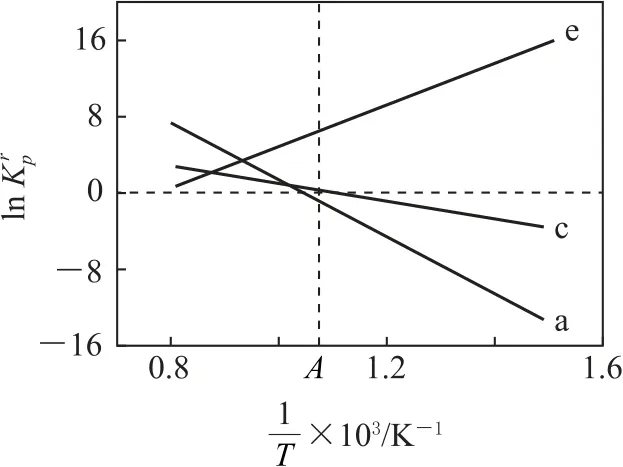
圖1
分析①隨著溫度的升高減小,反應(yīng)a和c的ln增大,說明的數(shù)值增大,反應(yīng)向正反應(yīng)方向進(jìn)行,反應(yīng)a和c為吸熱反應(yīng),同理反應(yīng)e的ln減小,說明減小,反應(yīng)向逆反應(yīng)方向進(jìn)行,反應(yīng)e為放熱反應(yīng),故屬于吸熱反……

