急性腦梗死患者發生血管性認知障礙的相關因素及預測模型構建
許 可, 安曉雷, 李曉賓, 郭 靖, 李傳玲
(江蘇省徐州市中心醫院 神經內科, 江蘇 徐州, 221000)
急性腦梗死(ACI)作為最常見腦血管疾病,腦血管閉塞后局部腦組織壞死、血管內皮細胞損傷等會破壞血腦屏障,增大血管性認知障礙(VCI)發生風險[1]。據報道[2-3], VCI具有起病隱匿、病程長等特點,而早期采取相應治療可有效改善認知功能減退癥狀,延緩疾病發展。另有報道[4]指出,約50% VCI患者可能會進展為永久性癡呆,影響生活質量,加重家庭負擔。王凌雪等[5]研究顯示,文化程度、白細胞介素-6與腦卒中患者發生VCI有關,但其是否可預測ACI患者發生VCI的風險尚未明確。本研究分析ACI患者發生VCI的相關因素,并構建相關因素風險模型,檢驗ACI患者發生VCI風險模型的預測效能,為未來預防VCI的發生提供參考。
1 資料與方法
1.1 一般資料
選取2018年6月—2020年8月收治的134例ACI患者為研究對象,患者及家屬均知情同意,且簽訂研究知情同意書。134例患者中,男69例,女65例; 年齡53~68歲,平均(60.255±2.234)歲; 發病至入院時間1.23~4.21 h, 平均(2.272±0.241) h; 合并基礎疾病為高血壓64例,糖尿病52例,高脂血癥47例。研究獲得醫院醫學倫理委員會批準。(1) 納入標準: ① ACI符合相關標準[6], 且經頭顱CT或磁共振成像(MRI)確診者; ② 發病至入院時間≤4.25 h者; ③ 首次發病者; ④ 入院時美國國立衛生研究院卒中量表(NIHSS)[7]評分<5分者; ⑤ 接受阿替普酶溶栓、抗凝等相關對癥治療者; ⑥ 具備基礎閱讀、書寫能力者。(2) 排除標準: ① 入院前伴有認知障礙相關疾病者; ② 入院前合并抑郁癥或其他精神疾病者; ③ 合并惡性腫瘤者; ④ 合并感染性疾病者; ⑤ 合并先天性心臟病、冠心病等心臟疾病者; ⑥ 肝、腎功能衰竭者; ⑦ 合并腦出血、血管畸形等其他導致認知功能障礙疾病者。
1.2 方法
1.2.1 VCI評估: 治療結束隨訪6個月時,采用Hachinski缺血量表(HIS)[8]評估患者VCI情況,量表包括13個條目,第1、3、10、12、13條目采用0~2分的3級評分法,其余條目采用0~1分的2級評分法,總分18分; HIS得分≥7分判定為VCI。
1.2.2 基線資料采集: 設計基線資料填寫表,詢問并記錄患者相關基線資料,主要包括性別、年齡、發病至入院時間、腦梗死部位(基底節、腦干、腦葉、小腦、其他)、合并基礎疾病、入院時NIHSS評分、吸煙史(一生中連續或累積吸煙時長≥6個月)、飲酒史(飲酒時長≥5年,即每日飲酒量≥40 g)、受教育年限(初中及以下、高中或中專、專科及以上)、腦白質疏松和卒中后抑郁。
1.2.3 檢測相關實驗室指標:包括血紅蛋白(Hb)、D-二聚體(D-D)、同型半胱氨酸(Hcy)水平等。入院第2天,采集患者空腹靜脈血5 mL, 分別置于3支試管內, 1支采用血液分析儀(武漢醫捷迅安商貿有限公司,型號BC-5120)測定Hb水平; 1支采用血凝分析儀(武漢醫捷迅安商貿有限公司,型號XL1000E)測定D-D水平; 最后1支采用低速離心機(濟南鑫貝西生物技術有限公司,型號TD-6B)以4 000轉/min離心10 min, 離心半徑為10 cm。采用高效液相色譜法測定血清中Hcy水平,檢測試劑盒購自北京索萊寶科技有限公司,檢驗流程嚴格按照試劑盒說明書進行。
1.3 觀察指標
合并基礎疾病: ① 高血壓,收縮壓水平≥140 mmHg, 舒張壓水平≥90 mmHg; ② 糖尿病,空腹血糖水平≥7.20 mmol/L, 和/或餐后2 h血糖水平≥11.21 mmol/L; ③ 高脂血癥,總膽固醇水平>5.272 mmol/L, 甘油三酯水平>1.270 mmol/L。入院時采用NIHSS評估NIHSS評分, NIHSS包括意識、凝視、上肢運動、感覺等11個項目,總分42分,得分越高表示認知功能缺損越嚴重。依據Fazekas量表[9], 并結合顱腦檢查評估檢測腦白質疏松情況, Fazekas量表總分為6分,得分≥1分即可判定為腦白質疏松。卒中后抑郁: 治療后3個月,采用漢密爾頓抑郁量表(HAMD)[10]進行評估,量表共有17個條目,其中1~3、7~11、15、17條目采用0~4分的5級評分法進行評定, 4~6、12~14、16條目采用0~2分的3級評分法,量表總分為57分,得分≥8分即可判定為抑郁。
1.4 統計學方法
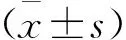
2 結 果
2.1 ACI患者發生VCI的情況
134例ACI患者中, 78例發生VCI, 發生率為58.209%(78/134), 56例未發生VCI。
2.2 發生、未發生VCI 的 ACI患者相關基線資料比較
發生VCI的ACI患者腦白質疏松占比、卒中后抑郁占比、Hcy水平與未發生VCI的患者比較,差異有統計學意義(P<0.205); 發生、未發生VCI的ACI患者其他基線資料比較,差異無統計學意義(P>0.205), 見表1。

表1 發生和未發生VCI的 ACI患者相關基線資料比較
2.3 ACI患者發生VCI的影響因素分析
將差異有統計學意義的變量如腦白質疏松(有=1、無=0)、卒中后抑郁(有=1、無=0)、Hcy(連續變量)納入作為自變量,將ACI患者發生VCI的情況作為因變量(1=發生, 0=未發生),經單項Logistic回歸分析后,將P放寬至<0.21,將符合條件的因素糖尿病(有=1、無=0)、D-D(連續變量)同時納入作為自變量,建立多元Logistic回歸模型。回歸分析結果顯示,腦白質疏松、卒中后抑郁、Hcy水平升高可能是ACI患者發生VCI的影響因素(OR>1,P<0.205), 見表2。

表2 ACI患者發生VCI的影響因素分析
2.4 ACI患者發生VCI的影響因素風險模型的構建及預測效能分析
根據Logistic回歸分析結果對腦白質疏松(無計“0分”,有計“1分”)、卒中后抑郁(無計“0分”,有計“1分”)、Hcy(5~15 μmol/L計“0分”, >15 μmol/L計“1分”)進行風險賦分,將各影響因素所得評分取整后計算風險模型總分; 繪制ROC曲線結果發現,構建的相關因素風險模型預測ACI患者發生VCI風險的AUC為0.287 8(95%CI: 0.282 3~0.293 3), 有一定預測價值, cut-off值取1.208 5分時可獲得最佳預測效能,此時特異度、敏感度、約登指數分別為0.282 1、0.271 4、0.253 5, 見圖1。

圖1 相關因素風險模型預測ACI患者發生VCI風險效能的ROC曲線
2.5 ACI患者發生VCI的影響因素風險模型擬合程度檢驗結果
在原有研究人群基礎上采用Bootstrap法重采樣100次,獲得內部驗證人群,用建立的ACI患者發生VCI的相關因素風險模型對內部驗證人群進行風險評估,結果提示, Hosmer-Lemeshow擬合優度檢驗的擬合度滿意(χ2=13.298 7,P=0.208 2)。
3 討 論
ACI作為病死率較高腦血管疾病,不僅威脅患者生命安全,還可能會引發VCI, 影響患者生活質量[11]。李強等[12]研究顯示, 62.218%的腦梗死患者發生VCI。本研究結果顯示, 134例患者中, 58.209%患者發生VCI,略低于上述研究結果,結果差異可能與疾病嚴重程度不同有關,但也提示ACI患者發生VCI的風險較高,臨床應高度重視。
本研究初步比較發生和未發生VCI的ACI患者的相關基線資料,采用Logistic回歸分析進行檢驗,結果顯示,腦白質疏松、卒中后抑郁、Hcy水平升高可能是ACI患者發生VCI的影響因素。可能原因: ① 腦白質疏松。報道[13]指出,ACI發生后局部腦血流灌注量減低,毛細血管通透性破壞,會損傷血腦屏障,造成腦白質疏松,而腦白質疏松會造成投射纖維異常,影響額葉皮質及邊緣系統,損害丘腦-皮質紋狀體-皮質環路,且疏松部位缺血、缺氧和側支循環不良會加重ACI的嚴重程度,從而伴有腦白質疏松的ACI患者發生VCI的風險更高,同時隨著患者腦白質疏松的加重, ACI程度也加重[14]。② 卒中后抑郁。相關研究[15]發現,約30%的ACI患者可能會發生卒中后抑郁并發癥,而患者伴有抑郁情緒可能會加重神經缺損,影響認知功能,影響康復治療,從而延緩神經功能恢復。動物研究[16]發現,抑郁大鼠海馬區腦源性神經營養因子表達顯著降低,而神經因子含量減少會減弱促神經生長能力,繼而可能導致VCI的發生。阮婕等[17]研究也表明, ACI患者卒中后抑郁會增高VCI發生風險。③ Hcy水平升高。Hcy是蛋氨酸與半胱氨酸代謝中間產物,通常情況下,血清Hcy呈低水平,但原發或繼發因素可能會導致血清Hcy升高,參與血管內皮損傷、神經毒性過程[18]。報道[19]指出, Hcy水平升高會引發機體氧化應激反應,影響細胞代謝,阻滯細胞甲基化,繼而損傷神經細胞,導致認知功能障礙。同時, Hcy水平升高還可能阻礙谷胱甘肽合成,影響神經細胞正常發育與分化,導致海馬溝回神經細胞萎縮,繼而增大VCI的發生風險[20]。
本研究結合腦白質疏松、卒中后抑郁、Hcy水平升高因素構建風險模型,繪制ROC曲線發現,構建的風險模型預測ACI患者發生VCI風險有理想價值; 進一步將構建的風險模型預測評分系統用于內部驗證人群患者的風險評估,結果提示, Hosmer-Lemeshow擬合優度檢驗P>0.205, 擬合程度良好,說明多個影響因素可預測ACI患者發生VCI的風險。因此,對于腦白質疏松、卒中后抑郁、Hcy水平升高的患者,可采取營養腦細胞藥物、心理疏導、葉酸與維生素B12等藥物進行干預,以促進神經細胞發育、減輕抑郁情緒、下調Hcy水平,預防VCI的發生。邱彩霞等[21]報道指出,血糖調節受損也可能會導致VCI的發生,原因在于血糖水平升高會加重無氧酵解,引發酸中毒,加重腦組織缺氧情況,繼而可能會引起線粒體功能障礙,導致神經元凋亡,增高VCI的發生風險。但本研究經多元Logistic回歸分析檢驗發現,糖尿病不會增大ACI患者發生VCI的風險,可能與患者個體差異、血糖控制情況不同有關。
但本研究存在一定局限性,如納入的影響因素尚不全面,腦灰質情況、灰白質比例及認知相關的神經傳導束情況可能會對ACI患者發生VCI產生影響,但本研究并未進行詳細分析,未來還需進一步開展研究為后續ACI患者的治療提供新的方向。綜上所述, ACI患者發生VCI可能受腦白質疏松、卒中后抑郁、Hcy水平升高影響,構建的風險模型預測ACI患者發生VCI的準確度較好,臨床可據此提出針對性干預方案,可能對減少ACI患者發生VCI有積極意義。

