3D打印個體化補償物在肛管癌放療中的研究
曾彪,竇鈺姣,譚劍鋒,駱龍軍,黃仕雄,周瓊輝,曾德高,徐詩磊,朱婉琳,張九堂
1. 湖南省腫瘤醫院/中南大學湘雅醫學院附屬腫瘤醫院 放射物理技術部,湖南 長沙 410013;2. 中南大學湘雅醫院 門診辦,湖南 長沙 410008
引言
放療技術的進步,大大降低了放療的不良反應,在治療腫瘤的同時,可以讓患者不必降低生活質量。當前,同步放化療已成為肛管癌的主要治療手段[1]。肛管癌放療時,大多數采用俯臥位固定方式,因為俯臥位固定時,小腸、膀胱、直腸和結腸等器官受量明顯低于仰臥位[2-4]。這是由于采取俯臥位固定時,位于腹部的危及器官由于重力的作用下垂,使得靶區周圍重要的危及器官如膀胱、小腸等得到了更好的保護。然而,當肛管癌患者采用俯臥位固定方式放療時,放療靶區有大部分在淺表部位,由于高能射線建成效應的影響,淺表腫瘤的劑量很難真正得到提高[5-7];如果要提高淺表腫瘤的劑量,需要在患者身體表面覆蓋補償物。目前,大部分放療中心使用的是傳統的組織補償物,這種補償物與患者皮膚表面之間留有空腔,由于達不到充分的背向散射條件,補償物后方空腔會產生跌落效應影響療效[7];此外,空腔后次級電子的沉積引起的建成效應,會導致空腔后的皮膚組織出現熱點[8-9],而且傳統補償物每次覆蓋所帶來的位置偏差也會引起空腔位置及體積的差異,進一步造成肛管癌放療吸收劑量的誤差。
本文利用3D打印技術,打印出貼合度好的個體化組織補償膜,并利用常規組織補償物與其進行多種計劃方案的劑量學比較,最后進行相關的劑量驗證,以期為3D打印個體化組織補償物的應用優勢提供理論依據。
1 材料與方法
1.1 病例收集
本研究收集湖南省腫瘤醫院2014—2019年收治的肛管癌患者共計12例,所有患者均由本院病理證實為鱗狀細胞癌。本研究經我院倫理委員會批準,且患者均簽署知情同意書。
1.2 CT定位及影像采集
應用GE公司大孔徑CT模擬定位機進行掃描。患者俯臥于腹板體架上,平靜呼吸,額頭放于手交叉處。掃描上界至第四腰椎水平、下界至股骨上段,掃描層厚為0.5 cm[10]。首先進行第1次CT定位掃描,并把圖像傳送至3D打印軟件Mimics以及放療計劃系統。待制作出3D打印個體化組織補償膜后,患者覆蓋常規組織補償膜和3D打印組織補償膜(圖1)分別進行第2次和第3次CT定位掃描[11-12]。

圖1 使用3D打印個體化補償物進行放療定位
1.3 制作個體化組織補償物
放療醫生利用患者的CT定位圖像,運用3D打印軟件Mimics處理系統對CT圖像進行分割處理,使用閾值與區域生長的分割方法提取患者輪廓信息,然后經過拉普拉斯平滑處理,將患者放療組織補償膜數據以.STL格式輸入3D打印機;3D打印機使用高分子合成生物材料——聚乳酸,按指定路徑掃描打印,待4~6 h模型干燥穩定后應用于患者放療中。
1.4 放療靶區勾畫
放療醫生在CT定位圖像上勾畫肛管癌患者的靶區和正常器官。靶區勾畫參考澳大利亞胃腸試驗組共識[10]。原發腫瘤靶區(Gross Tumor Volume,GTV)包括肛管大體腫瘤、區域轉移淋巴結;臨床靶區(Clinical Target Volume,CTV)包括腫瘤原發灶及其周圍2~3 cm,并包括相應淋巴引流區;腫瘤計劃靶區(Planning Gross Tumor Volume,PGTV)和臨床計劃靶區(Planning Clinical Target Volume,PCTV)為相應靶區周圍外擴0.5 cm形成。勾畫完畢后,把靶區和正常器官復制到第2次和第3次CT定位掃描圖像上,確保每位患者3組CT圖像上的靶區和正常器官的形狀大小是一致的。
1.5 處方劑量和放療計劃設計
參照澳大利亞胃腸試驗組共識[10],處方劑量為PGTV給予50 Gy/25次,PTV給予45 Gy/25次;腫瘤原發灶和轉移淋巴結采用序貫補量方式給予14 Gy/7次。采用瑞典醫科達公司Monaco治療計劃系統(Version 5.51),采用6 MV射線、7野靜態調強模式。每例患者共制定四組放療計劃,具體分組如下。① Plan A:以不加組織補償物進行的第1次定位CT掃描圖像為計劃主序列圖像;② Plan B:以Plan A的CT圖像為計劃主序列圖像,并在治療計劃系統上設計虛擬組織補償物;③ Plan C:以覆蓋常規補償物進行的第2次CT定位掃描圖像為計劃主序列圖像;④ Plan D:以覆蓋3D打印的組織補償物進行的第3次CT定位掃描圖像為計劃主序列圖像[11-12]。在設計完第一組放療計劃之后,把第一組放療計劃復制到其他三組定位圖像上進行放療計劃優化,因此四組放療計劃的射野參數、生物優化函數、優化參數以及其他的優化條件均保持一致。治療計劃設計完成后,統計所有肛管癌病例的靶區最大劑量、靶區覆蓋度、均勻度和正常組織受量。
1.6 靶區和正常組織劑量學評估
靶區劑量評估采用最大劑量(Dmax)、最小劑量(Dmin)、靶區均勻性指數(Homogeneity Index,HI)、適形指數(Conformity Index,CI)等指標進行評估[5]。因正常器官劑量受照體積關系到膀胱、直腸等的副反應發生的概率,所以要統計出直腸、膀胱、小腸等正常組織的受照最大劑量和體積劑量。HI=(D2%-D98%)/D50%×100%,其中Dx%表示百分之x的體積對應的劑量,HI值越小表示靶區劑量的均勻性越好。CI=V100%Rx/Vtarget,V100%Rx表示處方劑量所包括的體積,Vtarget表示靶區的體積。CI值取值范圍為0~1,越接近于1說明適形程度越高。
1.7 統計學分析
采用SPSS 19.0軟件進行分析,數據用±s表示,對四組放療計劃進行單因素方差分析,組內比較用LSD法進行。P<0.05為差異有統計學意義。
1.8 劑量驗證
選用EBT3免洗膠片、EPSON Express平板文檔掃描儀、RIT113膠片劑量分析軟件和盆腔仿真人體模型進行淺表腫瘤劑量驗證。高年資放療醫生在仿真人體模型的CT圖像中勾畫出肛管癌的靶區和正常器官,并進行如上肛管癌患者一樣的四種放療方案的設計,在仿真人體模型肛管位置的橫斷面上放置EBT3膠片之后,在加速器上實施照射(圖2)。膠片照射前先進行校準。校準方法:首先將膠片掃描后的像素值轉化為凈光密度,再將凈光密度轉換為劑量值,這樣可以去除掃描儀探測器的靈敏度變化以及光源強度等因素造成的驗證誤差[13]。膠片照射后避光保存1 d后開始進行掃描,掃描儀預熱2 h使光源穩定后再進行掃描。掃描完成后,從保存的48位RGB彩色tiff圖像中提取紅色通道的像素值進行分析。利用RIT113膠片劑量分析軟件對四種治療計劃進行劑量分析,統計出各組計劃膠片所在位置的腫瘤淺表部位劑量差異。四種計劃均在同一個淺表位置上設置一條標記線,之后利用RIT113軟件對這條標記線處的實際受照劑量與放療計劃劑量進行對比分析。

圖2 利用仿真人體模型進行膠片劑量驗證
2 結果
2.1 四種放療計劃的劑量學比較結果
12例患者的CT掃描數據顯示3D打印組織補償膜與人體的貼合度良好,與患者表面的空隙為1 mm左右,這是由本研究使用的3D打印材料聚乳酸材質偏硬造成的[11-12]。通過12例患者四組計劃的劑量學比較發現,四組計劃的正常組織受量均能滿足臨床要求(圖3)。PGTV和PCTV的覆蓋度均能滿足臨床要求且沒有統計學差異;PGTV的Dmax有統計學差異,其中Plan A的最大,為(73.7±2.1)Gy,其他三組的低5%左右,且其他三組之間沒有統計學差異(表1)。靶區均勻度HI有統計學差異,Plan A的HI最差,為(1.08±0.04),其他三組的HI均比Plan A好且三組之間沒有統計學差異,四組計劃的CI均無統計學差異(表1)。

圖3 四種放療方案的橫截面劑量分布圖
表1 四種放療方案PGTV劑量參數對比(±s)
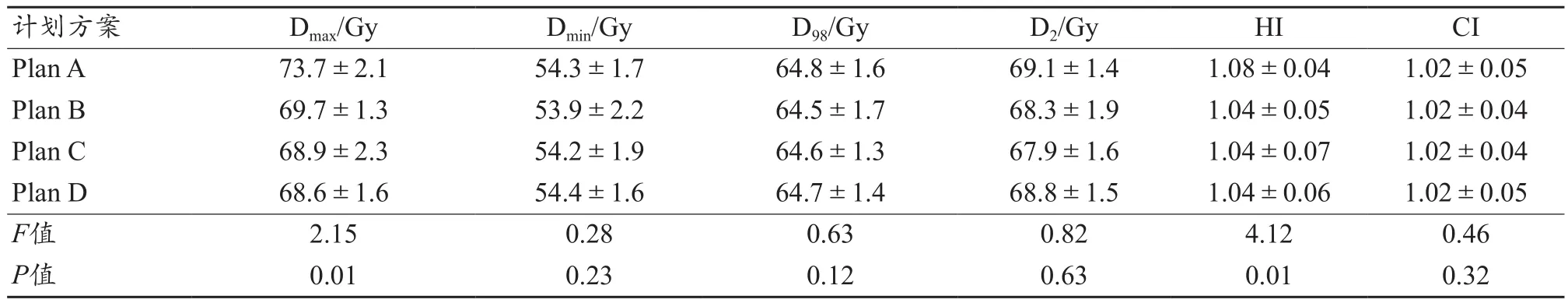
表1 四種放療方案PGTV劑量參數對比(±s)
計劃方案 Dmax/Gy Dmin/Gy D98/Gy D2/Gy HI CI Plan A 73.7±2.1 54.3±1.7 64.8±1.6 69.1±1.4 1.08±0.04 1.02±0.05 Plan B 69.7±1.3 53.9±2.2 64.5±1.7 68.3±1.9 1.04±0.05 1.02±0.04 Plan C 68.9±2.3 54.2±1.9 64.6±1.3 67.9±1.6 1.04±0.07 1.02±0.04 Plan D 68.6±1.6 54.4±1.6 64.7±1.4 68.8±1.5 1.04±0.06 1.02±0.05 F值 2.15 0.28 0.63 0.82 4.12 0.46 P值 0.01 0.23 0.12 0.63 0.01 0.32
2.2 肛管癌淺表腫瘤處的劑量驗證結果
在腫瘤橫斷面的淺表部位,對計劃劑量與實際測量劑量進行劑量比較分析發現,Plan A沒有使用補償物,其淺表位置處的實際劑量與計劃劑量平均偏差為37.1%;Plan B使用了虛擬補償物,在實際驗證中,使用3D打印補償物代替虛擬補償物,其淺表位置處的實際劑量與計劃劑量平均偏差為5.7%;Plan C使用常規補償物,其淺表位置處的實際劑量與計劃劑量平均偏差為12.6%;Plan D使用3D打印補償物,其淺表位置處的實際劑量與計劃劑量平均偏差為6.9%。對四組放療計劃的劑量驗證偏差進行單因素方差分析顯示,Plan D的劑量偏差最小(P=0.01),具有統計學意義,說明覆蓋3D打印補償物時淺表位置的實際劑量與計劃劑量偏差較小,臨床獲益大。
3 討論
放射治療的宗旨是盡可能提高靶區的劑量,降低正常組織的損傷[14-15]。在放射治療領域中,有一些腫瘤患者的放療靶區在淺表部位,由于高能射線劑量建成效應的影響,腫瘤靶區的劑量很難提高[16]。肛管癌患者俯臥位放療時,要提高患者淺表部位腫瘤區域的劑量,需要在患者身體表面覆蓋補償物。在目前國內外的放療中,患者使用的補償物規格大小基本相同,但覆蓋的貼合度非常不好,補償物與患者皮膚表面之間留有空腔,導致劑量分布不均勻、不準確。本研究中的放療個體化補償物是通過3D打印技術來實現的。選用高分子聚乳酸材料,3D打印出與患者個人外輪廓信息一致的個體化補償膜。在臨床放療中,補償膜可以讓腫瘤患者的靶區劑量分布更精確、更均勻。
Chiu等[17]將3D打印補償膜應用于鼻咽癌患者的放射治療中,結果顯示鼻咽癌患者的3D打印補償膜具有良好的劑量均勻性。Park等[18]用3D打印補償膜和常規補償膜對乳腺癌和皮膚癌患者靶區劑量分布的研究表明,采用3D打印補償膜的患者在靶區適形性方面具有明顯優勢,可以更好地實現治療計劃的目標劑量分布,而使用常規硅膠補償膜者,靶區范圍內存在劑量不足現象。同樣,在頭頸部惡性腫瘤和非黑色素瘤皮膚癌中,3D打印補償膜也產生了令人滿意的結果[16,19]。
4 結論
本研究通過對四種放療方案進行對比發現,在肛管癌患者的調強放療中,不加補償膜和使用常規組織補償膜均能在治療計劃上滿足臨床的要求,靶區覆蓋度良好,只在靶區最大劑量和靶區均勻性方面有區別。但是劑量驗證結果顯示,不加補償膜和使用常規組織補償膜在腫瘤橫斷面的淺表部位的劑量通過率很低,劑量偏差較大;3D打印的組織補償膜在腫瘤橫斷面的淺表部位的劑量通過率高,劑量偏差很小;而且虛擬的組織補償膜計劃與真實3D打印組織補償膜計劃的結果差別很小,趨向一致。因此,3D打印的補償膜對部分肛管癌患者的放療是有利的,能有效地提高淺表腫瘤的劑量。在執行過程中,肛管癌患者只需進行一次CT定位掃描即可開始制作3D打印補償膜,并在治療計劃系統勾畫虛擬補償膜進行治療計劃設計,既能夠滿足精確放療的要求,又能成為一種快捷而實用的3D打印組織補償膜的臨床應用方式。由于本研究中使用的是高分子合成生物材料——聚乳酸,材料偏硬,所以貼合度不是非常好,但是效果仍然較常規的補償物好,也能夠很好滿足臨床要求。
3D打印個體化組織補償膜不僅可應用于肛管癌患者的放療,對于大部分淺表腫瘤的放療都有非常重大的意義。3D打印技術的推廣,讓個體化定制組織補償膜得以實現,也讓精確放療技術得以精確實施,這對放療治療效果的提高有著積極的意義。

