N 6-甲基腺苷甲基化修飾與結直腸癌關系的研究進展△
韓非,程海東,侯明星#
1內蒙古醫科大學第一臨床醫學院,呼和浩特 010010
2內蒙古醫科大學附屬醫院胃腸外科,呼和浩特 010010
結直腸癌是成年人最常見的惡性腫瘤之一,發病率居全球惡性腫瘤第三位,僅次于乳腺癌及肺癌,病死率高居第二位[1]。結直腸癌的治療方式主要包括手術、新輔助放化療、靶向治療和免疫治療,即使經過積極的治療,晚期結直腸癌的治療效果仍然不令人滿意[2]。結直腸癌的發生、發展是一個復雜的過程,涉及遺傳學、表觀遺傳學和轉錄組學的變化。越來越多證據表明,N6-甲基腺苷(N6-methyladenosine,m6A)調節因子的失調與結直腸細胞癌變和進展相關。因此,進一步闡明結直腸癌的分子發病機制,以早期發現及診斷對疾病的治療是必要的。本文對m6A修飾在結直腸癌中的研究進展進行綜述,旨在對結直腸癌的發病機制進一步闡明,從表觀遺傳修飾的角度為結直腸癌的早期診斷及靶向治療提供新思路。
1 m6A甲基化的概念及其調節因子
表觀遺傳修飾是指在沒有細胞核DNA序列改變的情況時,基因功能可逆的、可遺傳的改變,主要包括DNA甲基化、組蛋白修飾、RNA修飾。前兩者的研究已較為成熟,RNA修飾盡管發現的較早,但由于技術的限制,近十年來才成為研究熱點。目前已有100多種RNA修飾被報道,其中m6A修飾是真核生物mRNA中最常見的內部修飾[3]。m6A修飾受甲基轉移酶、去甲基化酶和甲基化識別蛋白調控[4]。甲基轉移酶復合體由甲基轉移酶3(methyltransferase 3,METTL3)、甲基轉移酶 14(methyltransferase 14,METTL14)、WT1相關蛋白(WT1 associated protein,WTAP)、病毒樣m6A甲基相關轉移酶(vir like m6A methyltransferase associated,VIRMA)、鋅指CCCH結構域蛋白13(zinc finger CCCH-type containing 13,ZC3H13)和 RNA結合基序蛋白15(RNA binding motif protein 15,RBM15)組成,可使RNA上的堿基發生m6A甲基化修飾[5]。m6A去甲基化由肥胖相關蛋白(fat mass and obesity-associated protein,FTO)和烷基 B同系物5(alkB homolog 5,ALKBH5)兩種去甲基酶催化。含有YTH同源結構域的蛋白、胰島素樣生長因子2 mRNA結合蛋白1/2/3(insulin like growth factor 2 mRNA binding protein 1/2/3,IGF2BP1/2/3)和異質性核糖核蛋白A2/B1(heterogeneous nuclear ribonucleoprotein A2/B1,HNRNPA2B1)是 m6A 的“識別蛋白”,發揮促進m6A修飾的RNA剪接、翻譯、轉運、調節穩定性等作用[6]。m6A修飾在甲基化酶和去甲基化酶的作用下,對RNA的調控是動態可逆的過程,這種修飾的失調與包括惡性腫瘤在內的人類疾病密切相關。研究表明,在肝癌、胃癌、急性髓系白血病等腫瘤中,m6A調節因子的異常表達在腫瘤的發生、增殖及影響患者預后中都有著重要作用[7-9]。
2 m6A修飾在結直腸癌中的研究進展
2.1 METTL 3
METTL3是m6A甲基轉移酶中的重要亞單位,催化甲基從S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)轉移到目標mRNA腺嘌呤的N原子上,實現m6A甲基化[10]。METTL3促進腸癌細胞的增殖與糖酵解有著密切關系,從機制上有以下兩種方式:一是通過穩定大腸癌細胞中己糖激酶2(hexokinase 2,HK2)和葡萄糖轉運蛋白1(recombinant glucose transporter 1,GLUT1)的mRNA水平而發揮致癌基因的作用[11];二是通過影響GLUT1介導的葡萄糖代謝途徑激活雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)信號通路,加強了腸癌細胞的增殖能力[12]。METTL3對腸道腫瘤增殖的影響不僅僅在糖代謝途徑中體現,作用于MYC原癌基因(MYC proto-oncogene,MYC)也是其中重要的環節。MYC作為較早發現的一類基因,被證實在多種人類腫瘤中過表達。上調的METTL3通過增強MYC的表達促進大腸癌細胞的增殖和腫瘤的發生[13],在此過程中,MYC受METTL3/IGF2BP2 軸的調控[14]。此外,Zhu 等[15]發現METTL3的高表達可通過穩定細胞周期蛋白E1(cyclin E1,CCNE1)mRNA的表達促進結腸癌細胞的增殖。
METTL3促進腫瘤的發展還體現在它能提高腫瘤細胞的轉移能力,其中miRNA-1246/與EVH1結構域2相關的sprouty蛋白(sprouty related EVH1 domain containing 2,SPRED2)軸是METTL3發揮作用的重要信號通路[16]。METTL3介導的miRNA-1246上調負向調節SPRED2的表達,而SPRED2作為調節生長因子發揮抑癌基因的作用。作為主要的m6A編寫者,METTL3表達水平增高還可以抑制細胞因子信號2(suppressor of cytokine signaling 2,SOCS2)mRNA的表達,以維持結腸癌細胞中富含亮氨酸重復序列的G蛋白偶聯受體 5(leucine rich repeat containing G protein-coupled receptor 5,LGR5)表達水平,從而增強腸癌細胞的轉移能力[17]。由此可見METTL3可通過對RNA的不同作用維持腸癌細胞生長、增殖及轉移的腫瘤學特性。
2.2 METTL14
METTL14作為甲基轉移酶復合體的中心成分,已被證實其表達失調參與多種惡性腫瘤的發生和發展。與METTL3不同的是,多種研究表明,結直腸癌組織中METTL14表達明顯下調,METTL14更多的是作為抑癌基因調控腸癌的進展。METTL14在結直腸癌中調節RNA表達主要包括信使RNA、非編碼RNA以及miRNA。在信使RNA調節中,METTL14可以通過抑制癌基因轉錄,提高抑癌基因穩定性,抑制結直腸癌發展。SRY-盒轉錄因子4(SRY-box transcription factor 4,SOX4)是METTL4的下游靶基因,METTL14通過抑制SOX4基因參與的上皮-間充質轉化過程,降低腫瘤細胞的侵襲和遷移能力[18]。另一方面,METTL14/IGF2BP2/Kruppel樣因子 4(Kruppel like factor 4,KLF4)軸可以增加抑癌基因KLF4mRNA的穩定性進而抑制腸癌細胞轉移[19]。
m6A甲基化修飾不僅可以作用于信使RNA,非編碼RNA也是其作用靶點。X染色體失活特異性轉錄物(X inactive specific transcript,XIST)作為一種新發現的長鏈非編碼RNA(long noncoding RNA,lncRNA),在多種人體腫瘤中起致癌基因作用。在結直腸癌中,lncRNA XIST被確定為METTL14的下游靶點,一旦METTL14被敲除,XIST的m6A修飾水平被消除,XIST的表達增強。初步研究表明,METTL14可以通過下調致癌的lncRNA XIST來抑制大腸癌的增殖和轉移[20]。同樣,微小RNA的表達調控中也發現了METTL14的蹤影,METTL14通過miRNA-375/Yes相關蛋白1(Yes1 associated transcriptional regulator,YAP1)途徑抑制大腸癌細胞的生長,同時通過miRNA-375/Sp1轉錄因子(Sp1 transcription factor,SP1)途徑抑制大腸癌細胞的遷移和侵襲[21]。
此外,在細胞免疫方面,METTL14的研究也有了新進展。在腫瘤相關巨噬細胞(tumour-associated macrophage,TAM)中存在一類亞群C1q+TAM,其功能受METTL14/YTH N6-甲基腺苷RNA結合蛋白2(YTH N6-methyladenosine RNA binding protein 2,YTHDF2)軸的調節。C1q+TAM中METTL14缺乏可以抑制效應性CD8+T細胞的活化而促使CD8+T細胞功能失調最終導致機體清除腫瘤的能力受損。從機制上看,METTL14缺失的C1q+TAM細胞因子亞單位EB病毒誘導蛋白3(Epstein-Barr virus induced 3,EBI3)的m6A修飾水平降低,轉錄水平升高,誘導CD8+T細胞功能失調[22]。上述研究揭示了METTL4介導的不同途徑在大腸癌中的作用機制。
2.3 m6A識別蛋白
YTH家族包括YTHDF1/2/3、YTH結構域包含蛋白 1/2(YTH domain containing 1/2,YTHDC1/2),屬于m6A識別蛋白,能夠識別特定基序上的m6A修飾,控制修飾后的RNA加速降解、翻譯過程,提高穩定性等生物功能。
YTHDF1在結直腸癌中高表達,且其高表達與多種臨床特征相關,如腫瘤浸潤深度、淋巴結轉移、病理分期等。YTHDF1作為識別蛋白可以促進m6A修飾的frizzled類受體9(frizzled class receptor 9,FZD9)和 Wnt家族成員 6(Wnt family member 6,WNT6)mRNA的翻譯,導致其下游信號通路異常激活,該信號通路在腸癌細胞增殖、侵襲和轉移中都發揮了至關重要的作用[23]。對YTHDF1基因上游調控基因的研究發現,c-myc與其相關,通過基因敲除實驗證實,c-myc通過一種途徑誘導YTHDF1激活引起致癌效應[24]。
YTHDF3也被人們發現在結直腸癌中起到致癌基因的作用,YTHDF3與lncRNA生長抑制特異因子5(growth arrest specific 5,GAS5)及 YAP 形成環路相互調節,YTHDF3的異常高表達促進lncRNA GAS5降解最終導致腸癌的發生發展[25]。此外,Tanabe等[26]發現另一種m6A識別蛋白YTHDC2可增強缺氧誘導因子-1α(hypoxia-inducible factor-1α,HIF-1α)翻譯表達,進而促進上皮-間充質轉化,在結直腸癌的轉移中發揮重要作用。
IGF2BP家族也屬于m6A識別蛋白,并且發現它與已知的YTH結構域蛋白有著截然不同的功能。IGF2BP3通過誘導加快細胞周期來提高腸癌細胞在體內外的增殖能力[27],也可以誘導腸癌組織血管生成促使腸癌細胞轉移。從機制上看,一方面,IGF2BP3可以通過減緩G1/S期細胞周期蛋白D1(cyclin D1,CCND1)mRNA的降解提高細胞周期中S期細胞百分比,達到促進腫瘤細胞增殖的目的[28];另一方面,IGF2BP3通過與血管內皮生長因子(vascular endothelial growth factor,VEGF)的mRNA結合,調節VEGFmRNA的表達和穩定性從而促進腸癌細胞的侵襲轉移。
另一個IGF2BP家族成員IGF2BP2被發現與YAP和erb-b2受體酪氨酸激酶2(erb-b2 receptor tyrosine kinase 2,ERBB2)之間存在相互調節的關系。在該研究尚未發現之前,YAP通過調控細胞周期相關途徑促進了腫瘤細胞異常增殖的結論已經達成共識。此研究發現IGF2BP2可以通過識別YAPmRNA來激活ERBB2的表達,從而調控腸癌細胞的細胞周期,促進其異常增殖[29]。此外,IGF2BP2與lncRNA結合形成復合物,該復合物能與高遷移率族蛋 白 1(high mobility group AT-hook 1,HMGA1)mRNA結合以增強HMGA1mRNA的穩定性[30],進而促進結直腸癌細胞的增殖、遷移和侵襲。
2.4 m6A去甲基化酶
FTO作為去甲基化酶可以將m6A脫甲基生成N6-羥甲基腺苷和N6-甲酰腺苷。有研究提出,FTO中的單核苷酸多態性可能與脂肪因子相互作用,從而提高結直腸癌的發生風險[31]。在腸癌細胞中,FTO通過阻斷MYC基因m6A的修飾來提高MYC的表達,增強腸癌細胞的增殖和遷移功能。FTO自身的表達受AMP活化蛋白激酶α2(adenosine monophosphate-activated protein kinase alpha 2,AMPKα2)的調控。AMPKα2通過下調腫瘤細胞代謝阻礙腸癌細胞的增殖,能夠靶向作用于FTO并抑制其表達。FTO通過參與AMPKα2/FTO/m6A/MYC軸促進腫瘤發生[32]。ALKBH5是第二種已鑒定的m6A去甲基化酶,是一種FTO同系物,可以將m6A直接氧化成腺苷。據報道,ALKBH5的缺失使腫瘤對腫瘤免疫療法敏感,該基因敲除顯著抑制了腫瘤生長并提高免疫治療期間小鼠的存活率,并通過實驗證實ALKBH5的抑制劑可增強抗程序性死亡受體 1(programmed cell death 1,PDCD1,也稱PD-1)療法的功效[33]。
以上m6A調節因子在結直腸癌中的作用有多方面,在此進行總結,詳見表1。
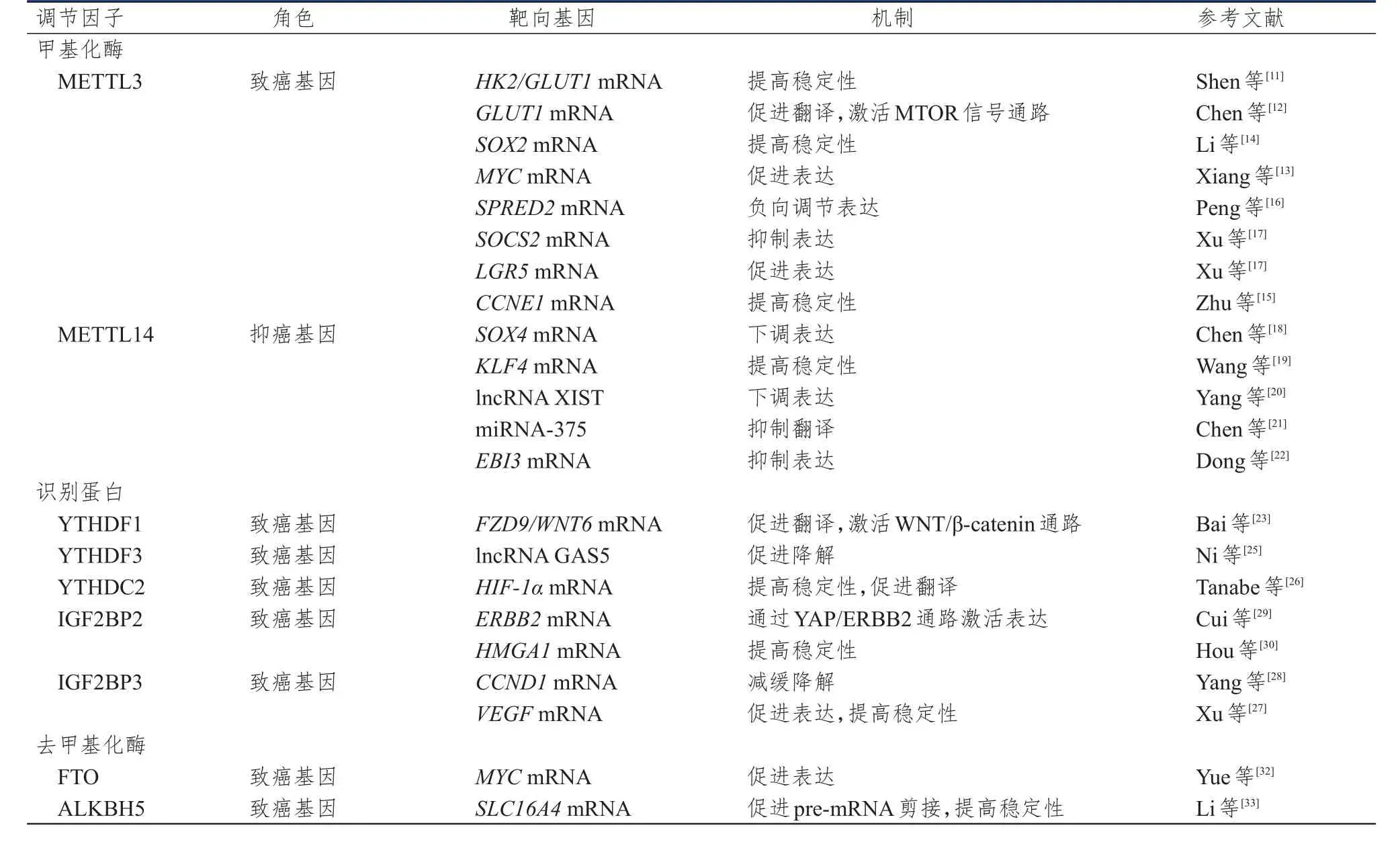
表1 m6A調節因子在結直腸癌中的作用
3 小結和展望
m6A調節因子在結直腸癌中發揮著致癌基因或者抑癌基因的作用,其失調通過介導下游靶基因表達異常在腫瘤發生、發展中扮演著至關重要的角色。盡管對于結直腸癌患者的治療已經有了較大的進展,但是早發現、早治療以及提高患者遠期療效都是永恒不變的話題。在治療方面,抑制部分m6A調節因子能增強結直腸癌對PD-1/程序性死亡受體配體 1(programmed cell death 1 ligand 1,PDCD1LG1,也稱PD-L1)腫瘤免疫療法的反應[34],這為后續靶向藥物的研究提供了新的理論依據。此外,還發現MYC基因在m6A修飾中出現頻率較高,涉及酶類較多,這或許為未來對結直腸癌的診治提供一種新的治療策略。將m6A修飾的研究轉換為臨床應用仍有很長的路要走,但這并不妨礙m6A修飾在結直腸癌的診斷和治療上有著極好的應用前景。

