免疫學(xué)指標(biāo)、炎性因子聯(lián)合臨床特征對(duì)卵巢癌患者預(yù)后的預(yù)測(cè)價(jià)值
崔嬌姣,周鵬翔,高翠紅
卵巢具有排卵、內(nèi)分泌及維持女性體內(nèi)激素水平穩(wěn)定的功能,其結(jié)構(gòu)復(fù)雜,是女性易患腫瘤的高危部位[1-2]。有文獻(xiàn)報(bào)道,卵巢癌的病死率占婦科惡性腫瘤之首[3]。由于卵巢解剖部位較隱蔽,加上早期并無(wú)明顯臨床癥狀,致早期診斷困難,發(fā)病時(shí)大部分患者已處于晚期,患者生存率較低[4]。雖然進(jìn)行較理想的減瘤手術(shù)聯(lián)合系統(tǒng)性的化療可使大部分患者達(dá)到臨床緩解,但部分患者仍會(huì)復(fù)發(fā),預(yù)后較差[5]。機(jī)體的免疫狀態(tài)變化情況與腫瘤的發(fā)生密切相關(guān),近年來(lái)研究顯示,腫瘤患者往往都有嚴(yán)重的免疫抑制甚至免疫缺失[6]。各種炎性因子、炎癥反應(yīng)物和抗炎因子常被用來(lái)預(yù)測(cè)腫瘤的嚴(yán)重程度。因此免疫學(xué)指標(biāo)、炎性因子對(duì)卵巢癌的預(yù)后有重要意義[7]。本研究回顧性分析我院134例卵巢癌患者的預(yù)后,探究免疫學(xué)指標(biāo)、炎性因子聯(lián)合臨床特征預(yù)測(cè)卵巢癌患者預(yù)后的價(jià)值。現(xiàn)報(bào)告如下。
1 資料與方法
1.1臨床資料 回顧性分析我院2018年3月—2019年3月收治的卵巢癌134例的臨床資料。納入標(biāo)準(zhǔn):符合《卵巢惡性腫瘤診斷與治療指南(第四版)》[8]中卵巢癌診斷標(biāo)準(zhǔn),且經(jīng)病理活檢證實(shí);非復(fù)發(fā)性卵巢癌患者;年齡≥18歲;病例資料完整者。排除標(biāo)準(zhǔn):合并其他惡性腫瘤者;不耐受化療者;伴認(rèn)知功能障礙或精神病史;患者依從性較差,未按規(guī)定完成治療方案者。根據(jù)隨訪2年內(nèi)是否發(fā)生死亡將患者分為預(yù)后不良組32例和預(yù)后良好組102例。本研究經(jīng)我院倫理委員會(huì)批準(zhǔn)(批號(hào)2020-2號(hào))。
1.2方法
1.2.1資料收集:收集2組入院時(shí)年齡、體質(zhì)量指數(shù)、吸煙(連續(xù)或累計(jì)吸煙6個(gè)月或以上)、飲酒(每周飲酒至少1次,每次乙醇量>40 g,連續(xù)飲酒半年以上)、高血壓病(符合《中國(guó)高血壓防治指南(2010年修訂版)》[9]診斷標(biāo)準(zhǔn))、糖尿病(符合《中國(guó)2型糖尿病防治指南(2017年版)》[10]診斷標(biāo)準(zhǔn))、血脂異常(符合《中國(guó)成人血脂異常防治指南》[11]診斷標(biāo)準(zhǔn))、肺栓塞、惡性腹水、妊娠次數(shù)、流產(chǎn)次數(shù)、病理分期、組織學(xué)分級(jí)、CD4+、CD8+、CD4+/CD8+、白細(xì)胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)、C反應(yīng)蛋白(CRP)。
1.2.2病理分期標(biāo)準(zhǔn):將卵巢癌患者分為Ⅰ~Ⅳ期,其中Ⅰ期:腫瘤細(xì)胞只局限在卵巢,無(wú)其他任何部位轉(zhuǎn)移;Ⅱ期:腫瘤細(xì)胞累及卵巢一側(cè)或兩側(cè),同時(shí)已伴有盆腔內(nèi)部擴(kuò)散;Ⅲ期:腫瘤細(xì)胞侵犯整個(gè)卵巢,并伴隨局部淋巴結(jié)轉(zhuǎn)移或盆腔外腹膜種植;Ⅳ期:腫瘤細(xì)胞侵犯整個(gè)卵巢,并伴隨遠(yuǎn)處轉(zhuǎn)移。
1.3檢測(cè)指標(biāo) 取患者靜脈血5 ml,測(cè)定T淋巴細(xì)胞亞群CD4+、CD8+,并計(jì)算CD4+/CD8+,檢測(cè)IL-6、TNF-α、CRP水平。

2 結(jié)果
2.1卵巢癌患者預(yù)后不良的單因素分析 預(yù)后不良組年齡≥60歲、病理分期Ⅲ~Ⅳ期、組織學(xué)分級(jí)低分化患者及CD8+、IL-6、TNF-α、CRP水平高于預(yù)后良好組,CD4+、CD4+/CD8+水平低于預(yù)后良好組(P<0.01)。
2.2卵巢癌患者預(yù)后不良的多因素Logistic回歸分析 取有差異因素中位值作為截?cái)嘀担⑸鲜龃嬖诓町惖囊蛩丶{入Logistic回歸分析模型,行量化賦值,年齡:<60歲=0,≥60歲=1;病理分期:Ⅰ~Ⅱ期=0,Ⅲ~Ⅳ期=1;組織學(xué)分級(jí):中、高分化=0,低分化=1;CD4+:≥35%=0,<35%=1;CD8+:<32%=0,≥32%=1;CD4+/CD8+:≥1.1=0,<1.1=1;IL-6:<24 mg/L=0,≥24 mg/L=1;TNF-α:<28 mg/L=0,≥28 mg/L=1;CRP:<21 mg/L=0,≥21 mg/L=1;預(yù)后不良:否=0,是=1。結(jié)果顯示,年齡≥60歲、病理分期Ⅲ~Ⅳ期、低分化、CD4+<35%、CD8+≥32%、CD4+/CD8+<1.1、IL-6≥24 mg/L、TNF-α≥28 mg/L、CRP≥21 mg/L是卵巢癌患者預(yù)后不良的獨(dú)立影響因素(P<0.01)。見(jiàn)表1。
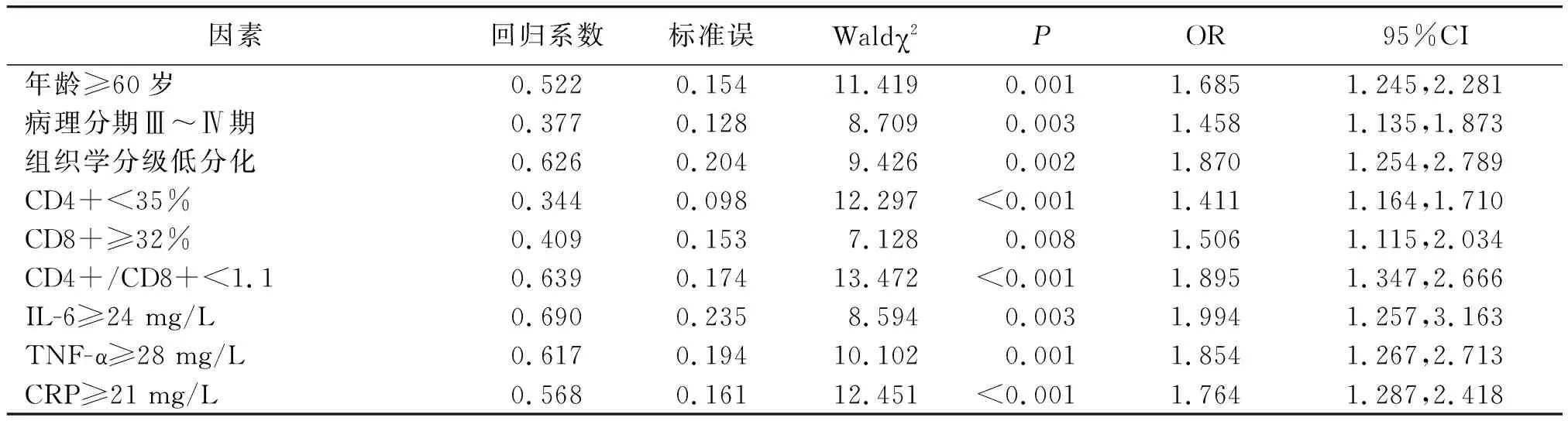
表1 卵巢癌患者預(yù)后不良的多因素Logistic回歸分析
3 討論
卵巢癌治療效果差,目前的主要治療方式是手術(shù)和化療,但晚期患者,術(shù)后5年生存率低且術(shù)后仍有大部分患者復(fù)發(fā),且化療藥物的毒副反應(yīng)、化療所產(chǎn)生的耐藥反應(yīng)都會(huì)導(dǎo)致卵巢癌預(yù)后效果較差[12]。卵巢癌的預(yù)后受多種因素影響,其中術(shù)后腫瘤殘余灶大小和化療敏感性是當(dāng)前國(guó)內(nèi)外公認(rèn)的最有效的臨床預(yù)后指標(biāo),但術(shù)后殘余灶大小受術(shù)者的熟練程度及手術(shù)難度影響,而化療敏感性往往需要術(shù)后數(shù)月才能做出評(píng)價(jià),難以有效預(yù)測(cè)卵巢癌患者預(yù)后[13]。因此,尋找能夠準(zhǔn)確有效預(yù)測(cè)卵巢癌患者預(yù)后的生化標(biāo)志物已成為臨床研究的重點(diǎn)。
本研究結(jié)果顯示,預(yù)后不良組年齡≥60歲、病理分期Ⅲ~Ⅳ期、組織學(xué)分級(jí)低分化患者占比高于預(yù)后良好組,提示上述因素可能是卵巢癌患者預(yù)后不良的危險(xiǎn)因素。分析原因:年齡較大患者的機(jī)體狀況較差,免疫能力較低,對(duì)疾病的抵抗性較差,同時(shí)老年患者對(duì)化療的耐受性較差,導(dǎo)致老年患者預(yù)后較差。臨床分期Ⅲ~Ⅳ期的患者,腫瘤細(xì)胞侵犯整個(gè)卵巢,并向盆腔外腹膜甚至遠(yuǎn)處轉(zhuǎn)移,此時(shí)患者體內(nèi)的腫瘤細(xì)胞難以控制,破壞相鄰的正常器官和組織,影響患者預(yù)后[14]。低分化的腫瘤細(xì)胞分裂活性高,患者預(yù)后更差。與穆翔等[15]報(bào)道相符。
本研究結(jié)果顯示,預(yù)后不良組CD8+水平高于預(yù)后良好組,CD4+、CD4+/CD8+水平低于預(yù)后良好組,分析原因:CD4+/CD8+可在一定程度反映機(jī)體的免疫功能,當(dāng)腫瘤細(xì)胞累及淋巴系統(tǒng)時(shí),腫瘤細(xì)胞與淋巴系統(tǒng)廣泛密切接觸,導(dǎo)致CD4+水平不斷降低、CD8+水平不斷升高,CD4+/CD8+的動(dòng)態(tài)平衡被打破,患者病灶局部浸潤(rùn)淋巴細(xì)胞數(shù)目變少,且周?chē)褐辛馨图?xì)胞的數(shù)目也變小,使機(jī)體的免疫功能紊亂及免疫失調(diào),削弱了機(jī)體對(duì)抗腫瘤細(xì)胞的能力,導(dǎo)致患者預(yù)后變差。趙艷勛等[16]研究發(fā)現(xiàn),卵巢癌患者臨床分期越高,CD4+/CD8+值越低,機(jī)體的免疫功能損傷越嚴(yán)重,本研究結(jié)果與文獻(xiàn)報(bào)道相符。本研究中預(yù)后不良組患者IL-6、TNF-α、CRP水平高于預(yù)后良好組。其原因?yàn)橛捎跈C(jī)體腫瘤細(xì)胞的快速轉(zhuǎn)移,IL-6通過(guò)增殖來(lái)調(diào)節(jié)B細(xì)胞的增殖與分化,從而促進(jìn)T細(xì)胞的增殖,調(diào)節(jié)免疫應(yīng)答與急性期反應(yīng)[17]。當(dāng)腫瘤細(xì)胞擴(kuò)散時(shí),TNF-α促進(jìn)炎性細(xì)胞的擴(kuò)散,引起組織損傷并激活其參與修復(fù)。腫瘤感染的急性期會(huì)引起CRP升高,持續(xù)的炎癥且無(wú)好轉(zhuǎn)或嚴(yán)重程度加重會(huì)導(dǎo)致CRP的持續(xù)升高。崔彭華等[18]報(bào)道,隨著卵巢癌患者的病情惡化,其炎癥反應(yīng)也更加強(qiáng)烈,本研究與其報(bào)道一致。
經(jīng)多因素Logistic回歸分析證實(shí),年齡≥60歲、病理分期Ⅲ~Ⅳ期、組織學(xué)分級(jí)低分化以及CD4+、CD8+、CD4+/CD8+、IL-6、TNF-α、CRP水平是卵巢癌患者預(yù)后不良的危險(xiǎn)因素。
綜上所述,免疫學(xué)指標(biāo)、炎性因子聯(lián)合臨床特征對(duì)卵巢癌患者預(yù)后具有良好的預(yù)測(cè)價(jià)值,臨床對(duì)卵巢癌患者進(jìn)行治療時(shí)應(yīng)對(duì)上述指標(biāo)密切關(guān)注,并及時(shí)進(jìn)行干預(yù),以改善患者預(yù)后。
- 解放軍醫(yī)藥雜志的其它文章
- 乳腺癌新輔助化療后行前哨淋巴結(jié)活檢的研究進(jìn)展
- 腹腔鏡輸尿管切開(kāi)取石術(shù)聯(lián)合金錢(qián)草顆粒治療腎盂分離、結(jié)石嵌頓輸尿管上段結(jié)石的臨床效果
- 中西醫(yī)結(jié)合治療急性腦梗死氣虛血瘀證臨床效果
- 替羅非班治療超時(shí)間窗急性后循環(huán)腦卒中效果及對(duì)炎性因子、凝血功能的影響
- 右美托咪定對(duì)非體外循環(huán)冠狀動(dòng)脈旁路移植術(shù)患者心肌的保護(hù)作用
- 依帕司他聯(lián)合胰激肽原酶治療2型糖尿病周?chē)窠?jīng)病變臨床效果及對(duì)炎性因子、肌電圖指標(biāo)的影響

