血管緊張素Ⅱ通過Raf/MEK/ERK通路對PDGF誘導的氣道上皮細胞轉分化的影響
楊丹芬 謝圓媛 康睿
支氣管哮喘是危害人類生命健康的慢性呼吸道疾病,具有較高的發病率[1]。目前研究發現,氣道重構是導致哮喘患者肺功能下降及哮喘癥狀反復發作的主要原因之一[2]。探尋氣道重構及控制氣道纖維化改變進程的調控機制,也是目前臨床研究的重點任務之一[3]。大量文獻研究發現,氣道上皮細胞結構及功能改變是引起氣道重構的關鍵環節[4],且氣道上皮細胞間質-轉分化(epithelial mesenchyme-transdifferentiation,EMT)進程也被認為是哮喘患者氣道重構及纖維化發生演變的重要機制[5]。但氣道上皮細胞EMT進程的分子生物學機制還不甚明確。近來研究發現,加速纖維肉瘤蛋白(rapidly accelerate fibrosarcoma protein,Raf)/絲裂原活化的細胞外信號調節激酶(mitogen activated extracellular signal regulated kinase,MEK)/細胞外信號調節激酶(extracellular signal regulated kinase,ERK)信號通路可調控細胞增殖、生長及分化過程[6],且能調控多種通路與大腸、腎小管、甲狀腺等多種組織上皮細胞及癌細胞EMT進程[7]。但Raf/MEK/ERK通路在支氣管哮喘氣道上皮細胞EMT進程中的調控機制,研究較少。另外,又有研究報道,血管緊張素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)在支氣管哮喘患者血清中分泌較高,且與患者氣道炎癥及氣道重構關系密切[8],但Ang Ⅱ調控氣道重構的具體機制還不甚明確。研究證實,Ang Ⅱ能通過Raf/ERK通路影響并促進肝癌細胞增殖[9],且能介導肝癌上皮細胞EMT進程[10]。Ang Ⅱ能否通過Raf/MEK/ERK途徑介導氣道上皮細胞EMT進程,參與支氣管哮喘氣道重構過程,筆者還未見報道。本研究體外培養并以血小板源生長因子(platelet-derived growth factor,PDGF)誘導氣道上皮細胞,給予Ang Ⅱ處理,探究其轉分化過程的分子機制,以期闡明Ang Ⅱ在支氣管哮喘氣道重構過程的調節機制,為支氣管哮喘的臨床治療提供參考。
1 材料與方法
1.1 細胞及主要試劑與儀器 人氣道上皮細胞株16 HBE(購自上海康朗生物科技有限公司,貨號:KLH1041);血管緊張素Ⅱ(購自上海經科化學科技有限公司,貨號:JKLN002722,規格:10 mg);重組人血小板源生長因子(PDGF)(購自美國sigma公司,凍干粉,臨用前用無菌去離子水溶解,貨號:BRP145,規格:50 μg);Raf/MEK/ERK通路抑制劑(索拉菲尼,sorafenib)(購自美國selleck公司,貨號:S1040,規格:10 mg);兔抗人E-粘鈣素(E-cadherin)、α-平滑肌肌動蛋白(α-SMA)、波形蛋白(vimentin)、纖維連接蛋白(FN)、膠原蛋白Ⅳ(ColⅣ)、Raf、MEK1及磷酸化MEK(p-MEK1)、ERK1及磷酸化ERK1(p-ERK1)、轉化生長因子β1(TGF-β1)等抗體(均購自美國abcam公司,貨號:ab407720、ab108424、ab92547、ab174833、ab34710、ab200653、ab32091、ab96379、ab32537、ab131438、ab215715);倒置顯微鏡(購自日本奧林巴斯,型號:CKX53)。
1.2 方法
1.2.1 細胞培養:16-HBE人氣道上皮細胞株常規復蘇后,用含10%胎牛血清的DMEM培養基于恒溫培養箱中貼壁培養,待細胞生長到70%~80%時,用胰蛋白酶進行消化傳代計數。
1.2.2 細胞分組處理:取生長到70%~80%的細胞,消化傳代后,按1×105個/孔密度接種于六孔板中,進行以下分組處理:(1)分為對照組、PDGF[11]不同濃度刺激組(5、25、50、100、200 ng/L),24 h后,用免疫熒光法檢測各組細胞中vimentin陽性表達水平,篩選出PDGF合適濃度。(2)分為正常對照組、PDGF誘導組(100 ng/L)、Ang Ⅱ[12]不同濃度組(10-7、10-6、10-5mol/L)組,各組均培養24 h后置于倒置顯微鏡下觀察細胞EMT形態,并用WB法檢測EMT間質轉化相關蛋白及Raf/MEK/ERK通路蛋白表達。(3)分為正常對照組、PDGF誘導組、Ang Ⅱ組(10-6mol/L)、Raf/MEK/ERK通路抑制劑(sorafenib)[9]組(10 μmol/L)、Ang Ⅱ+sorafenib(10-6mol/L+10 μmol/L)組,各組均培養24 h后置于倒置顯微鏡下觀察細胞EMT形態,并用WB法檢測Raf/MEK/ERK通路蛋白表達。
1.2.3 免疫熒光染色法檢測細胞vimentin陽性表達水平:取細胞,參照文獻[13]加入丙酮固定、 0.5% 曲拉通(Triton X-100)室溫透化、5% 牛蛋白血清封閉后,加入vimentin一抗抗體(1∶50)孵育過夜,再用Alexa Fluor594紅色熒光標記的羊抗兔 IgG二抗孵育,用DAPI避光染核,防猝滅液封片后于激光共聚焦顯微鏡下觀察,拍照,隨機選6個,對vimentin陽性表達細胞數目進行計數。
1.2.4 倒置顯微鏡觀察細胞形態:取各組細胞,置于倒置顯微鏡下觀察細胞形態。
1.2.5 Western blotting檢測各組細胞E-cadherin、α-SMA、vimentin、FN、ColⅣ、Raf、MEK、p-MEK、ERK、p-ERK、TGF-β1蛋白相對表達水平:取各組細胞,吸干培養液,用磷酸緩沖液反復清洗后,用蛋白裂解液裂解于冰上裂解20 min后,在4℃、1 000 r/min、10 min條件下離心并取上清液,用BCA法測定蛋白濃度后,取50 μg蛋白樣品行上樣及電泳分離后,加入一抗(E-cadherin、α-SMA、vimentin、FN、ColⅣ、Raf、MEK、p-MEK、ERK、p-ERK、TGF-β1抗體,稀釋倍數均為1∶1 000,抗體GAPDH(內參)1∶2 000],于4℃冰箱內孵育過夜,加入二抗HRP(1∶3 000)孵育2 h,化學發光法顯影后成像并用分析系統下拍照、分析灰度值。每組試驗重復3次。

2 結果
2.1 不同濃度PDGF對人氣道上皮細胞vimentin表達的影響 與對照組比較,隨著PDGF濃度升高,vimentin紅色熒光在胞漿著色逐漸增加,細胞vimentin陽性表達升高,并在100~200 ng/L時上升至穩定水平,其中PDGF濃度25、50、100、200 ng/L時vimentin陽性表達與對照組比較差異有統計學意義(P<0.05)。PDGF濃度100 ng/L與200 ng/L比較,差異無統計學意義(P<0.05),選用PDGF濃度為100 ng/L為誘導濃度。見表1。

表1 PDGF處理后6組vimentin陽性細胞數目比較
2.2 Ang Ⅱ不同濃度處理后對細胞EMT形態變化的影響 倒置顯微鏡下觀察,正常對照組細胞呈鋪路石樣狀態,細胞間緊密連接且稍凸起。PDGF誘導組細胞間連接減少,排列不規則,細胞肥大、呈長梭形、星形或多角形樣類似成纖維細胞樣形態改變。隨著Ang Ⅱ濃度升高,細胞肥大、呈長梭形、星形或多角形樣改變進一步加重,且Ang Ⅱ濃度10-6mol/L與10-5mol/L濃度細胞形態向接近。見圖1。
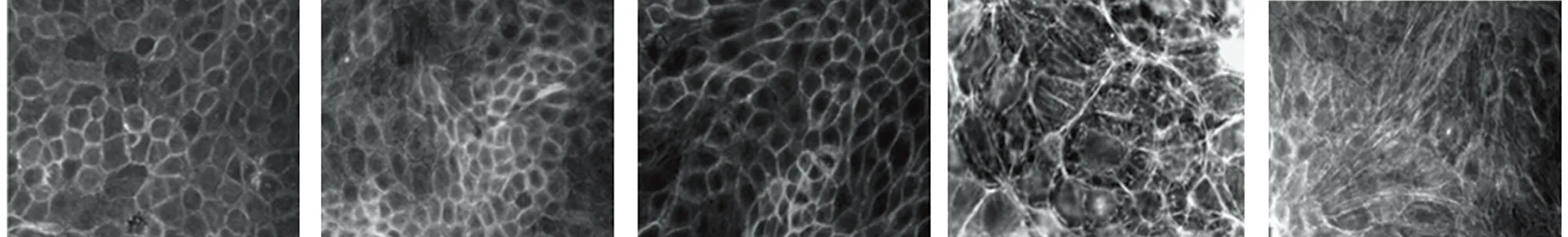
2.3 Ang Ⅱ不同濃度處理后對細胞E-cadherin、α-SMA、vimentin、FN、ColⅣ蛋白表達的影響 與正常對照組比較,PDGF誘導組E-cadherin表達降低,α-SMA、vimentin、FN、ColⅣ蛋白表達升高,差異均有統計學意義(P<0.05)。與PDGF誘導組比較,Ang Ⅱ不同濃度處理組E-cadherin表達進一步降低(P<0.05),α-SMA、vimentin、FN、ColⅣ蛋白表達進一步升高(P<0.05),且Ang Ⅱ濃度10-6mol/L組及10-5mol/L濃度組上述指標變化優于10-7mol/L組,差異有統計學意義(P<0.05)。Ang Ⅱ濃度10-6mol/L組與10-5mol/L濃度組比較差異無統計學意義(P>0.05)。見表2,圖2。

表2 5組細胞E-cadherin、α-SMA、vimentin、FN、ColⅣ蛋白表達水平比較

圖2 5組細胞E-cadherin、α-SMA、vimentin、FN、ColⅣ蛋白表達免疫印跡;A 正常對照組;B PDGF誘導組;C Ang Ⅱ濃度10-7mol/L組;D Ang Ⅱ濃度10-6mol/L組;E Ang Ⅱ濃度10-5mol/L組
2.4 Ang Ⅱ不同濃度處理后對細胞Raf/MEK/ERK通路蛋白表達的影響 與正常對照組比較,PDGF誘導組Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達升高(P<0.05)。與PDGF誘導組比較,Ang Ⅱ不同濃度處理組Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達進一步升高(P<0.05),且Ang Ⅱ濃度10-6mol/L組及10-5mol/L濃度組上述指標變化優于10-7mol/L組,Ang Ⅱ濃度10-6mol/L組與10-5mol/L濃度組比較差異無統計學意義(P>0.05)。見圖3,表3。

圖3 5組細胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達免疫印跡;A 正常對照組;B PDGF誘導組;C Ang Ⅱ濃度10-7mol/L組;D Ang Ⅱ濃度10-6mol/L組;E Ang Ⅱ濃度10-5mol/L組
表3 5組細胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達水平比較
2.5 Ang Ⅱ與sorafenib聯合應用對細胞EMT形態的影響 倒置顯微鏡下觀察,正常對照組細胞呈鋪路石樣狀態且細胞間緊密連接較好。PDGF誘導組細胞間連接減少,細胞肥大、呈長梭形、星形或多角形樣改變較多。與PDGF誘導組比較,Ang Ⅱ組細胞肥大、呈長梭形、星形或多角形樣改變進一步加重,sorafenib組細胞長梭形、星形或多角形樣改變減少,鋪路石樣改變較多,細胞間緊密連接較好。Ang Ⅱ+Sorafenib組細胞肥大、呈長梭形、星形或多角形樣改變與PDGF誘導組接近,較Ang Ⅱ組加重。見圖4。

2.6 Ang Ⅱ與sorafenib聯合應用對細胞Raf/MEK/ERK通路蛋白表達的影響 與正常對照組比較,PDGF誘導組Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達升高(P<0.05)。與PDGF誘導組比較,Ang Ⅱ組Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達進一步升高(P<0.05),sorafenib組Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達降低,差異有統計學意義(P<0.05)。Ang Ⅱ+Sorafenib組上述指標變化與Ang Ⅱ組相反,且差異有統計學意義(P<0.05)。見表4,圖5。
表4 5組細胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達水平比較

圖5 5組細胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表達免疫印跡;A 正常對照組;B PDGF誘導組;C Ang Ⅱ濃度10-7mol/L組;D Ang Ⅱ濃度10-6mol/L組;E Ang Ⅱ濃度10-5mol/L組
3 討論
據世界流行病學分析,預計到2025年全世界支氣管哮喘患者將達3億[1]。支氣管哮喘病因及發病機制一直是醫學界研究的重點,而氣道重構被認為是引起支氣管哮喘患者通氣功能障礙、氣道反應性增高及哮喘癥狀控制不佳的重要原因[2]。探索支氣管哮喘的病理改變機制,是目前哮喘防治的重要方向。
研究證實,哮喘患者氣道損傷修復過程中,氣道上皮細胞EMT過程與氣道重構關系密切。魏盼等[14]結合前人研究發現作為氣道第一屏障的上皮細胞,可分泌多種因子如TGF-β1,并通過多種信號通路誘發EMT,引起細胞外基質沉積、上皮纖維化、平滑肌增生與遷移等導致氣道壁結構增厚,參與哮喘氣道重構過程。Zou等[15,16]發現氣道上皮、平滑肌等多種細胞均可分泌PDGF等細胞因子,并引起氣道上皮細胞EMT及遷移、氣道膠原合成、氣道壁增厚,加重哮喘的發作,并認為PDGF是介導哮喘氣道重構的免疫調節因子。本研究用不同濃度PDGF誘導培養人正常氣道上皮細胞發現,隨著PDGF濃度升高,EMT標志物vimentin陽性表達顯著升高,并在100~200 ng/L時達到穩定,且與正常氣道上皮細胞比較,100 ng/L濃度的PDGF誘導組細胞出現不規則、肥大、梭形等成纖維細胞樣改變,提示PDGF可誘導氣道上皮細胞EMT進程。另外研究證實,細胞EMT過程中會由上皮表型細胞樣轉變為成纖維間質細胞樣(特征為E-cadherin表達降低,α-SMA、vimentin表達升高,FN及ColⅣ沉積增加)[17]。本研究也檢測到PDGF誘導組出現E-cadherin表達降低,α-SMA及vimentin表達升高、FN及ColⅣ沉積增加,進一步證實PDGF誘導氣道上皮細胞EMT模型造模成功。
近來研究報道,Ang Ⅱ在支氣管哮喘氣道重構過程中發揮重要作用。Magalhaes等[8,18]發現在支氣管哮喘患者血清中Ang Ⅱ呈異常高表達水平,并認為Ang Ⅱ高表達與哮喘氣道高反應狀態及氣道重構有一定的相關性。另外,Ang Ⅱ也與腎、肝、肺等組織上皮細胞EMT關系密切。陳毅華等[10,19]證實Ang Ⅱ可誘導肝及腎上皮細胞EMT轉分化進程。本研究用不同濃度的Ang Ⅱ干預培養人氣道上皮細胞,發現,隨著Ang Ⅱ濃度升高,細胞不規則、肥大、梭形等成纖維細胞樣改變進一步加重,E-cadherin表達進一步降低,α-SMA及vimentin表達、FN及ColⅣ沉積進一步增加,提示Ang Ⅱ升高也可促進人氣道上皮細胞EMT進程,這可能為Ang Ⅱ參與支氣管哮喘患者氣道重構的可能機制之一。
TGF-β1被認為是誘導氣道上皮細胞EMT轉分化的經典通路之一[14]。Itoigawa等[20]證實TGF-β1可通過絲裂原活化蛋白激酶(MAPK)、細胞信號轉導分子(Smad)等信號通路激活EMT相關標志物Vimentin、N-cadherin、α-SMA等轉錄及表達,促進哮喘患者氣道重構過程。Rudzka等[21,22]證實MAPK可通過Raf即MAPK激酶的激酶(MAPKKK)、MEK、ERK完成三級激酶級聯磷酸化介導細胞增殖凋亡,且TGF-β1刺激胞膜并與胞膜受體結合后,能夠引起Ras/MEK/ERK相繼激活介導Smad3/α-SMA通路的纖維化進程,預示TGF-β1介導EMT及氣道重構的過程可能離不開Ras/MEK/ERK通路參與。本研究在PDGF誘導的氣道上皮細胞EMT過程中,發現TGF-β1升高的同時,伴隨著Ras、p-MEK/MEK、p-ERK/ERK表達的升高,而用sorafenib抑制Raf/MEK/ERK通路活化后,隨著Ras、p-MEK/MEK、p-ERK/ERK表達的降低,TGF-β1表達也隨之降低,且EMT相關標志物α-SMA及vimentin表達、FN及ColⅣ沉積表達也顯著降低,細胞不規則、肥大、梭形等成纖維細胞樣形態改變也隨之減輕,證實Raf/MEK/ERK通路活化可能是TGF-β1介導氣道上皮細胞EMT及氣道重構過程中的關鍵通路,阻斷Raf/MEK/ERK通路活化可抑制氣道上皮細胞EMT進程。本研究還觀察到Ang Ⅱ可進一步促進氣道上皮細胞EMT進程及Raf/MEK/ERK通路進一步活化,這一作用可被Raf/MEK/ERK通路抑制劑sorafenib逆轉,提示Ang Ⅱ可能通過促進Raf/MEK/ERK通路活化,促進氣道上皮細胞EMT。
綜上所述,Ang Ⅱ可通過激活Raf/MEK/ERK通路表達,促進氣道上皮細胞EMT,可能為闡明哮喘患者氣道重構的分子生物學機制提供一定理論依據,但氣道上皮細胞EMT轉分化及氣道重構的分子機制復雜且途徑較多,有待進一步探究。

