用于吸附水中硫酸根的聚吡咯改性活性炭制備及再生工藝條件優化研究
王東升,張峰,解立國,崔建國
(1.太原理工大學 環境科學與工程學院,山西 晉中 030600;2.太原市城市排水管理中心,山西 太原 030006)

利用聚吡咯(PPy)的離子交換功能對活性炭改性可去除水中陰離子[3-4]。摻雜苯磺酸根后的PPy有助于層流生長為緊湊和有序的形態[5]。具有緩沖能力的NH3·H2O其脫附能力較少被考察[6]。PPy上帶正電荷的氮被電子攻擊后呈電中性[3-4],故易提供電子的還原性物質[7],也可能使PPy還原再生。

1 實驗部分
1.1 材料與儀器
吡咯、三氯化鐵、無水硫酸鈉、氫氧化鈉、鹽酸、苯磺酸鈉、十二烷基苯磺酸鈉、碳酸氫鈉、無水碳酸鈉、氨水、甲酸、無水亞硫酸鈉、甲醇均為分析純;木質凈水用活性炭,購買于承德。
CIC-D120型離子色譜儀;TENSOR27型傅里葉變換紅外光譜儀;JSM-7100F型掃描電子顯微鏡;THZ-82B型數顯恒溫振蕩器;HJ-6A型六聯數顯控溫磁力攪拌器;FE28型精密pH計;DHG9070-B型智能型電熱恒溫鼓風干燥箱;SB-5200DT型超聲波清洗機;DZF-6020A型真空干燥箱。
1.2 改性活性炭的制備
選取16~20目的GAC,將GAC用去離子水沖洗多次后,在真空干燥箱中55 ℃下干燥24 h至恒重。利用先前研究Py和FeCl3·6H2O為1∶3的配比進行BSNa摻雜制備。稱取2.5 g干燥后的GAC投加至密閉玻璃瓶中,將50 mL 1 mol/L的Py加入玻璃瓶中密封,將玻璃瓶放入恒溫振蕩器中于常溫25 ℃ 180 r/min下振蕩12 h。將上清液棄掉后,投加50 mL 1.5 mol/L的FeCl3·6H2O,25 ℃下振蕩氧化一定時間向混合液中投加一定量的BSNa,繼續振蕩3 h。振蕩結束后,將改性活性炭取出后放入載有濾紙的漏斗中,采用(去離子水-無水乙醇-去離子水)的順序沖洗3次后放入真空干燥箱中,55 ℃下真空干燥24 h。將真空干燥后的改性活性炭放入密封瓶中充氮氣,低溫、黑暗下保存。
為表達方便,文中改性活性炭(Py-FeCl3·6H2O-BSNa-GAC)縮寫為PFB-GAC;Py和FeCl3·6H2O的摩爾比為P∶F。
1.3 吸附實驗

平衡吸附量qe(mg/g)的計算式為:
(1)
吸附容量qt(mg/g)在不同接觸時間t(min)的計算式為:
(2)

mads=0.2×qe
(3)
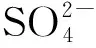
V——溶液體積,mL;
ms——吸附劑的干重,g。
1.4 脫附再生實驗


mi=Ci×V
(4)
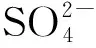
V——投加再生液體積,mL。
脫附效率D(%)采用下式計算:
(5)

Cm=0.2×qe×D
(6)

2 結果與討論
2.1 PFB-GAC制備條件的影響

我國農村公共產品供給機制的不合理之處主要體現在供給主體單一和決策機制單向兩個方面。首先,受傳統思想文化、歷史因素以及公共產品本身特性的影響,農村公共產品供給始終由政府控制,其他社會組織、外來資本都無法大量進入公共產品市場中,政府已經無法繼續滿足農村社會的發展要求。其次,我國政府在農村公共產品供給上實行“自上而下”的決策方式。基層政府干部的偏好取向對公共產品的供給起主導作用,更多地關注時間周期短、見效快的“政績工程”,而普通農民喪失了通暢表達需求的話語權,使得農村公共產品供需嚴重不符。
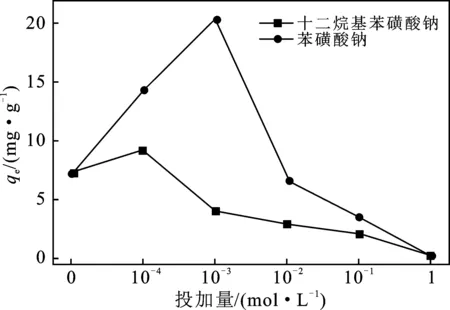
圖1 等量BSNa與SDBS摻雜制備改性活性炭對的吸附效果Fig.1 Adsorption effect of the modified activated carbon prepared by adding the same dosage of BSNa and SDBS on sulfate

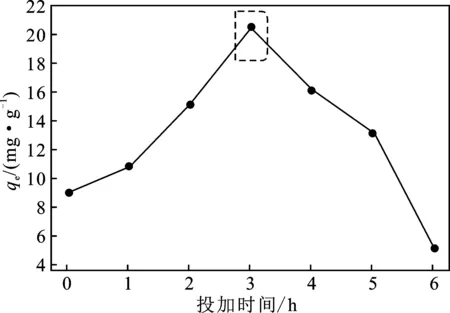
圖2 BSNa投加時間對改性活性炭吸附的影響Fig.2 The effect of adding time of BSNa by modified activated carbon on the adsorption of sulfate


圖3 活性炭負載導電聚合物的量對吸附的影響Fig.3 The effect of the amount of conductive polymer supported by activated carbon on the adsorption of sulfate

2.2 PFB-GAC再生及富集的研究
2.2.1 堿性物質再生 分別選取NaOH和NH3·H2O兩種典型堿性物質作為再生劑,對吸附飽和的PFB-GAC吸附劑進行脫附再生對比實驗。實驗中所用吸附劑初次吸附量均為20 mg/g左右。圖4A中,采用去離子水進行脫附,其對化學吸附作用甚微,脫附率僅為1.5%左右。而隨著NaOH的濃度逐漸提高,脫附率也逐漸升高;當NaOH濃度為2 mol/L 時脫附率達80%左右。與脫附率趨勢不同,當NaOH濃度升高至0.1 mol/L以上后,吸附劑再次吸附量出現了明顯的下降;再生液濃度2 mol/L時的再次吸附量較0.1 mol/L時下降了1/3。表明了過高NaOH濃度雖有利于單次脫附,但卻不利于PFB-GAC的循環利用。


圖4 不同濃度NaOH(A)、NH3·H2O(B)作為再生劑對的脫附率以及再次吸附的影響Fig.4 The desorption and re-adsorption sulfate studies on different NaOH (A),NH3·H2O (B) solutions by PFB-GAC
2.2.2 還原性物質再生 分別選取HCOOH、CH3OH和Na2SO3作為再生劑進行還原性物質脫附再生對比實驗,結果見圖5。


圖5 不同濃度HCOOH、CH3OH和Na2SO3作為再生劑對的脫附率以及再次吸附的影響Fig.5 The effect of the different concentrations of HCOOH,CH3OH and Na2SO3 on the desorption of
亞硫酸鹽是典型的強還原劑,還原電位約為-0.92 V, 為了進一步研究還原性更強的物質對PFB-GAC的再生效果,選擇了Na2SO3作為再生劑進行實驗研究。當Na2SO3的濃度為2 mol/L時,脫附率接近70%,再吸附量達15.24 mg/g,再生效果明顯強于HCOOH、CH3OH。相比于具有較弱還原性的短鏈有機物,還原性更強的Na2SO3對PFB-GAC的脫附再生效果更好。
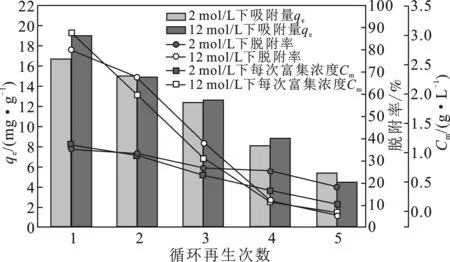
圖6 12 mol/L、2 mol/L NH3·H2O下PFB-GAC循環再生次數以及富集濃度Fig.6 Number of regeneration cycles of PFB-GAC and enrichment amount of at 12 mol/L and 2 mol/L NH3·H2O


圖7 未改性活性炭(A)、PFB-GAC吸附后(B)和NH3·H2O 五次再生后的PFB-GAC(C)的表面形貌Fig.7 Unmodified activated carbon (A);PFB-GAC adsorption (B);PFB-GAC (C) after five-times regeneration of NH3·H2O


圖8 0.1,2 mol/L Na2SO3下PFB-GAC循環再生次數以及富集濃度Fig.8 Number of regeneration cycles of PFB-GAC and enrichment amount of at 0.1,2 mol/L Na2SO3
2.3 機理分析



圖9 NaOH、NH3·H2O、HCOOH、CH3OH和Na2SO3脫附機理圖Fig.9 Mechanism diagram of desorption by NaOH,NH3·H2O,HCOOH,CH3OH and Na2SO3
3 結論


