術后腸梗阻炎癥進展中NR4A1、MAPK及IL-6表達變化的分析
魏永, 張俊榕, 潘杰, 翁宗奇, 陳先強
術后腸梗阻(postoperative ileus, POI)是外科術后常見的并發癥,發生率為10%~30%[1-2]。POI的發病機制比較復雜,至今尚未完全闡明,其中炎癥反應是POI的主要機制。絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)14和MAPK3是炎癥反應中最重要的激酶之一,參與炎癥反應的發生、發展并發揮調控作用。NR4A1(nuclear receptor subfamily 4, group A-1)是孤核受體家族之一,是免疫穩態的重要調節因子。多種細胞外刺激因素,如缺氧、炎癥、細胞應激等可誘導NR4A1快速表達[3-4]。已有研究表明,NR4A1作為一種響應蛋白,在信號傳導的早期發揮作用,可調控MAPK激酶和炎癥因子的表達,從而參與炎癥反應[5-6]。本研究擬建立大鼠POI模型,檢測NR4A1、MAPK14、MAPK3和白細胞介素6(interleukin, IL-6)的表達,探討NR4A1調控POI炎癥反應的可能機制。
1 材料與方法
1.1 材料
1.1.1 動物 18只健康雄性SD(Sprague-Dawley)大鼠,體質量(180±20) g,福建醫科大學實驗動物中心[動物批號:SCXK(閩)2016-0002]飼養(普通飼料飼養,溫度20~26 ℃,濕度40%~70%)。本研究已獲得福建醫科大學實驗動物委員會批準。
1.1.2 主要試劑 CytosporoneB (CAS321661-82-5,美國Glpbio公司);NR4A1(DF7850,江蘇Affinity公司);MAPK14(別名p38α, ab170099,英國Abcam公司);MAPK3(別名ERK1,16443-1-AP,美國Proteintech公司);IL-6酶聯免疫吸附試驗ELISA(MM-0190R1,武漢Elabscience公司);TUNEL檢測試劑盒(C1088,上海碧云天公司)。
1.2 方法
1.2.1 POI造模 大鼠術前禁食12 h,可飲水。2%戊巴比妥鈉(50 mg/kg)腹腔注射麻醉。麻醉后四肢固定于手術臺上,腹部備皮后碘伏消毒鋪巾。做下腹部正中線長約3 cm切口,依次切開皮膚、腹壁肌肉后進腹。取出全部小腸外置于兩層濕紗布間,用鹽水濕紗布由小腸末端自下而上擦拭腸管至幽門環,反復6次,用時10 min,期間注意防止損傷腸系膜血管。將全部腸管放回腹腔,注意理順小腸,防止其扭轉。1-0絲線分層連續縫合肌肉及皮膚關腹。假手術組大鼠腹部只做進腹和關腹處理。動物麻醉清醒后禁食不禁水,注意保溫。
1.2.2 動物分組 將18只SD大鼠數字隨機分成3組:假手術組、模型組(POI模型)和激動劑組(POI模型+CytosporoneB),每組6只。激動劑組大鼠術前1 h腹腔注射CytosporoneB (13 mg/kg);假手術組和模型組大鼠術前1 h腹腔注射同等劑量磷酸鹽緩沖液。飼養48 h后大鼠進行1 mL墨汁灌胃處理,灌胃后30 min麻醉各組大鼠,開腹觀察小腸形態,測量小腸推進率,取腹主動脈血液和距離盲腸10 cm的一段回腸組織樣本做相關指標檢測。
1.2.3 腹腔內小腸形態情況 打開腹腔,肉眼觀察小腸形態情況,包括腸管有無積氣、積液、充血、水腫。
1.2.4 小腸推進率測量 將不同組大鼠處死后取出整段小腸(保留胃、盲腸),測量小腸長度L1及幽門到墨汁最遠處的距離L2,計算小腸推進率:
小腸推進率=(L2/L1)×100%
1.2.5 組織病理學檢查 將腸組織固定于4%甲醛溶液,乙醇脫水、石蠟包埋、切片,蘇木精-伊紅(hematoxylin and eosin, H-E)染色。采用光學顯微鏡觀察腸道組織的病理改變。
1.2.6 TUNEL法檢測細胞凋亡情況 石蠟切片預處理準備、烤片、脫蠟、水化、修復、洗滌,加TUNEL檢測液、封片鏡檢。
1.2.7 免疫組織化學檢測NR4A1表達 石蠟切片烤片、脫蠟、水化、修復、洗滌、一抗NR4A1(1∶100)磷酸鹽緩沖液浸洗玻片,辣根酶標記山羊抗兔IgG(H+L)(1∶100),磷酸鹽緩沖液充分淋洗。DAB顯色、蘇木精復染、鹽酸酒精分化、返藍、脫水、透明、封片、鏡檢。
1.2.8 免疫熒光檢測MAPK14和MAPK3表達 石蠟切片包埋、切片脫臘水化、抗原修復、通透、封閉、一抗孵育MAPK14 (1∶150)和MAPK3 (1∶50)、熒光二抗cy3 (1∶150)、復染核、封片。
1.2.9 ELISA法檢測IL-6水平 取大鼠血液及回腸組織樣本進行處理,分離血漿,采用雙抗夾心法加樣、加酶、溫育,覆膜置于37 ℃溫箱60 min,配液,洗滌,甩干,洗滌5次,拍干,加入顯色劑,37 ℃避光顯色,加終止液,酶標儀分析。
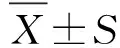
2 結 果
2.1 免疫組織化學檢測腸組織中NR4A1蛋白表達情況 假手術組中可見大量NR4A1蛋白,呈棕黃色。與假手術組比較,模型組中的棕黃色程度明顯減少,僅少數陽性顆粒在細胞核中表達,NR4A1蛋白表達明顯降低;與模型組比較,激動劑組中的棕黃色程度明顯增加,NR4A1蛋白表達明顯升高(圖1)。

A:假手術組;B:模型組;C:激動劑組。NR4A1:孤核受體。圖1 大鼠腸組織NR4A1表達Fig.1 Expression of NR4A1 in intestinal tissue of rats
2.2 腸組織病理形態學、細胞凋亡及小腸推進率情況
2.2.1 病理形態學 假手術組為正常的腸組織結構,無明顯形態改變。與假手術組比較,模型組的腸組織水腫嚴重,細胞邊界不清,具有大量炎性細胞浸潤;與模型組比較,激動劑組的腸組織炎性浸潤程度具有明顯的改善(圖2A)。
2.2.2 TUNEL檢測細胞凋亡結果 與假手術組比較,模型組腸組織中細胞凋亡明顯升高,差別有統計學意義(P<0.01);與模型組比較,激動劑組腸組織中細胞凋亡明顯降低,差別有統計學意義(P<0.01,圖2B)。
2.2.3 小腸推進率情況 與假手術組比較,模型組中小腸推進率顯著降低,差別有統計學意義(P<0.000 1);與模型組比較,激動劑組小腸推進率顯著提高,差別有統計學意義(P<0.000 1,圖2C)。
DAPI:4,6-二脒基-2-苯基吲哚;Apoptotic cell:凋亡細胞;Merge:融合。Sham:假手術組;Model:模型組;Stimulator:激動劑組。A:病理H-E染色;B:細胞凋亡;C:小腸推進率。與Sham組比較,△:P<0.01,△△△: P<0.000 1;與Model組比較,△:P<0.01,△△△:P<0.000 1。圖2 腸組織病理學檢查、細胞凋亡及小腸推進率情況Fig.2 Pathological examination of intestinal tissue, apoptosis and small intestine propulsion rate
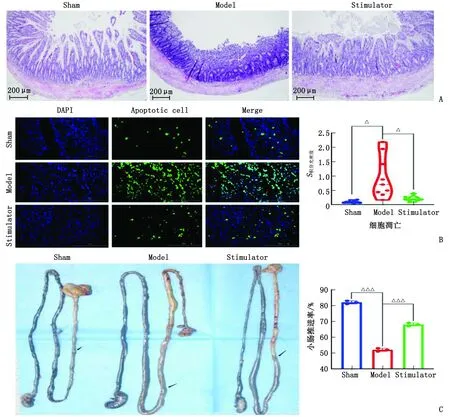
2.3 免疫熒光檢測MAPK14和MAPK3的表達 與假手術組比較,模型組中MAPK14和MAPK3顯著上調,差別有統計學意義(P<0.000 1);與模型組比較,激動劑組中MAPK14和MAPK3顯著下調,差別有統計學意義(P<0.000 1)。MAPK14和MAPK3激活下可誘導炎癥反應,NR4A1激動劑顯著抑制MAPK14和MAPK3的表達,進而抑制炎癥因子(圖3)。

DAPI:4,6-二脒基-2-苯基吲哚;Merge:融合;MAPK:絲裂原活化蛋白激酶;ERK:細胞外調節蛋白激酶。Sham:假手術組;Model:模型組;Stimulator:激動劑組。A:MAPK14表達;B:MAPK3表達。與Sham組比較,△△△:P<0.000 1;與Model組比較,△△△:P<0.000 1。圖3 腸組織MAPK14和MAPK3表達情況Fig.3 Expression of MAPK14 and MAPK3 in intestinal tissue
2.4 IL-6含量水平變化 與假手術組比較,模型組血漿和腸組織中IL-6含量升高,差別有統計學意義(P<0.000 1);與模型組比較,激動劑組血漿和腸組織中IL-6的含量降低,差別有統計學意義(P<0.000 1,P<0.001,圖4)。
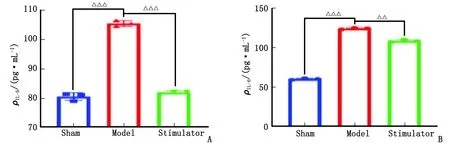
IL-6:白細胞介素6。Sham:假手術組;Model:模型組;Stimulator:激動劑組。A:血漿;B:腸組織。與Sham組比較,△△△:P<0.000 1;與Model組比較,△△:P<0.001;△△△:P<0.000 1。圖4 血漿和腸組織IL-6含量水平Fig.4 IL-6 level of plasma and intestinal tissue
3 討 論
POI是腹部外科手術后常見的并發癥,與手術創傷程度、炎癥反應、術后疼痛、阿片類藥物、應激等多因素有關[7]。POI的主要臨床表現為腹脹、惡心、嘔吐、腹痛不明顯及肛門停止排氣、排便等癥狀。POI可導致患者推遲進食時間、延長住院時間、降低手術療效及增加額外醫療費用等。雖然微創技術持續發展,手術方法也不斷改進,但POI仍不可避免發生。
POI發生和發展的機制十分復雜,涉及多方面因素相互作用,分為早期階段和持續階段。POI的持續階段主要是腸組織炎癥反應作用,其持續時間與腸肌層炎癥反應的程度呈正相關[8]。抑制炎癥反應是防治POI最直接和最有效的方法。POI的炎癥反應機制涉及多個信號傳導通路共同作用。手術操作刺激胃腸道1 h即可激活細胞內MAPK14(p38α)、MAPK3(ERK1)、JNK/SAP等炎癥反應相關的信號通路,引起一系列連鎖反應,導致腸道部位的巨噬細胞和肥大細胞激活和核轉錄因子的活化,從而產生和釋放大量IL-6、TNF-α及IL-1等促炎細胞因子和趨化因子,其中IL-6 在炎癥反應中具有廣泛的影響。IL-6等促炎因子激活中性粒細胞,引起腸道的炎癥反應,最終導致POI的發生[9-11]。ZHU等[12]發現,結直腸癌術后發生POI患者的腹腔引流液中IL-6、TNF-α等炎癥因子含量水平明顯升高,腹腔炎癥因子可預測POI的發生及持續時間。ZHANG等[13]發現,激活p38MAPK、ERK1/2信號通路可誘導細胞的炎癥反應,抑制p38可降低IL-6和TNF-α表達水平,抑制ERK1/2可降低IL-6表達水平。WEHNER等[10]的研究表明,抑制小腸常駐巨噬細胞中p38信號通路可以有效預防POI。XIONG等[14]的研究發現,通過阻斷p38/MK2信號通路可以有效地抑制小鼠POI中炎癥因子表達,減少炎癥細胞的浸潤,從而減輕腸道炎癥。因此,通過抑制MAPK信號通路,可以預防或減輕POI炎癥反應,改善腸梗阻癥狀。
NR4A1屬于孤核受體家族的重要一員,參與多種細胞過程,包括增殖、分化、凋亡、代謝和發育。NR4A1在免疫穩態、動脈粥樣硬化、代謝類疾病、腫瘤的發生、發展等過程中扮演著重要角色[15-16]。最近有研究表明,NR4A1在炎癥反應中具有負性調節作用[5-6,17]。NR4A1是一種磷酸化的蛋白。磷酸化可以調節NR4A1的活性,在刺激或炎癥反應時可激活MAPK激酶,導致NR4A1的磷酸化。NR4A1處于失活狀態,促進核因子NF-κB進入細胞核內,與 NF-κB位點結合,促進下游細胞因子IL-6、TNF-α釋放大量炎癥因子,進一步導致局部或全身炎癥反應[18-19]。NR4A1在巨噬細胞和單核細胞中表達降低,而炎癥因子(如IL-1和IL-6)表達升高[3-4]。HAMERS等[20]發現,NR4A1通過抑制p38MAPK和NF-κB表達而降低ET-1水平,ARDS大鼠肺組織中NR4A1表達明顯降低,NR4A1激動劑CytosporoneB減輕了ARDS的炎癥和損傷。ANOUK等[21]發現,小鼠結腸炎模型中敲除NR4A1基因,結腸炎癥明顯加重,激活NR4A1表達可減輕結腸炎癥。本研究結果顯示,大鼠POI腸組織中NR4A1表達明顯降低,MAPK14、MAPK3及IL-6的表達顯著升高;CytosporoneB激活NR4A1表達可顯著降低MAPK14、MAPK3及IL-6表達,減輕腸組織的炎癥和水腫,提高小腸推進率。
綜上所述,大鼠POI腸組織中NR4A1低表達在炎癥反應及POI進展中起著重要作用。激活NR4A1表達可減輕POI腸組織炎癥和緩解梗阻癥狀,其作用機制可能與通過抑制MAPK信號通路有關。

