咽炎片微生物限度檢查方法的構建
劉 博 任仲麗 曹魯娜 李秀菊 張裕民
作者單位:菏澤市食品藥品檢驗檢測研究院,山東菏澤 274000
咽炎片主要由玄參、天冬、麥冬、板藍根、薄荷油等成分組成,具有養陰潤肺、清熱解毒、清利咽喉、鎮咳止癢功效[1]。因處方中的多味藥具有抑菌作用[2-8],根據《中華人民共和國藥典》2020年版四部1105 規定,采用增加稀釋液或培養基體積、加入適宜的中和劑或滅活劑、采用薄膜過濾法,上述幾種方法的聯合使用可消除供試品的抑菌活性。為了真實反映藥品中微生物污染狀況,本研究采用了常規法、增加培養基體積法和薄膜過濾法進行檢查,以期建立咽炎片的微生物限度檢查方法。
1 材料與方法
1.1 材料
1.1.1 樣品根據山東省藥品監督管理局藥品質量風險監測項目要求,選取10 個不同生產企業的咽炎片樣品。
1.1.2 菌種菌種微生物計數方法適用性試驗所用菌種為金黃色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、枯草芽孢桿菌(Bacillus subtilis)[CMCC(B)63501]、銅綠假單胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003],控制菌檢查方法適用性試驗所用菌種為大腸埃希菌(Escherichia coli)[CMCC(B)44102]、乙型副傷寒沙門氏菌(Salmonella paratyphi-B)[CMCC(B)50094],由廣東環凱微生物科技有限公司提供,試驗所用菌株為第3 代。
1.1.3 儀器電子天平(JY2002,上海精密科學儀器有限公司)、高壓蒸汽滅菌器(mLS-3780,三洋)、細菌濁度分析儀(WGZ-2XJ,上海盺瑞儀器儀表有限公司)、生物安全柜(Class Ⅱ BSC,新加坡ESCD 公司)、電熱恒溫培養箱(DH4000B Ⅱ,天津市泰斯特儀器有限公司)、霉菌培養箱(MJ-250F-1,上海新苗醫療器械制造有限公司)、微生物限度檢驗儀(HTY-302G,杭州泰林生物技術股份有限公司)。
1.1.4 培養基與試劑胰酪大豆胨液體培養基、pH7.0 氯化鈉-蛋白胨緩沖液、胰酪大豆胨瓊脂培養基、沙氏葡萄糖瓊脂培養基、麥康凱瓊脂培養基、麥康凱液體培養基、腸道菌增菌液體培養基、紫紅膽鹽葡萄糖瓊脂培養基、木糖賴氨酸脫氧膽酸鹽瓊脂培養基等由北京陸橋技術股份有限公司提供。氯化鈉、聚山梨酯80 由天津市科密歐化學試劑有限公司提供。
1.2 方法
對10 個不同企業生產的咽炎片進行微生物方法適用性試驗。
1.2.1 菌液制備將金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、大腸埃希菌、乙型副傷寒沙門氏菌的新鮮培養物經濁度計比濁后,用0.9%無菌氯化鈉溶液10 倍系列稀釋制成100~10 000 cfu/ml 的菌懸液;取黑曲霉的新鮮培養物加入10 ml 0.9%無菌氯化鈉溶液(含0.05%聚山梨酯80)將孢子洗脫,經濁度計比濁后,稀釋制成100~10 000 cfu/ml 的菌懸液,做活菌計數后備用。
1.2.2 供試液的制備 稱取供試品10 g,加pH7.0氯化鈉-蛋白胨緩沖液至100 ml,溶解均勻后得1∶10的供試液。取1∶10 供試液1 ml 加pH7.0 氯化鈉-蛋白胨緩沖液至10 ml,制成1∶100 的供試液,同理制得1∶1 000 的供試液。
1.2.3 需氧菌、霉菌和酵母菌總數計數方法的驗證
1.2.3.1 常規法(1 ml/皿)試驗組:取5 個滅菌試管裝入9.9 ml 1.2.2 項下1∶10 的供試液,每個試管中依次加入金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、黑曲霉菌懸液0.1 ml;供試品對照組:取相應量的稀釋液代替菌液同試驗組操作;菌液對照組:取相應量的稀釋液替代供試液同試驗組操作[9]。以上各組吸取1 ml 注入平皿中,平行制備2 個平皿,傾注15~20 ml 胰酪大豆胨瓊脂培養基,置33 ℃培養3 d 計數;分別取白色念珠菌、黑曲霉的實驗組、供試品對照組和菌液對照組各1 ml 注入平皿中,平行制備2 個平皿,傾注15~20 ml 沙氏葡萄糖瓊脂培養基,置23 ℃培養5 d 計數。
1.2.3.2 增加培養基體積(0.2 ml/皿)試驗組:取5 個滅菌試管裝入9.9 ml 1.2.2 項下1∶10 的供試液,每個試管中依次加入金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、黑曲霉菌懸液0.1 ml;供試品對照組:取相應量的稀釋液代替菌液同試驗組操作;菌液對照組:取相應量的稀釋液替代供試液同試驗組操作[9]。以上各組吸取2 ml 注入10 個平皿中,傾注15~20 ml 胰酪大豆胨瓊脂培養基,置33 ℃培養3 d 計數;分別取白色念珠菌、黑曲霉的實驗組、供試品對照組和菌液對照組各2 ml 注入10 個平皿中,傾注15~20 ml 沙氏葡萄糖瓊脂培養基,置23 ℃培養5 d 計數。
1.2.3.3 薄膜過濾法試驗組:取1.2.2 項下1∶10的供試液1 ml 至100 ml pH7.0 氯化鈉-蛋白胨緩沖液中,用稀釋液分3 次沖洗濾膜,100 ml/膜,在末次沖洗中依次加入制備好的金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、黑曲霉菌懸液0.1 ml;供試品對照組:取相應量的稀釋液代替菌液同試驗組操作;菌液對照組:取相應量的稀釋液替代供試液同試驗組操作[9]。濾膜菌面朝上貼于胰酪大豆胨瓊脂培養基,平行制備2 個平皿,33 ℃培養3 d 計數;分別取白色念珠菌、黑曲霉的實驗組、供試品對照組和菌液對照組各個濾膜,菌面朝上貼于沙氏葡萄糖瓊脂培養基,平行制備2 個平皿,置23 ℃培養5 d 計數。
1.2.4 回收率的計算試驗組菌回收率(%)=[(試驗組菌落數平均值-供試品對照組菌落數平均值)/菌液對照組菌落平均值]×100%,若3 次平行試驗中5 種菌回收率均在70%以上,則認為結果符合驗證試驗。
1.2.5 控制菌的檢查
1.2.5.1 耐膽鹽革蘭陰性菌取供試品10 g 用胰酪大豆胨液體培養基稀釋制成1∶10 供試液,混勻,20~25 ℃培養2 h[9],依次制成1∶100、1∶1 000的供試液。分別取1∶10、1∶100、1∶1 000 的供試液1 ml 接種至10 ml 腸道菌增菌液體培養基作為供試品組;陽性對照組照供試品組配制,再加入小于100 cfu/ml 的大腸埃希菌和銅綠假單胞菌菌懸液;陰性對照組以稀釋液代替供試液,其他同供試品組。放置33 ℃培養箱培養48 h,上述培養物劃線接種于紫紅膽鹽葡萄糖瓊脂培養基平板上,33 ℃培養24 h。
1.2.5.2 大腸埃希菌取1.2.2 項下的1∶10 的供試液10 ml 接種至100 ml 胰酪大豆胨液體培養基作為供試品組;陽性對照組照供試品組配制,再加入小于100 cfu/ml 的大腸埃希菌菌懸液;陰性對照組以稀釋液代替供試液,其他同供試品組。置33 ℃培養箱培養24 h,將其1 ml 接種至100 ml 麥康凱液體培養基中,43 ℃培養48 h,之后劃線接種于麥康凱瓊脂培養基平板上,33 ℃培養72 h[10]。
1.2.5.3 沙門菌取10 g 供試品直接接種于100 ml胰酪大豆胨液體培養基中,混勻,置30~35 ℃培養箱中培養18~24 h 作為供試品組;陽性對照組照供試品組配制,再加入小于100 cfu/ml 的乙型副傷寒沙門氏菌菌懸液;陰性對照組以稀釋液代替供試品,其他同供試品組。取上述培養物0.1 ml 接種至10 ml RV 沙門菌增菌液體培養基中,置33 ℃培養箱培養24 h,取RV 沙門菌增菌液體培養物劃線接種于木糖賴氨酸脫氧膽酸鹽瓊脂培養基平板上,33 ℃培養48 h[10]。
2 結果
不同企業樣品的金黃色葡萄球菌和枯草芽孢桿菌的回收率均低于50%。見表1。增加培養基體積可適當提高金黃色葡萄球菌的回收率,但枯草芽孢桿菌的回收率仍不能達到藥典的要求,又選擇薄膜過濾法再進行驗證。見表2。采用薄膜過濾法各試驗菌的回收率均符合要求。見表3。控制菌檢查采用常規法,陽性對照均檢出生長良好,陰性對照未檢出。見表4。

表1 常規法需氧菌、霉菌和酵母菌總數方法平均回收率(%)

表2 增加培養基體積需氧菌、霉菌和酵母菌總數方法平均回收率(%)
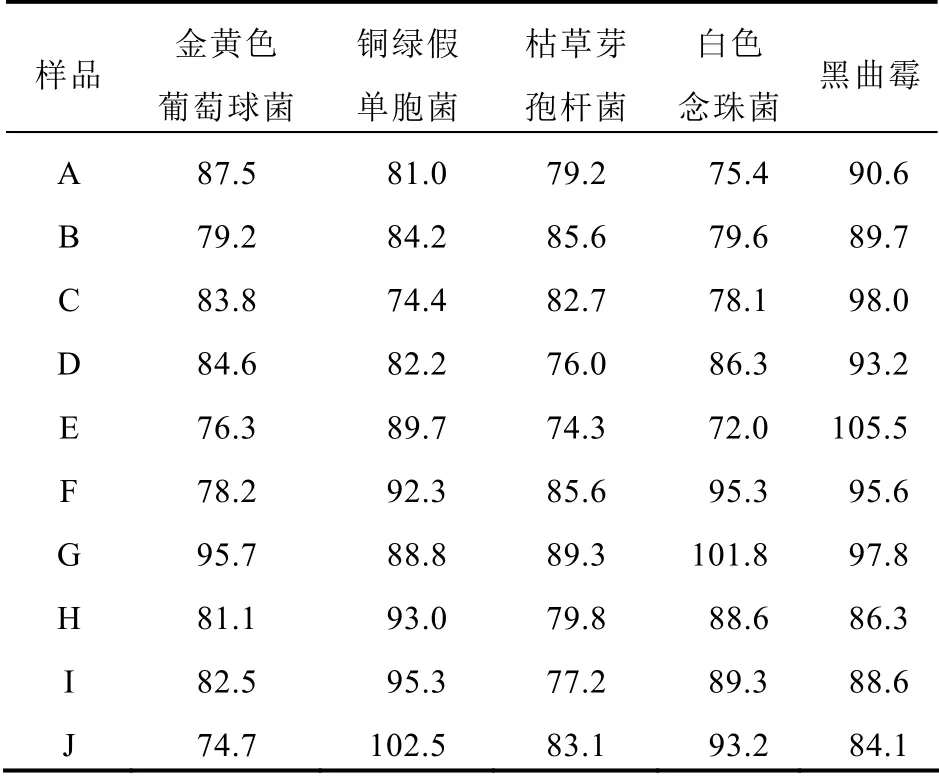
表3 薄膜過濾法需氧菌、霉菌和酵母菌總數方法平均回收率(%)

表4 控制菌檢查驗證結果
3 討論
藥品微生物限度檢查指的是微生物對各種中藥、西藥的侵蝕及感染的程度,并對這種侵蝕程度進行實驗驗證,在規定的試驗條件下,檢查樣品中存在微生物的數量以及是否存在特定微生物[10]。在檢驗過程中易受到各種因素的影響,不僅要遵循藥品檢驗的相關標準,還要符合微生物的檢測要求,除了要牢記“無菌、快速、準確”外還要謹記微生物的特殊性[11]。以最大程度保證微生物檢測結果的準確性,降低誤差率。
咽炎片處方中含有多種抑菌成分,具有抑菌作用的成分可影響微生物限度檢查的準確性[12]。雖然不同企業同名中藥制劑的成分基本相同,但其含量存在一定差異[13],同一種中草藥由于不同來源、季節性變化、植物不同部位、不同提取方法導致其成分也有差別[4]。為了保證檢查方法的可靠性,本研究通過對10 個不同企業生產的50 批次的咽炎片樣品進行了需氧菌、霉菌和酵母菌總數及控制菌的方法驗證。結果表明金黃色葡萄球菌、枯草芽孢桿菌采用常規法和增加培養基體積法不能完全消除供試品的抑菌活性,說明咽炎片對需氧菌有較強的抑菌作用,應重新選擇適當的方法進行驗證。含有抑菌成分的中成藥往往對這兩種菌有作用,這與相關研究一致[14-15]。為進一步驗證方法適用性結果的可行性,本研究選取了薄膜過濾法進行再驗證,結果表明,采用薄膜過濾法各種菌的回收率在70%以上,因此選擇薄膜過濾法(300 ml/膜)對咽炎片進行微生物計數檢查,符合方法適用性試驗要求。咽炎片的控制菌檢查方法有效性驗證試驗表明,10 個企業生產的50 批次的咽炎片均可使用常規法進行檢查。結果完全符合《中華人民共和國藥典》2020年版四部微生物限度檢查控制菌驗證要求,所以該方法可行。本試驗建立的方法準確、可靠,適用于咽炎片的微生物限度檢查。

