Real-time PCR和雙向電泳聯合鑒別嬰幼兒配方羊乳粉的乳源成分
侯艷梅,楊艷歌,吳 桐,劉鳴暢,王洪越,王丹丹,吳亞君,*
(1.海普諾凱營養品有限公司,湖南 長沙 410000;2.中國檢驗檢疫科學研究院,北京 100176)
羊乳作為特色小眾乳品具有較好的營養特性,它的蛋白質構成、非蛋白氮含量、脂肪酸構成和寡糖種類與牛乳相比更接近于母乳[1-2],因此羊乳基嬰幼兒配方奶粉具有特有的營養特性和健康益處,日益受到消費者歡迎,市場份額也在不斷擴大,近些年全球銷量增長率均保持10%以上[3]。然而奶羊的數量和日產量都遠小于奶牛,導致羊乳粉的價格比牛乳粉高。因此羊乳制品中摻雜牛乳制品的經濟利益欺詐現象時有發生。同時摻雜摻假也會引入牛源性過敏成分,增加致敏的風險,對消費者的健康構成威脅[4-5]。
我國《嬰幼兒配方乳粉產品配方注冊管理辦法》規定了“產品名稱中有動物性來源的,應當根據產品配方在配料表中如實標明使用的生乳、乳粉、乳清(蛋白)粉等乳制品原料的動物性來源。使用的乳制品原料有兩種以上動物性來源時,應當標明各種動物性來源原料所占比例”[6]。為保證嬰幼兒配方羊乳粉產品的質量,有必要開發一種靈敏度高和準確性好的原料檢測方法。目前乳制品中乳源鑒定和檢測的方法較多,有理化方法[7-10]、免疫技術[11-14]、基因方法[14-19]、蛋白方法[20-24]等。基因檢測技術被公認是物種鑒定的金標準技術,其中實時聚合酶鏈式反應(real-time polymerase chain reaction,realtime PCR)技術操作簡便、靈敏度高,被廣泛用于食品物種檢測標準中[25-26]。但real-time PCR法也存在一些限制,如靈敏度雖然高,且適用于各類基質樣品,但由于核酸可存在于不同的組分中,包括全乳、脫脂乳、乳清等,因此對于核酸檢測呈陽性的樣品,還需要對組分來源進行確證。例如采用蛋白質電泳技術分析樣品的蛋白組成,判定是否含有目標物種來源的蛋白質成分,才能對樣品的真實性有準確的認識。蛋白質是乳品的主要營養成分,不同種源的乳品所包含的蛋白質組分有所不同,因此依據乳品的蛋白質或多肽指紋進行真偽檢測也日益成為乳品質量評價的重要方法。其中雙向電泳法是根據蛋白質等電點和分子質量兩大特性,對蛋白進行高效分離,所得的圖譜分辨率高、穩定性好,可以直觀地展現不同種類、不同來源蛋白的差異[27]。筆者實驗室已經發表了采用雙向電泳技術進行乳源檢測的研究[28-29]。但單獨采用蛋白進行檢測,操作流程復雜,檢測耗時長,靈敏度不高,對實驗人員要求高,不適合作為常規性檢測方法。因此實驗認為應該將DNA方法發展為一種快速初篩手段,將蛋白檢測作為確證方法。
本研究首先建立嬰幼兒配方乳粉DNA快速提取方法,采用具有遠高于蛋白酶K降解能力的嗜熱蛋白酶,通過溫控設備一步式獲取DNA,整個過程僅需17 min。優化建立乳粉中乳源成分快速real-time PCR篩查技術,不僅減少了檢測時間,而且提高了擴增效率,包括哺乳動物,牛(家牛、水牛、牦牛)、羊(山羊和綿羊通用及單一乳源)以及山羊、綿羊單一物種檢測方法,檢測靈敏度好。采用快速、簡便、靈敏的real-time PCR方法對樣品的乳源進行初篩,然后對于檢出牛基因成分的配方乳粉,再增加雙向電泳乳源蛋白的檢測,以αS1-酪蛋白、αS2-酪蛋白、κ-酪蛋白、β-乳球蛋白作為乳源判別的特征差異蛋白,并依據乳清蛋白和乳酪蛋白的特性,進一步判定樣品中摻雜了牛乳還是牛乳清。通過以上兩種技術聯合,解決以往嬰幼兒配方乳粉檢測中因配料復雜,乳源判別困難的瓶頸問題。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
嬰幼兒配方羊乳粉、嬰兒配方牛乳粉、全脂羊乳粉、脫脂羊乳粉、綿羊乳清粉、山羊乳清粉、山羊綿羊乳清粉、牛乳清粉、全脂牛乳粉、脫脂牛乳粉均由委托的乳品企業提供,水牛乳由廣西水牛研究所提供;牛乳、綿羊乳、山羊乳、駱駝乳、馬乳均從內蒙古的牧場收集;驢乳由青島海關提供;牦牛乳由中國農業大學提供;市售嬰幼兒配方羊乳粉均購自北京超市和網商平臺;其他物種材料(豬、梅花鹿、馬鹿、狗、兔、狐貍、水貂、大鼠、雞、鴨、魚),以及配方乳粉中常添加的植物源成分(葵花、大豆、椰子、玉米、菜籽),均為本實驗室儲存樣品。
1.1.2 試劑
PDQeX prepGEM Universal DNA提取試劑盒英國MicroGEM公司;QuickGene DNA Tissue Kit L DNA提取試劑盒 日本Kurabo公司;NucleoSpin?Food德國Macherey-Nagel公司;DNeasy Mericon Food Kit德國Qiagen公司;Foodproof?GMO Sample Preparation Kit德國Biotecon Diagnostics公司;TaqMan Fast Advanced Master Mix 美國Applied Biosystems公司;BCA蛋白定量試劑盒 德國Merck公司;預染十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel eletropheresis,SDS-PAGE)標準品(Prestained SDSPAGE Standards,Broad range)、兩性電解質(Bio-Lyte 4/6 Ampholyte、Bio-Lyte 5/7 Ampholyte)、IPG預制膠條(7 cm、pH 4~7)、30%丙烯酰胺溶液、1.5 mol/L三羥甲基氨基甲烷(tris (hydroxymethyl) aminomethane,Tris)溶液(pH 8.8)、四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)、二硫蘇糖醇(dithiothreitol,DTT)、3-[3-(膽酰胺丙基)二甲氨基]丙磺酸內鹽(3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfate,CHAPS) 美國Bio-Rad公司。
1.1.3 引物探針
從GenBank數據庫中提取哺乳動物、牛、家牛、水牛、牦牛、羊、山羊和綿羊以及其他乳源物種和近源物種的生長激素基因(GH)和cytb基因序列。利用Clustal X軟件進行序列比對,利用Primer Premier 5.0軟件分別在保守區域設計哺乳動物通用引物探針,在種間差異區域設計牛、羊、山羊和綿羊的特異性引物探針。其中牛為牛亞科牛族動物的統稱,包括家牛(Bos taurus)、水牛(Bubalus bubalus)和牦牛(Bos grunniens),這3種乳在市場上的占有率較高,尤其是牛乳和水牛乳,占全世界乳產量的96%[30],通過設計一個牛族通用引物探針,可同時將牛乳、水牛乳、牦牛乳乳源成分擴出。同時由于嬰幼兒配方羊乳粉的主要原料是羊乳,其常見的兩個亞種是山羊和綿羊,因此實驗首先設計了羊的通用引物,可同時實現對山羊和綿羊乳源成分的擴增。而市場上又有山羊乳和綿羊乳標識的乳粉,因此為了進一步滿足標簽查驗的需求,實驗又分別設計了山羊和綿羊引物探針,以進一步區分乳源。具體信息如表1所示,所有引物探針均在上海英濰捷基生物技術有限公司合成。
1.2 儀器與設備
7500 Fast實時熒光PCR儀 美國Applied Biosystems公司;Labsystems Multiskan Spectrum酶標儀、Pico17離心機(離心力≥12 000hg) 美國Thermo公司;Mini Protean 3 Cell垂直板電泳儀、PharosFX激光成像系統美國Bio-Rad公司;QuickGene Mini8L 日本Kurabo公司;Qubit 2.0核酸蛋白分析儀 美國Invitrogen公司;組織研磨機 德國Qiagen公司;渦旋儀 德國IKA公司;恒溫混勻儀、微量移液器 德國Eppendorf公司;離心管、八連排PCR管 美國Axygen公司;電子天平德國Sartorius公司;qPCR儀 杭州安塔生物科技有限公司;恒溫水浴鍋 北京六一生物科技有限公司。
1.3 方法
1.3.1 快速real-time PCR
1.3.1.1 樣品前處理
液態乳混勻后冷凍干燥,乳粉直接混勻分裝;其他動植物樣品統一用組織研磨儀粉碎,-80 ℃凍存。
1.3.1.2 DNA提取
分別稱取50 mg嬰幼兒配方牛乳粉和嬰幼兒配方羊乳粉樣品,用傳統的CTAB法以及5種商業試劑盒進行DNA提取效果比較,部分步驟在說明書基礎上進行了改良。其中采用PDQeX prepGEM通用DNA提取試劑盒改良后的步驟為:稱取50 mg乳粉于1.5 mL離心管中,加入500 μL wash buffer,渦旋振蕩1 min,12 000 r/min離心3 min,棄上清液,以洗去油脂,然后按照試劑盒配制100 μL提取反應體系(10 μL Histosolv,10 μL Orange Buffer,2 μL PrepGEM,78 μL H2O)重懸沉淀并移至PCR單管中,進行熱循環反應:52 ℃細胞壁降解5 min,75 ℃細胞裂解10 min,95 ℃變性2 min,即可獲取DNA。
改良的CTAB法在GB/T 19495.3ü2004《轉基因產品檢測 核酸提取純化方法》[31]步驟的基礎上,蛋白酶K量增加1 倍,氯仿去蛋白的步驟重復1次。NucleoSpin食品基因組DNA提取試劑盒、DNeasy Mericon食品基因組DNA提取試劑盒、QuickGene DNA多樣本抽提試劑盒、Foodproof?GMO Sample Preparation核酸純化試劑盒改良的步驟為:加入裂解液至樣品自由懸浮于液體中,蛋白酶K量是說明書量的2 倍,所有樣品于65 ℃、500 r/min舒適型恒溫混勻儀中振蕩孵育過夜,其他步驟按照各說明書操作,獲取的DNA統一用100 μL無菌ddH2O溶解。用Qubit 2.0核酸蛋白定量儀測量DNA濃度,用哺乳動物引物探針作為內參照進行real-time PCR擴增效率評估,每份DNA重復擴增3次,-20 ℃保存DNA。
1.3.1.3 real-time PCR
real-time PCR檢測采用25 μL反應體系:12.5 μLTaqMan Fast Advanced Master Mix,10 μmol/L上下游引物各0.5 μL,10 μmol/L探針0.5 μL,模板DNA 5 μL,用無菌水補至總體積25 μL。在7500 Fast real-time PCR儀進行PCR擴增,原始反應程序為:50 ℃去除RNA 2 min;95 ℃預變性10 min;95 ℃變性15 s,60 ℃退火1 min,35個循環。
1.3.1.4 通用性和特異性檢測
real-time PCR檢測分別以綿羊奶、山羊奶、牛乳、水牛乳、牦牛乳、駱駝乳、馬奶、驢乳、馬鹿、梅花鹿、豬、狗、兔、狐貍、水貂、大鼠、雞、鴨、魚、葵花、大豆、椰子、玉米、菜籽的DNA(5 ng/μL)為擴增對象進行擴增,以無菌水為空白對照,每個樣品2個平行重復。
1.3.1.5 快速real-time PCR程序的建立
為縮短檢測時間,建立快速real-time PCR檢測流程,在上述典型傳統擴增程序(設為①)的基礎上進行優化,優化的程序設為②~⑧。分別采用羊和引物探針對羊乳和牛乳DNA進行擴增,分析擴增效果和檢測時間,生成圖像時閾值設為自動。在PCR同時,設置陽性對照、陰性對照和空白對照,每個反應設置2個平行,并重復實驗1次。
②50 ℃去除RNA 2 min;95 ℃預變性10 min;95 ℃變性10 s,60 ℃退火1 min,35個循環。
③50 ℃去除RNA 2 min;95 ℃預變性7 min;95 ℃變性5 s,60 ℃退火30 s,35個循環。
④50 ℃去除RNA 2 min;95 ℃預變性5 min;95 ℃變性3 s,60 ℃退火15 s,35個循環。
⑤50 ℃去除RNA 2 min;95 ℃預變性2 min;95 ℃變性2 s,60 ℃退火10 s,35個循環。
⑥95 ℃預變性2 min;95 ℃變性2 s,60 ℃退火10 s,35個循環。
⑦95 ℃預變性2 min;95 ℃變性2 s,60 ℃退火8 s,35個循環。
⑧95 ℃預變性2 min;95 ℃變性2 s,60 ℃退火5 s,35個循環。
1.3.1.6 絕對靈敏度分析
將提取的山羊、綿羊、牛樣品的DNA從100 ng/μL開始進行10 倍比稀釋,使其質量濃度分別為100 ng/μL、10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL,共6個梯度,用篩選好的特異性引物探針進行real-time PCR擴增,每個反應設置3個平行。
1.3.1.7 實際靈敏度分析
分別按照質量分數為0.1%、1%、10%、50%、100%制備嬰幼兒配方牛乳粉/嬰幼兒配方羊乳粉、脫脂牛乳粉/脫脂羊乳粉、全脂牛乳粉/全脂羊乳粉、牛乳清粉/山羊綿羊乳清粉、牛乳清粉/全脂羊乳粉、牛乳清粉/脫脂羊乳粉模擬摻雜混合樣品,混勻后提取DNA,進行realtime PCR擴增,每個反應設置3個平行。
1.3.2 雙向電泳
前期雙向電泳研究表明山羊乳和綿羊乳的蛋白無明顯差異,牛乳和羊乳所含蛋白種類也基本相同,但在乳清蛋白區域及乳酪蛋白區域存在明顯差異,即:牛αS1-酪蛋白和羊αS1-酪蛋白等電點基本相同,但牛αS1-酪蛋白分子質量比羊αS1-酪蛋白大;牛αS2-酪蛋白和羊αS2-酪蛋白,牛κ-酪蛋白和羊κ-酪蛋白分子質量均相同,但羊αS2-酪蛋白和牛κ-酪蛋白等電點更大。牛β-乳球蛋白和羊β-乳球蛋白分子質量相同,但羊β-乳球蛋白等電點大于牛β-乳球蛋白。從而選定牛αS1-酪蛋白、牛αS2-酪蛋白、牛κ-酪蛋白作為乳酪蛋白乳源判別的特征差異蛋白,以此判別嬰幼兒配方羊乳粉中是否添加牛乳成分;并選定β-乳球蛋白作為判定嬰幼兒配方羊乳粉中是添加牛乳清(蛋白)還是羊乳清(蛋白)成分的判別依據。本研究將聯合該方法對本研究中的樣品嬰幼兒配方乳粉和常用配料以及市售配方乳粉的乳源成分進行判別。
1.3.2.1 樣品預處理
稱取1.5 g乳粉樣品及配料置于15 mL離心管中,加10 mL去離子水,渦旋振蕩,至充分溶解。使用BCA蛋白定量試劑盒對乳粉樣品溶液的總蛋白進行測定,將蛋白質量濃度調整為20 mg/mL,存于4 ℃。
1.3.2.2 等電聚焦
預處理樣品渦旋振蕩混勻,吸取10 μL樣品和150 μL水化液(8 mol/L尿素、4% CHAPS、40 mmol/L Tris、100 mmol/L DTT、0.5%兩性電解質)混勻,使用IPG膠條進行等點聚焦。條件設定為50 V主動水化8 h;250 V線性30 min;500 V快速30 min;4 000 V線性3 h;4 000 V快速40 000 Vgh。
1.3.2.3 垂直電泳
SDS-PAGE參照文獻[33]相關內容進行。其中分離膠為12%,電泳條件為10 mA恒流電泳。電泳結束,凝膠用考馬斯亮藍染液(50%甲醇、10%醋酸、0.25%考馬斯亮藍R250)染色1 h,用脫色液(25%甲醇、10%醋酸)脫色至凝膠背景消失,用蒸餾水浸泡1 h,隨后用PharosFX激光成像系統拍照,獲取雙向電泳圖譜。
1.3.3 市售樣品乳源檢測
市售樣品各稱取50 mg,采用PDQeX prepGEM通用DNA提取試劑盒按照1.3.1.2節改良步驟進行DNA提取,所有DNA質量濃度調制5 ng/μL,采用建立的快速realtime PCR程序進行乳源檢測。牛基因檢測呈陽性的樣品再按照上述雙向電泳步驟進行乳源蛋白分析。
1.4 數據統計及圖表繪制
從儀器導出檢測結果和數據,Excel軟件計算并繪制圖表。擴增圖譜和標準曲線儀器自動生成,導出圖譜進行組合。其中實際靈敏度的線性回歸曲線的繪制是以目標樣品含量的對數(ln值)為X軸,以相應的Ct均值為Y軸,繪制散點圖,并添加趨勢線(對數)。
2 結果與分析
2.1 6種DNA提取方法比較與一步法DNA快速提取方法的建立
基因檢測限制快速應用的主要瓶頸在于傳統DNA提取耗時長、操作復雜,因此建立一個簡單、快速、高效的DNA提取方法是快速篩查需要解決的首要問題。實驗選用6種提取方法:CTAB法、PDQeX prepGEM通用DNA提取試劑盒、NucleoSpin食品基因組DNA提取試劑盒、DNeasy Mericon食品基因組DNA提取試劑盒、QuickGene DNA多樣本抽提試劑盒、Foodproof?GMO Sample Preparation核酸純化試劑盒,并進行改良,以嬰幼兒配方牛乳粉和嬰幼兒配方羊乳粉為研究對象,比較DNA提取效果、提取時間、擴增效率,結果如圖1所示。采用PDQeX的DNA提取質量濃度最高,嬰幼兒配方牛乳粉為5.2 ng/μL、嬰幼兒配方羊乳粉為63.20 ng/μL。采用4種柱層析試劑盒提取的DNA質量濃度差別不大,CTAB最低。從擴增效率看,CTAB擴增效果最低,PDQeX和4種柱層析試劑盒擴增效果差異不大,其中牛乳的Ct值在22.2~23.5之間,羊乳的Ct值在18.8~20.13之間。從提取時間看,CTAB耗時最長,約3 h,4種試劑盒耗時差別不大,約130~150 min,而PDQeX僅需溫控反應一步式獲取DNA,時間僅需17 min,大大縮短了提取時間。綜上,PDQeX所用的時間最短,操作步驟最簡便,提取效率高,可以滿足檢測需求,因此后續研究均采用此一步法進行DNA的快速提取。
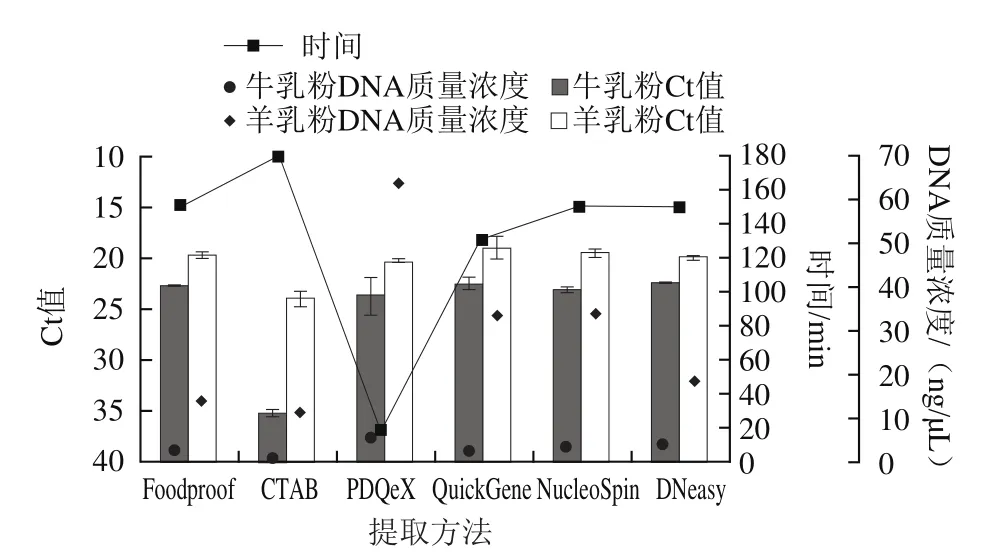
圖1 6種提取方法對嬰幼兒配方乳粉DNA效果分析Fig.1 Operational efficiencies of six DNA extraction methods for infant formula
2.2 real-time PCR方法檢測乳源成分方法的建立
2.2.1 引物探針設計與特異性篩選
考慮到乳粉在生產過程中需要經過噴霧干燥、高溫殺菌等加工處理,可能導致DNA斷裂或者降解,為保證能從不同加工程度的乳制品中檢測出目標動物成分,實驗在設計引物探針的時候將擴增靶序列控制在150 bp以內,設計的哺乳動物內參照靶序列為82 bp左右,牛族靶序列為81 bp,羊靶序列為79 bp,山羊靶序列為139 bp,綿羊靶序列為136 bp。引物和探針序列見表1。
為對待測樣品的DNA進行質量控制,根據常見的乳源(綿羊、山羊、家牛、水牛、牦牛等)均為哺乳動物的特性,設計了哺乳動物通用引物探針,real-time PCR通用性檢測結果顯示,設計的哺乳動物引物探針可以將所有哺乳動物源性成分擴出,擴增Ct值在24~30之間,表明通用性和覆蓋性較好,其他非哺乳動物物種均無擴增結果,表明擴增的特異性較好,可以作為乳源成分DNA質控檢測的內參照,PCR結果如圖2A所示。設計的牛引物探針可將牛乳、牦牛乳、水牛乳擴出,平均Ct值分別為25.71f0.08、25.92f0.09、26.18f0.21。其他常見畜禽魚物種(豬、梅花鹿、馬鹿、狗、兔、狐貍、水貂、大鼠、雞、鴨、魚),以及配方乳粉中常添加的植物源成分(葵花、大豆、椰子、玉米、菜籽)未出現非特異擴增,表明牛引物探針覆蓋性和特異性良好,結果如圖2B所示。
羊通用引物探針可同時擴增綿羊乳和山羊乳,平均Ct值分別為24.14f0.07和24.41f0.08,對其他常見畜禽魚以及嬰幼兒配方乳粉中常添加的植物源成分無非特異擴增,表明羊的引物探針覆蓋性和特異性良好,結果如圖2C所示。山羊和綿羊這兩對引物探針分別僅能特異性擴增山羊或綿羊成分,綿羊平均Ct值為20.15f0.09,山羊平均Ct值為26.34f0.17,特異性良好,結果分別如圖2D和2E所示。
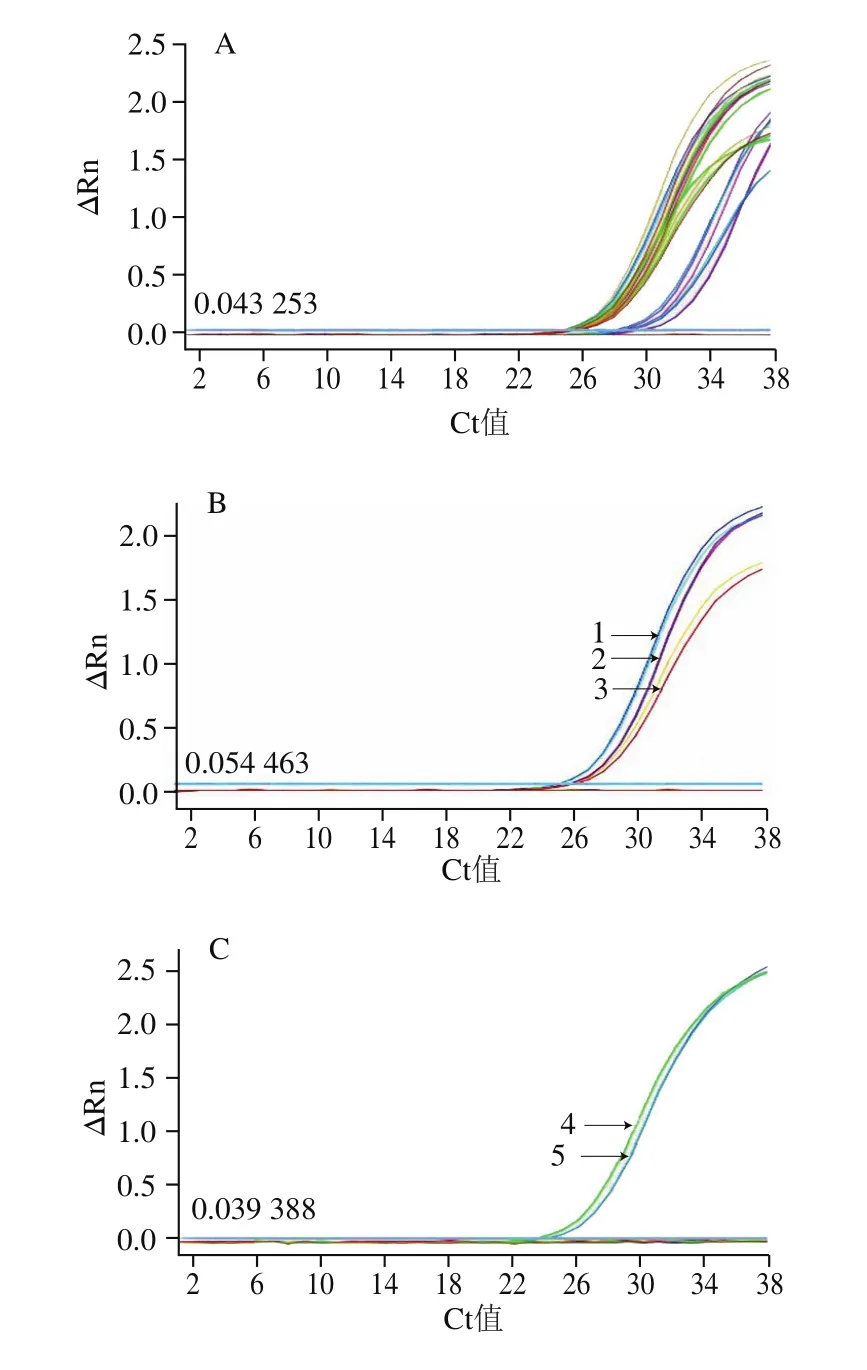
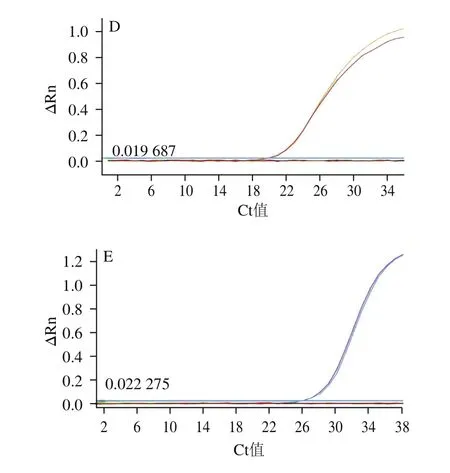
圖2 real-time PCR引物探針特異性分析Fig.2 Specificity of primers and probes used for real-time PCR
2.2.2 快速real-time PCR檢測體系的優化
為縮短檢測時間,實驗建立了快速real-time PCR檢測流程,以嬰幼兒配方牛乳粉和嬰幼兒配方羊乳粉的DNA為模板,以牛和羊引物探針為代表對擴增效率進行分析。如圖3所示,羊源性檢測結果表明,從反應程序①~⑧,擴增的Ct值幾乎保持不變,都在21左右,且擴增效率還稍有升高,Ct值從21.65提前到21.27。牛的擴增結果顯示,從反應程序①~⑤,擴增時間逐漸縮短,擴增效率卻逐漸提高,Ct值從26.16提前到25.50,之后再縮短檢測時間擴增效率開始逐漸下降,到第⑧個反應程序時Ct值升至28.88。綜合上述結果,以反應程序⑤作為快速real-time PCR檢測的最優反應程序,此時不僅擴增時間縮減到28 min 26 s,比反應程序①的反應時間74 min 58 s縮減了47 min左右,且擴增效率還有所提高,Ct值可減少1左右,因此后續均采用該程序進行快速real-time PCR檢測。
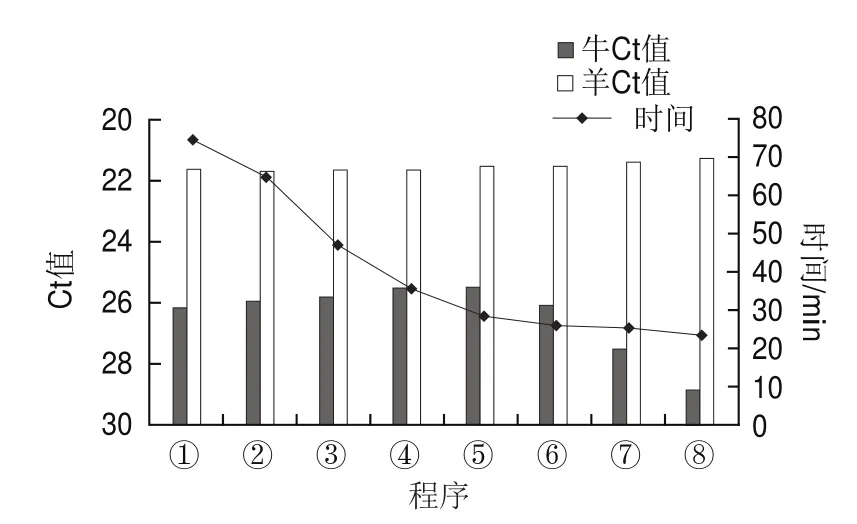
圖3 快速real-time PCR檢測體系優化結果Fig.3 Optimization of fast real-time PCR detection system
2.2.3 靈敏度分析
6個梯度濃度的DNA快速real-time PCR擴增檢測結果顯示:羊和綿羊的引物探針在DNA模板量為10 pg/μL時,尚有良好的擴增,此時平均Ct值分別為32.66f0.11和32.29f0.24;當低至1 pg/μL時,在特定的循環數內,不再有擴增,因此初步確定羊和綿羊的絕對靈敏度為10 pg/μL,結果如圖4C、D所示。哺乳動物、牛和山羊引物探針檢測結果顯示,當DNA質量濃度達到100 pg/μL時,仍有良好的擴增,此時平均Ct值分別為32.16f0.12:33.07f0.04、30.73f0.09;但當DNA模板量低至10 pg/μL時,牛的Ct值超出35,哺乳動物和山羊雖然有擴增,平均Ct值分別為34.94f0.72和34.28f0.10,但熒光信號ΔRn值較低,已經接近閾值,因此初步確定哺乳、牛和山羊的絕對靈敏度為100 pg/μL,結果如圖4A、B、E所示。根據儀器自動生成的標準曲線,哺乳動物、牛、羊、山羊和綿羊的線性相關系數R2分別為0.996、0.992、0.998、0.997、0.996(結果未提供),線性關系良好。因此確定本研究設計的哺乳動物、牛和山羊源性成分最低絕對靈敏度為100 pg/μL,羊和綿羊成分最低絕對靈敏度為10 pg/μL。
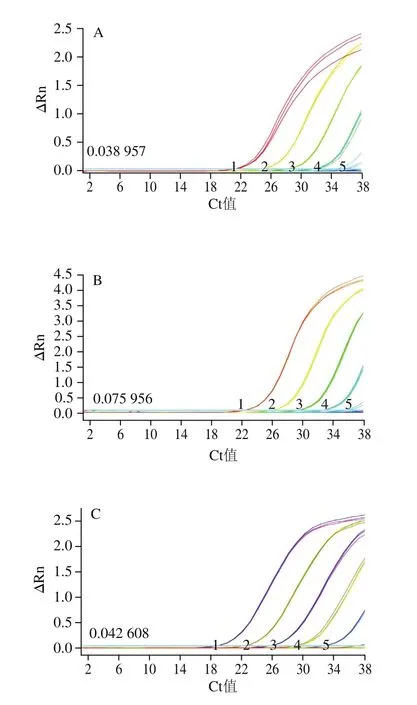
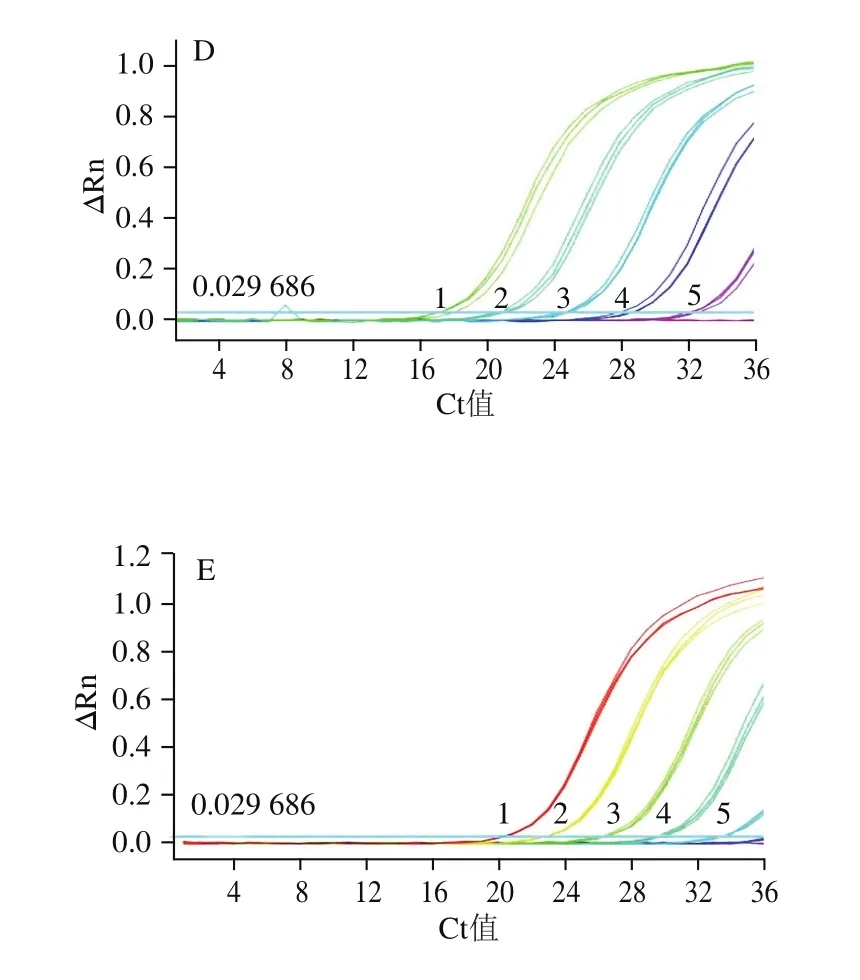
圖4 乳源成分real-time PCR檢測絕對靈敏度分析Fig.4 Sensitivity of detection of milk-derived ingredients by real-time PCR
2.2.4 常見嬰幼兒配方粉及乳源配料模擬添加牛源性成分靈敏度分析
按照1.3.1.7節方法進行實際靈敏度檢測。采用篩選的PDQeX prepGEM通用DNA提取試劑盒快速提取樣品DNA,檢測結果顯示,乳清、脫脂乳粉、全脂乳粉以及嬰幼兒配方中的牛源性成分檢出限均可達1%,線性回歸曲線R2均在0.9以上(圖5),可滿足適合用于實際樣品的檢測需求。
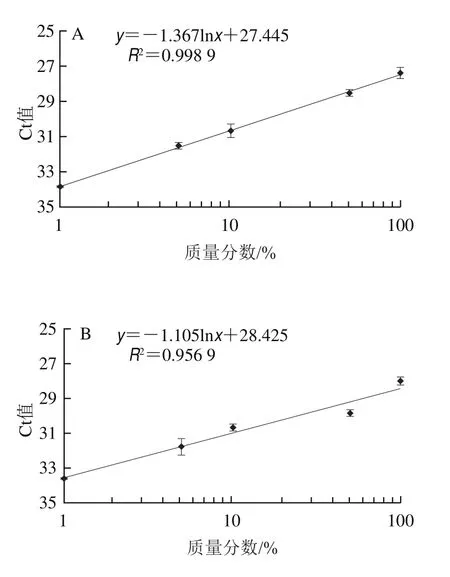
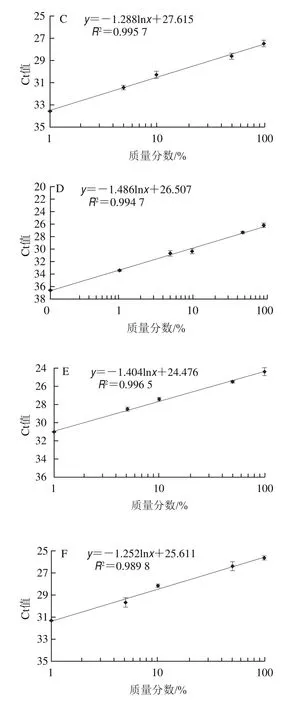
圖5 嬰幼兒配方羊乳粉及其常用配料中牛源性成分檢測實際靈敏度分析Fig.5 Sensitivity of detection of bovine milk-derived ingredients in infant formula and common milk powder and whey products
2.3 方法聯合檢測嬰幼兒配方乳粉及常用配料的乳源成分
聯合前期研究已建立的乳源蛋白雙向電泳蛋白檢測方法[29],采用建立的real-time PCR基因檢測方法對嬰幼兒配方乳粉乳源檢測的準確性進行評估。實驗以收集的10 份嬰兒配方粉及常用原料真實樣品為研究對象,進行檢測和結果對比分析。檢測結果對比顯示:1)牛乳清可檢出牛基因成分,雙向電泳可檢出牛乳清蛋白,未檢出牛乳酪蛋白成分。2)山羊乳清可檢出羊和山羊基因成分,綿羊乳清可檢出羊和綿羊基因成分,山羊綿羊乳清可檢出羊、綿羊、山羊基因成分;3種乳清雙向電泳檢測均可檢出羊乳清蛋白,均未檢出乳酪蛋白成分。3)全脂牛奶粉和脫脂牛奶粉可檢出牛基因成分,雙向電泳可同時檢出牛乳清蛋白和牛乳酪蛋白成分。4)全脂羊乳粉和脫脂羊乳粉可檢出羊和山羊基因成分,雙向電泳可同時檢出羊乳清蛋白和羊乳酪蛋白成分。5)嬰兒配方牛奶粉可檢出牛基因成分,雙向電泳可同時檢出牛乳清蛋白和牛乳酪蛋白成分。6)嬰兒配方羊奶粉可檢出羊和山羊基因成分,雙向電泳可同時檢出羊乳清蛋白和羊乳酪蛋白成分;未檢出牛乳清蛋白和牛乳酪蛋白成分。詳細結果如表2所示,典型樣品雙向電泳特征圖譜詳見圖6。通過兩種方法對收集的真實樣品的結果對比分析,雙向電泳的結果和核酸結果完全一致;并且雙向電泳的結果可以區分乳蛋白的來源,對核酸檢測結果是一個重要的補充。
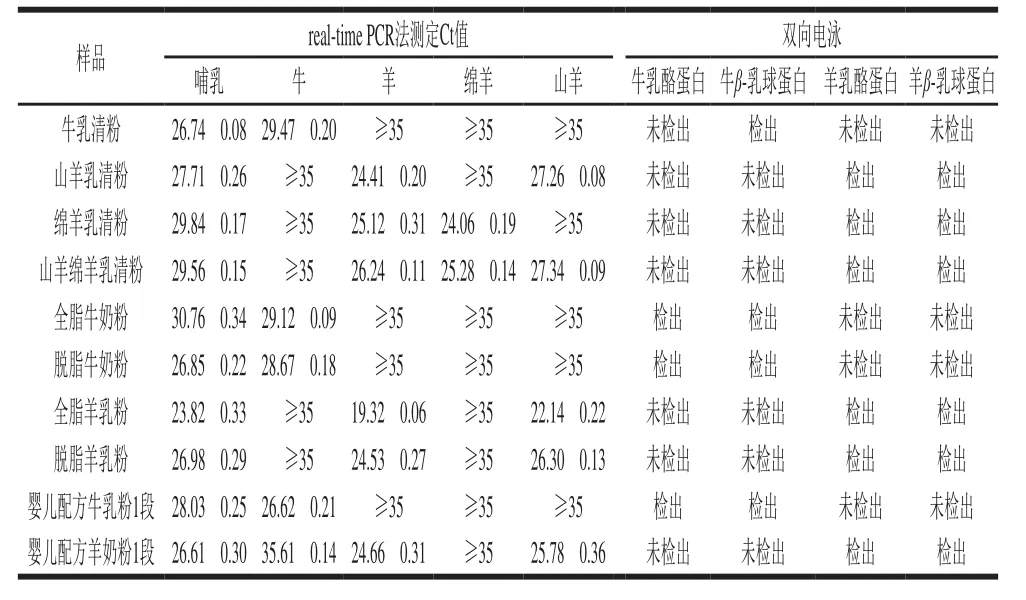
表2 嬰幼兒配方乳粉及常用原料的乳源成分檢測Table 2 Results of milk-derived ingredient detection in infant formula,whey powder and milk powder
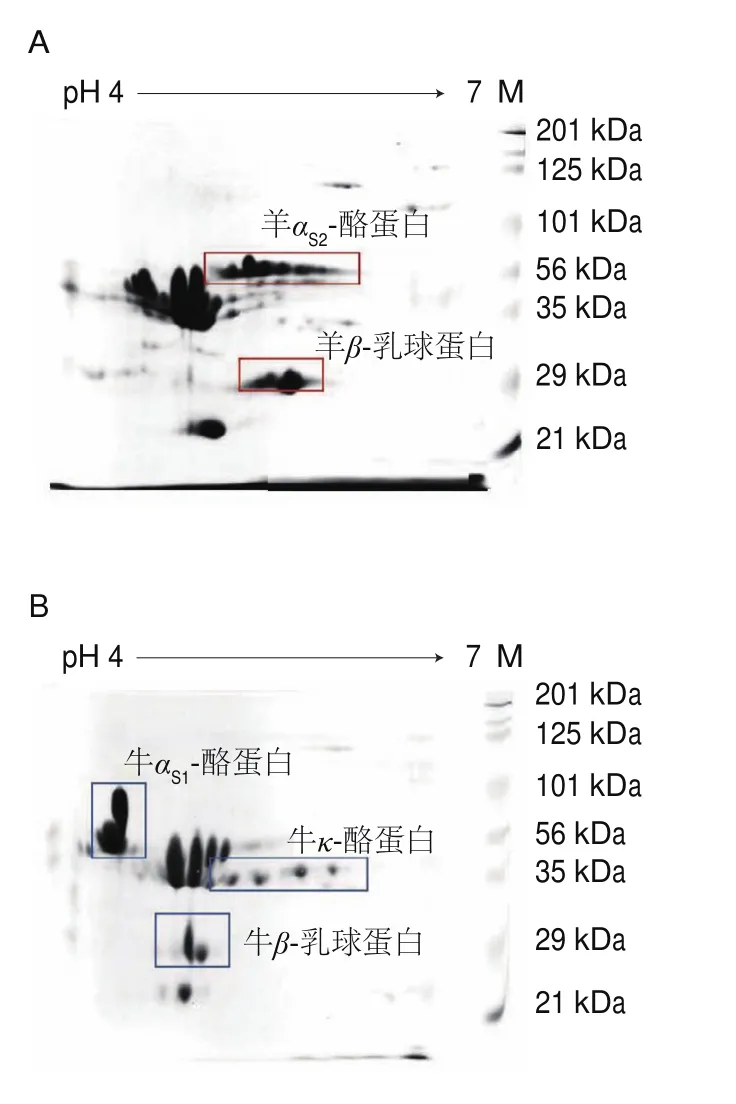
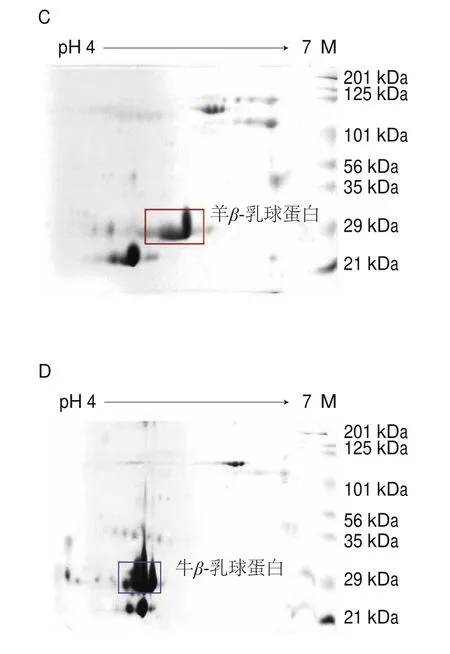
圖6 典型樣品雙向電泳特征蛋白圖譜Fig.6 Two-dimensional electrophoresis maps of typical milk powder samples
2.4 快速real-time PCR與雙向電泳聯合在市售嬰幼兒配方粉樣品乳源成分檢測中的應用
抽檢的20 份嬰幼兒配方粉羊奶粉,其中8 份配料表標識乳清蛋白來源為羊源,5 份為牛源,3 份標識含乳清但未標識乳源來源,4 份配料表標識無乳清蛋白配料,聯合檢測結果見表3。采用建立的方法提取樣品DNA,快速real-time PCR程序進行初篩,羊基因檢測結果顯示:所有樣品均檢出羊源性成分;有10 份檢出山羊成分,未檢出綿羊成分;有1 份檢出綿羊成分,未檢出山羊成分;其余9 份同時檢出山羊和綿羊成分,但其中有2 份配料標識是純山羊或純綿羊,即10%的樣品羊源性標識不一致。牛基因檢測結果顯示有11 份檢出牛源性成分,對這11 份牛基因檢測呈陽性的樣品進一步采用雙向電泳檢測,以確證其蛋白來源,結果顯示10%的樣品同時檢出牛乳酪蛋白和牛乳清蛋白,可能摻雜了牛乳;9 份檢出牛乳清成分,去除5 份已標識乳清來源為牛源的樣品,即20%的樣品檢出牛乳清摻雜成分。綜合real-time PCR和雙向電泳的檢測結果,8 份嬰幼兒配方粉羊奶粉檢出與標簽不符的乳源成分,占比40%。
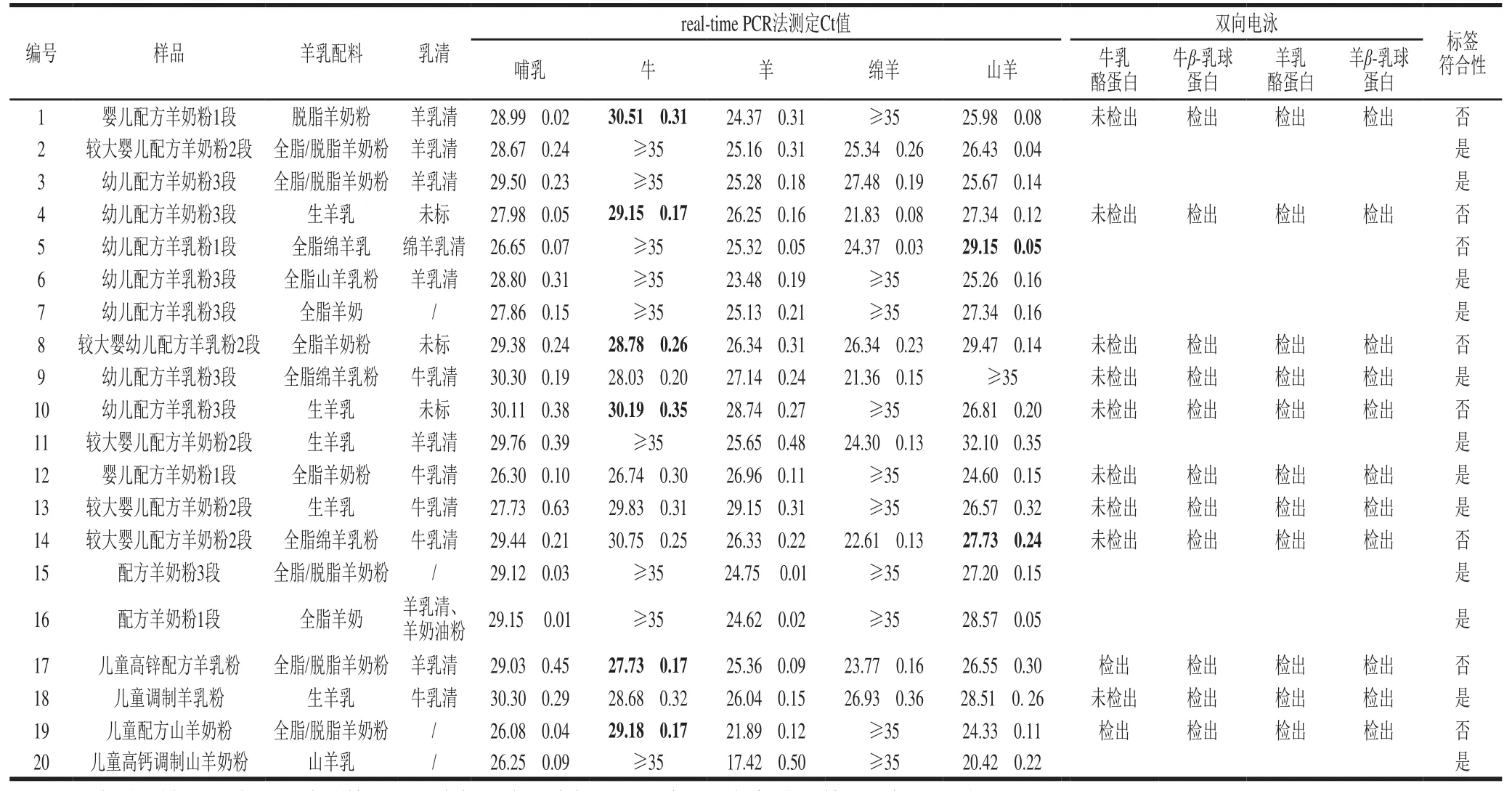
表3 市售嬰幼兒配方羊奶粉中乳源成分檢測Table 3 Results of detection of milk-derived ingredients in infant formula
3 討 論
3.1 建立嬰幼兒配方羊乳粉DNA快速提取方法的特點和優勢
為實現嬰幼兒配方羊乳粉樣品DNA的快速提取,實驗對提取方法進行篩選,通過CTAB法、一步法、吸附柱法的比較,最終選擇PDQeX prepGEM通用DNA提取試劑盒。該技術采用具有遠高于蛋白酶K降解能力的獨特嗜熱蛋白酶,其提取流程也不同于任何現有的核酸提取方法:不使用磁珠或吸附柱,也不使用SDS或CTAB,僅依靠溫控反應即可實現一步式獲取DNA。這樣既去除了磁珠法/吸附柱法中吸附、洗脫、洗滌等需要反復移液操作而造成回收損失的環節,又在快速提取的同時,保證高回收率。樣品前處理簡便、快速,可在17 min內獲取乳粉DNA,簡化了提取步驟,提高了DNA提取效率,可滿足現場快速篩查的需求。
3.2 聯合real-time PCR和雙向電泳進行嬰幼兒配方羊乳粉乳源檢測的必要性
本研究建立的嬰幼兒配方羊乳粉中牛、羊、山羊、綿羊成分檢測real-time PCR方法,可對嬰幼兒配方羊乳粉的乳源成分進行快速初判,且方法的靈敏度較高(檢出限1%),即便含有微量牛乳源也會被檢出,說明該方法在檢測的過程中不會造成假陰性和漏檢的情況。由于嬰兒配方乳粉是含有乳清、脫脂乳粉、全脂乳粉等復雜配料的混合制品,本研究推出聯合雙向電泳技術對乳源進行判別和確證的技術。采用該方法不僅可以區分牛乳和羊乳,還可依據乳清中不含酪蛋白的特性,進一步區分牛成分是來源于牛乳還是牛乳清。但相比于基因技術,雙向電泳技術對手工操作依賴較大,并且操作步驟復雜、耗時較長、靈敏度稍低,且無法準確區分山羊和綿羊乳,因此需要聯合基因的方法先對乳源進行快速初判,排除合格樣品,再針對檢出牛基因的樣品采用雙向電泳對乳源進行復核和確證。這樣不僅提高了檢測結果的準確性,也解決了以往配方乳粉中由于基質復雜導致乳源判別困難的問題,為配方乳產品乳源檢測提供有利的技術支撐。
3.3 市售嬰幼兒配方羊乳粉抽查結果顯示存在乳源摻雜現象
線上線下市售嬰幼兒配方羊乳粉的抽檢結果表明,30%的產品摻雜了牛乳來源成分,其中10%的樣品同時檢出牛乳酪蛋白和乳清蛋白,20%檢出牛乳清蛋白。同時檢出牛乳酪蛋白和乳清蛋白的產品屬于牛乳摻雜,違反了有關嬰幼兒配方羊乳粉的要求。檢出牛乳清蛋白的產品,20%未在配料表中進行乳源說明。依據國內外相關技術法規,例如國際食品法典委員會公布的標準Codex Stan 72-1981嬰兒配方及特殊醫用嬰兒配方食品(2015修訂版)[32]和國家食品藥品監督管理總局第26號令[7],嬰幼兒配方乳粉中動物源或植物源配料以及食品添加劑應當標出其種名,上述未在配料表中進行標注以及檢出非標識乳源成分的產品不符合相關規定。
4 結 論
建立了一步法DNA快速提取流程和快速real-time PCR檢測方法。從DNA提取到real-time PCR擴增,整個流程可在50 min內完成檢測,可以區分牛、羊、綿羊、山羊乳源物種成分,實際靈敏度達1%。可以彌補雙向電泳法操作復雜、耗時長、靈敏度不足、無法區分綿羊和山羊成分的不足。對牛基因檢測呈陽性的樣品進一步采用雙向電泳法可對乳源成分進行復核和確證,并依據乳清蛋白和乳酪蛋白的特性,可判定樣品摻雜成分是牛乳或牛乳清,能彌補real-time PCR法無法區分組分來源的不足。通過聯合兩種經典方法進行優勢互補、彌補不足,解決了以往利用單一檢測技術檢測配方乳粉時存在的精準度和靈敏度限制的問題,以及出現的指標重疊,難以下結論,甚至誤判的情況。為乳粉企業進行原料質控,政府實行監管和標簽查驗提供良好的技術支撐。

