高血壓腦出血不同手術方式對血清MMP-9、TNF-α表達的影響
許真,穆振欣,吳桂美,孫國慶,陳祥濤,孟令新,時峰,崔維剛,楊允學
高血壓腦出血(hypertensive intracerebral hemorrhage,HICH)是神經外科常見疾病之一,致殘率高,61%~88%的患者有重度殘疾,而急性期病死率高達30%~40%[1]。相關研究發現,ICH發病后血腫周圍水腫(perihematoma edema,PHE)是患者神經功能恢復及預后的主要影響因素之一[2]。目前對PHE的病理及生理變化研究正在不斷深入,多項研究證實基質金屬蛋白酶-9(matrix metalloproteinase-9,MMP-9)、血清腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)等炎癥因子在PHE發生發展過程中起到了極其重要的作用[3],而HICH患者不同手術方式對術后的炎癥反應有著不同的影響,對繼發性腦損傷、PHE程度也有不同的影響,并最終影響患者術后的神經功能恢復及預后。本研究回顧性分析2018年1月—2019年12月日照市人民醫院神經外科及日照市中心醫院神經外科收治的166例HICH患者的臨床資料,通過對比鎖孔內鏡及開顱血腫清除兩種不同手術方式術后血清MMP-9、TNF-α水平及PHE的動態變化,來探討不同手術方式對術后MMP-9、TNF-α水平變化與PHE的影響。現報告如下。
1 資料與方法
1.1 一般資料 共納入166例HICH患者,入院后通過采用隨機數字表的方法,以及隨機數余數分組法,分為兩組:一組鎖孔內鏡組,一組大骨瓣開顱組,均發病24 h以內接受手術治療。鎖孔內鏡組83例,其中男47例,女36例;年齡37~76歲,平均(48.3±5.2)歲;術前血腫量為(42.2±5.1)mL,GCS評分為(7.8±1.8)分。大骨瓣開顱組83例,其中男44例,女39例;年齡38~77歲,平均(47.9±6.2)歲;術前血腫量為(43.8±5.1)mL,GCS評分為(7.6±2.1)分。入組標準:幕上血腫且量大于30 mL HICH患者,排除顱內動脈瘤、顱內動靜脈畸形、血液系統疾病或腫瘤等其他原因導致的出血,排除腦疝患者,排除有心臟、肺臟、肝臟及腎臟等基礎疾病患者。另選同期健康體檢者30例作為對照組,其中男16例,女14例;年齡39~75歲,平均(49.36±5.14)歲。對三組患者術前的一般情況進行比較,兩組間差異無統計學意義(P>0.05),具有可比性。
1.2 手術方法
1.2.1 鎖孔內鏡組 鎖孔定位,銑刀開顱,骨瓣2~2.5 cm,腦穿針穿刺后,專用鞘置入血腫腔,形成柱狀工作通道,在內鏡引導下應用吸引器清除血腫,雙極電凝止血。清除血腫時采用一人雙手操作,術者左手內鏡,右手吸引器吸除血腫;電凝止血時采用二人三手操作,助手持鏡,術者左手吸引器,右手雙極電凝止血。縫合硬腦膜,連接片固定骨瓣。
1.2.2 大骨瓣開顱組 基底節區腦出血采用擴大翼點入路,骨窗大小約(7~8)cm×(9~12)cm,顯微鏡下分離外側裂,島葉皮質造瘺,進入血腫腔,腦壓板牽拉清除血腫,雙極電凝止血。枕葉、額葉等腦葉表面出血,根據血腫定位的馬蹄形或冠狀切口,皮質造瘺達血腫腔,腦壓板牽拉清除血腫,關顱時縫合硬膜或行減張修補,根據患者情況決定是否行去骨瓣減壓術。
1.3 術后腦水腫觀察 兩組手術患者術后1 d、3 d、7 d、14 d時復查CT橫斷位掃描,選擇水腫的最大層面測量水腫的最大徑(D)。水腫程度分級:0級無水腫D=0;1級水腫,D<2 cm;2級水腫2 cm≤D≤4 cm;3級水腫D>4 cm。水腫程度評分,0~1級者為輕度水腫,2~3級者為重度水腫。計算二組患者術后1 d、3 d、7 d、14 d 的重度水腫率。
1.4 炎性因子MMP-9、TNF-α水平檢測 兩組手術患者入院時、術后1、3、7、14 d時,對照組體檢時抽取靜脈血3 mL,以3 000 r/min離心處理10 min,取上層清液置于冷藏室內待檢,應用全自動蛋白測定儀(美國Beckman Array 360)采用酶聯免疫吸附法檢測MMP-9、TNF-α水平。
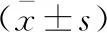
2 結 果
2.1 術后腦水腫情況 兩組手術組患者重度水腫率均在術后逐漸增加,在術后3 d達到高峰,后逐漸下降。二組間相比較,鎖孔內鏡組在術后第1 d、3 d、7 d、14 d 重度水腫率分別為9.6%、15.7%、7.2%、0%,明顯低于大骨瓣開顱組術后第1 d、3 d、7 d、14 d 的31.3%、42.2%、26.5%、9.6%重度水腫率,二組之間有顯著差異P<0.05(表1)。

表1 兩組術后不同時間重度水腫率比較
2.2 術后MMP-9表達 術前兩手術組血清MMP-9質量濃度與對照組相比明顯升高(P<0.05),但二組間無明顯差異,無統計學意義(P>0.05)。兩組患者MMP-9表達均在術后逐漸增加,在術后3 d達到高峰,后逐漸下降,大骨瓣開顱組14 d時仍維持一個較高水平。兩組相比較,鎖孔內鏡組在術后第1 d、3 d、7 d、14 d 的MMP-9分別為(182.32±12.67)μg/mL、(294.32±16.25)μg/mL、(164.32±11.56)μg/mL、(96.65±9.57)μg/mL,明顯低于大骨瓣開顱組術后第1 d、3 d、7 d、14 d 的(315.24±18.56)μg/mL、(412.59±15.42)μg/mL、(289.26±14.45)μg/mL、(135.56±11.85)μg/mL的MMP-9表達,兩組之間有顯著差異P<0.05(表2)。
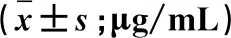
表2 3組受試者血清MMP-9水平比較
2.3 術后TNF-α表達 術前兩手術組血清MMP-9質量濃度與對照組相比明顯升高(P<0.05),但兩組間無明顯差異,無統計學意義(P>0.05)。兩組患者TNF-α表達均在術后逐漸增加,在術后3 d達到高峰,后逐漸下降,大骨瓣開顱組14 d時仍維持一個較高水平。兩組相比較,鎖孔內鏡組在術后第1 d、3 d、7 d、14 d MMP-9分別為(2.54±0.49)ng/mL、(2.84±0.52)ng/mL、(1.87±0.32)ng/mL、(1.32±0.26)ng/mL,明顯低于大骨瓣開顱組術后第1 d、3 d、7 d、14 d (4.86±0.54)ng/mL、(5.45±0.65)ng/mL、(4.34±0.57)ng/mL、(2.45±0.32)ng/mL的TNF-α表達,兩組之間有顯著差異(P<0.05)。見表3。
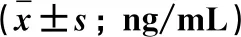
表3 3組受試者血清 TNF-α水平比較
3 討 論
HICH具有高發病率、高病死率、高致殘率的特點[5-8],常見原因是出血對神經功能區及神經傳導束的損傷[9],而PHE也是常見原因之一。PHE是指腦出血血腫增大后壓迫周圍腦組織,在血腫與周圍腦組織中形成壓力差,使腦組織移位(圖1A),使周圍血管循環受阻,引發血管自身調節障礙,腦組織缺血、缺氧,從而導致腦內血腫周圍水分增加進而促使腦容積增大的一種病理現象,可以引起顱內壓的急劇升高,嚴重者壓迫腦干導致腦疝的發生,危及患者的生命[10-11]。
目前PHE的發生及發展基礎機制仍未完全闡明,但研究表明[12],在PHE的發生、發展過程中,炎癥介質可能起了極其重要的作用。腦出血后腦血腫占位效應能夠迅速引發炎癥細胞表達浸潤,導致VEGF、 MMP-9、TNF-α等炎癥因子及氧自由基大量釋放,血管內皮細胞受損,引發細胞毒性腦水腫[13],而缺血缺氧及血腫分解產物毒性反應引起繼發性血腦屏障破壞,導致血管通透性增加,最終引發血管源性腦水腫的發生[14]。腦出血后血腫附近組織內MMP-9、MMP-2表達水平明顯上升,能夠水解膠原纖維、層粘連蛋白,直接破壞細胞間連接及細胞外基質分子,引起血腦屏障通透性增加,促進血管源性腦水腫的形成[15]。TNF-α可促使T細胞產生多種炎癥因子,引發炎性反應等多效級聯反應,同時引起神經細胞的凋亡、血腦屏障的破壞、局部腦血流下降及炎癥反應等繼發性腦損傷,導致混和性腦水腫的發生。研究表明各種炎性因子的表達與腦出血預后有明顯相關性,血清中細胞炎性因子水平變化可能有助于提示患者病情[16]。而腦出血不同治療方式,患者腦出血手術過程及術后病理生理均出現不同程度的變化,這也會引起不同炎性因子的變化方式,直接影響到 PHE的發生、發展及不同的程度變化。
鎖孔內鏡技術能夠快速開顱,在最短時間高效率地清除腦內血腫,解除血腫壓迫,使神經損傷降到最低[17-19]。小骨孔最大程度減少了腦組織的暴露,柱狀內鏡通道向周圍腦組織均勻傳遞壓力,形成多方向支撐,對腦組織沒有明顯牽拉,利用持續較高并緩慢下降的“腦-血腫”壓力差[4],使血腫自動涌向內鏡通道(圖1B),血腫易于清除,內鏡的多角度觀察,也更易于高效率的清除血腫,所以對腦組織破壞輕微,術后就不會產生嚴重的腦水腫,術后患者的神經功能恢復良好。本組術后患者的腦水腫情況明顯較開顱組輕,術后重度水腫率明顯低于大骨瓣開顱組,鎖孔內鏡組在術后第1 d、3 d、7 d、14 d MMP-9、TNF-α等炎癥因子表達明顯低于開顱組術后第1 d、3 d、7 d、14 d 表達,兩組之間有顯著差異(P<0.05)。鎖孔內鏡的手術方式能夠在最短時間高效率地清除腦內血腫,對腦組織破壞少,解除血腫占位效應,并清除血腫后防止了血紅蛋白等物質吸收引起的毒性作用,能夠明顯減少MMP-9、TNF-α等炎癥因子的釋放,充分表明鎖孔內鏡手術方式可以明顯降低術后MMP-9、TNF-α等炎癥因子表達,打斷了PHE的發生發展進程,更有利于HICH患者術后神經功能的恢復。
大骨瓣開顱后,腦組織首先向顱外膨隆,形成較小的“腦-血腫”壓力差,使腦組織向回移位壓力小,血腫不容易回縮,不易清除(圖1C),只能通過腦壓板牽拉腦組織,來顯露血腫進行清除,導致手術時間長,血腫清除率相對低,術中出血多、往往需要輸血治療,并且腦壓板過度的牽拉容易造成腦組織損傷,引起術后重度腦水腫,導致術后神經功能恢復差[20-21]。本組患者術后腦水腫情況明顯較鎖孔內鏡組重,術后重度水腫率明顯高于鎖孔內鏡組,大骨瓣開顱組在術后第1 d、3 d、7 d、14 d MMP-9、TNF-α等炎癥因子表達明顯高于鎖孔內鏡組術后第1 d、3 d、7 d、14 d 表達,兩組之間有顯著差異(P<0.05)。開顱手術方式雖然解除血腫占位效應,減少了血紅蛋白等物質吸收引起的毒性作用,能夠降低MMP-9、TNF-α等炎癥因子的釋放,但由于清除腦內血腫時間相對較長,廣泛牽拉對腦組織破壞較重,術后細胞毒性腦水腫及血管源性腦水腫仍然存在,術后MMP-9、TNF-α等炎癥因子表達會長時間維持一個相對較高水平,充分表明開顱手術方式可以降低術后MMP-9、TNF-α等炎癥因子表達,但相對鎖孔內鏡組下降程度較小,PHE的緩解程度較慢,術后仍有長時間的腦水腫有較高重度水腫率,不利于HICH患者術后神經功能的恢復。
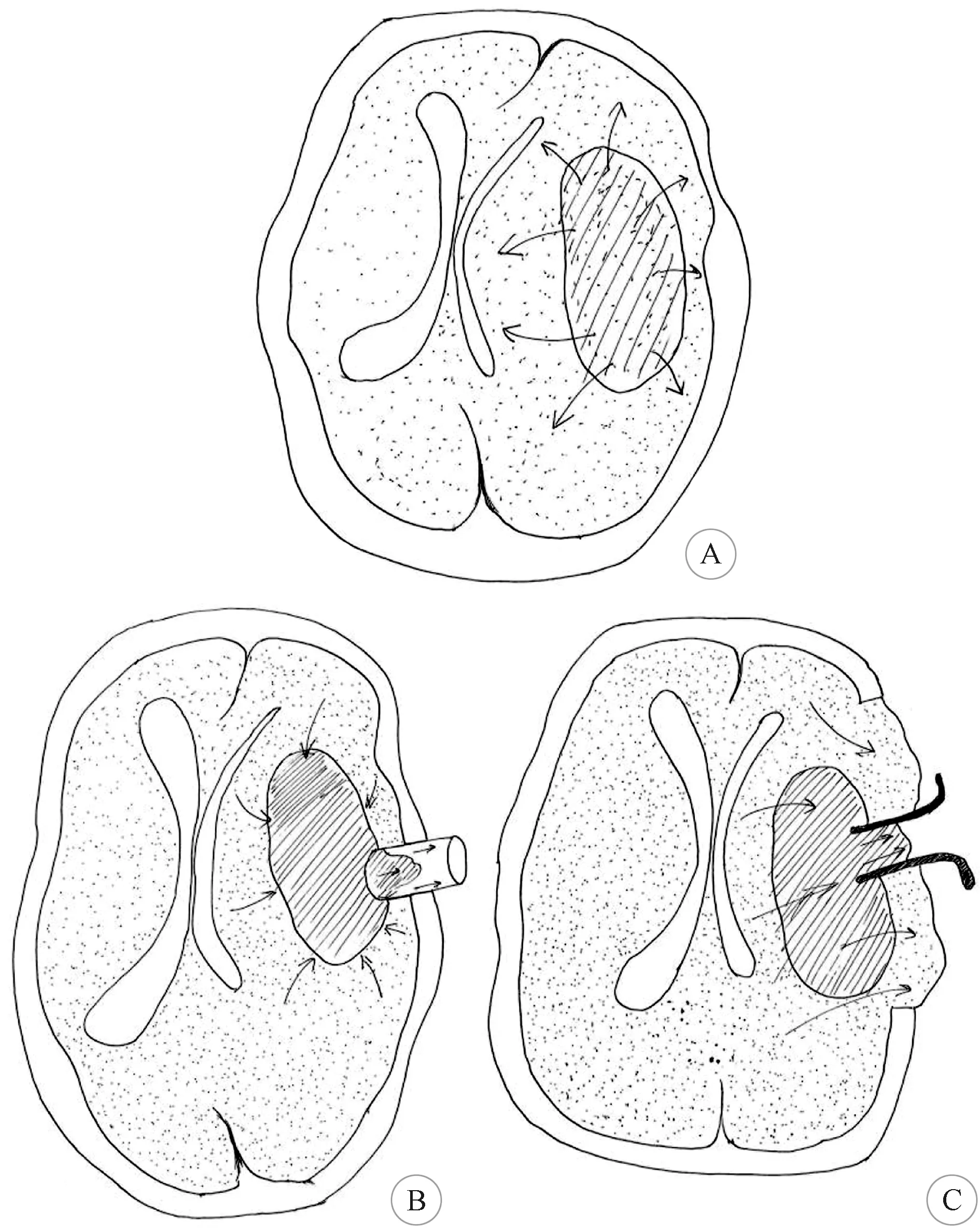
A:腦出血后血腫占位效應使血腫壓高于腦組織壓,使周圍腦組織移位,最終血腫壓與腦組織壓達到平衡后,移位停止; B:內鏡輔助下鎖孔入路血腫清除手術時,內鏡工作通道處血腫相對于其它部位血腫以及周圍腦組織相對負壓狀態,形成“腦組織-血腫-內鏡通道”壓力梯度差,使腦組織的進一步回縮,促使血腫向內鏡工作通道內涌入,不需要特殊顯露就可以在吸引等綜合作用下清除血腫; C:大骨瓣開顱手術時,去除骨瓣打開硬腦膜后,因為“遠處腦組織-血腫腔-骨窗處腦組織”壓力差,使局部腦組織在腦組織壓及血腫壓力的共同作用下向骨窗外膨出,腦組織壓明顯下降,在清除血腫時,“腦-血腫”壓力差小,血腫不回縮,不易清除,只能通過腦壓板的牽拉腦組織,來顯露血腫進行清除,過度的牽拉易造成腦組織損傷;箭頭方向代表腦組織及腦內血腫隨壓力改變移位方向[4]
綜上所述,HICH患者PHE的發生、發展過程中,血腫占位效應引起炎癥細胞表達浸潤,導致VEGF、 MMP-9、TNF-α等炎癥因子及氧自由基大量釋放,導致血管內皮細胞受損,引發細胞毒性腦水腫及血管源性腦水腫的發生。而手術治療可以清除顱內血腫,解除血腫占位效應,并清除血腫,防止血紅蛋白等物質吸收引起的毒性作用,能夠明顯減少MMP-9、TNF-α等炎癥因子的釋放,打斷了PHE的發生發展進程,有利于患者術后神經功能恢復。不同手術方式發揮的作用明顯不同,鎖孔內鏡手術更為微創、血腫清除效率更高,術后MMP-9、TNF-α等炎癥因子的釋放能夠更為迅速地下降,PHE的程度更低,更有利于HICH患者術后神經功能的恢復。
利益沖突:所有作者均聲明不存在利益沖突。

