丹酚酸A抑制血小板及中性粒細胞活化作用
楊文杰,王洪穎,馬璐璐,方樂玉,李春曉,張璐莎,張麗媛,王倩怡,孫 偉,冷雨澤,薛岳進,李夢瑤,陳 璐,王 虹
(1. 天津中醫藥大學中西醫結合學院, 天津 301617;2. 中國人民解放軍聯勤保障部隊天津康復療養中心, 天津 300141;3.天津中醫藥大學組分中藥國家重點實驗室, 天津 301617)
心血管疾病是由高脂血癥、動脈粥樣硬化等所導致,涉及心臟、動脈、毛細血管和靜脈的血液循環系統疾病,根據中國心血管危險因素研究顯示[1],我國心血管疾病患病率和死亡率仍處于快速增長階段,心血管病死亡率在居民死亡構成中居首位。心肌損傷后,血小板功能改變,中性粒細胞活化,內皮黏附分子上調,活化的血小板和中性粒細胞黏附到內皮表面,在梗死區形成中性粒細胞-血小板聚集體[2],使梗死面積進一步擴大,因此,抑制血小板和中性粒細胞活化是預防和治療心血管疾病的重要環節。目前臨床上常用的治療藥物作用靶點單一,選擇性低,在發揮抗血小板或抗炎作用的同時常伴有嚴重出血、胃腸道潰瘍等風險,發現并深入研究安全有效的抗血小板和抗炎藥物尤為重要,同時尋求新的靶點成為關注方向。
丹參為活血化瘀藥,廣泛應用于缺血性心血管疾病的治療,丹酚酸A(salvianolic acid A,SAA)是丹參水溶性成分中含量豐富的物質之一,也是最強的抗氧化酚酸之一[3],對血栓、炎癥、癌癥等有治療作用[4]。但是SAA是否通過影響血小板及中性粒細胞活化來抑制心肌缺血疾病還有待進一步研究。本研究通過測定SAA對體內外血小板和中性粒的活化來探討SAA治療心血管疾病的作用及作用機制。
1 材料與方法
1.1 動物SPF 級健康 C57BL/6 45小鼠,♀♂各半,6~8周齡,體質量 (20±2) g,均購自北京斯貝福生物技術有限公司,生產許可證號:SCXK(京)2016-0003,飼養與SPF級動物實驗室。所有實驗均經天津中醫藥大學臨床藥理研究所動物實驗倫理審查委員會批準。實驗中涉及的方法均根據動物實驗相關指南和法規進行。
1.2 藥品與試劑替羅非班(tirfiban,批號WKQ-17915)購自四川省維克奇生物科技有限公司;丹酚酸A(salvianolic acid A, SAA,批號DST180201-008)購自成都德思特生物技術有限公司;二磷酸腺苷二鈉鹽(adenosine-5′-diphosphate disodium salt, ADP,批號SLBN0134V)購自Sigma公司;CD45 antibody(貨號:Ab10558)購自abcam公司;CD42c antibody(貨號:YT6028)購自Immunoway公司;APC anti-mouse/rat CD62p antibody(貨號:148303)購自Biolegend公司;PVDF膜(貨號:HVHP01300)購自密理博有限公司;BCA 試劑盒(貨號:PC0020)購自北京索萊寶科技有限公司。
1.3 儀器小動物呼吸機(Harvard Inspira公司,美國),體視顯微鏡(Leica公司,德國),高分辨率超聲儀(Visual Sonics公司,加拿大),流式細胞儀(BD 公司,美國),Flex Station 3酶標儀(Molecular Device 公司,美國),倒置熒光顯微鏡(Nikon公司,日本)
1.4 小鼠MI模型的建立建立小鼠MI模型,小鼠麻醉、固定、氣管插管呼吸機正壓通氣,潮氣量為1 mL,將呼吸頻率調至100次·min-1,呼吸比2∶1。開胸暴露心臟,以眼科縫線沿左心耳下緣2 mm穿過冠狀動脈左前降支(left anterior descending coronary artery,LAD),結扎引起LAD閉塞,Sham組僅穿縫線但不結扎。建模成功后,逐層縫合胸腔并排出胸腔內氣體。小鼠清醒后隨后常規飼養。
1.5 分組及給藥隨機將C57BL/6小鼠分為如下組(每組9只):正常對照組(生理鹽水)、MI模型組、SAA低劑量組(5 mg·kg-1)、SAA高劑量組(10 mg·kg-1)、Tirofiban組(0.87 mg·kg-1)。適應性喂養7 d后進行MI模型的建立及術后尾靜脈注射給藥,MI+SAA 組給予SAA尾靜脈注射(5 mg·kg-1或10 mg·kg-1,每天1次),MI+Tirofiban組給予Tirofiban尾靜脈注射(0.87 mg·kg-1),連續3 d;MI組以同等量的溶媒(生理鹽水)注射。正常對照(sham)組尾靜脈灌注等量溶媒(生理鹽水),連續3 d。
1.6 心功能評價持續吸入異氟烷麻醉小鼠,仰臥固定至37 ℃恒溫板。小鼠四肢與電極相連監測心率。胸部脫毛并涂抹超聲波耦合劑,分別在短軸和在四腔面檢測小鼠心臟的舒縮和血流變化。選取連續5個心動周期測量計算左室射血分數(left ventricular ejection fraction,LVEF)、左室短軸縮短率(fractional shortening,FS)、收縮末期左室前壁厚度(systolic left ventricular anterior wall,LVAWs)、舒張期左室前壁厚度(diastolic left ventricular anterior wall,LVAWd) 、收縮末期左室后壁厚度(systolic left ventricular posterior wall,LVPWs) 、舒張期左室后壁厚度(diastolic left ventricular posterior wall,LVP-Wd)、左室舒張早期最大血流/二尖瓣心房收縮期最大血流(ratio of E /A),數據取平均值。
1.7 心肌組織HE染色將處死后小鼠的心臟剪取左心室,含室間隔部分,用10%的甲醛浸泡固定,沿左室長軸的中點行組織切片,其厚度保持在4 μm左右。用去離子水清洗切片組織后,蘇木精染色3~5 min,再次用去離子水清洗后,置入含1% HCl的無水乙醇中固定,之后再用伊紅染色1~4 min,去離子水清洗干凈,無水乙醇固定后石蠟包埋,置入普通顯微鏡的40×物鏡鏡頭下觀察。
1.8 免疫組化檢測小鼠心臟中CD42c、CD45、Ly6G以及C3aR的表達小鼠心臟組織石蠟切片,脫蠟水化,封閉,加抗原修復液進行冷修復,一抗,即CD42c、CD45、Ly6G、C3aR(1 ∶100)抗體,4 ℃孵育過夜,次日室溫放置30 min后,先滴加反應增強液室溫反應10 min,后滴加二抗,室溫反應20 min,DAB顯色5~8 min,蘇木精復染20 s,脫水,封片顯微鏡觀察CD42c、CD45、Ly6G、C3aR的表達情況。
1.9 ELISA檢測血小板中中性粒細胞NE、MPO、MMP9、LF的釋放根據ELISA 說明書進行,在NE、MPO、MMP9、LF 細胞因子檢測板中加入樣本或對應的標準品,嚴格按照試劑盒說明書操作,加檢測抗體孵育,洗板,加酶孵育,洗板,加入顯色劑顯色反應15 min后,加終止液使反應終止,立即在酶標儀設置參考波長610~630 nm,檢測波長450 nm測出各孔吸光度值,用ELISACALC軟件繪制標準曲線并計算出中性粒細胞NE、MPO、MMP9、LF 細胞因子的水平。
1.10 Western blot法檢測相關蛋白的表達取分離后的血小板懸液,分別加入生理鹽水、Tirofiban以及不同濃度的SAA于37 ℃,孵育20 min,將空白對照組,Tirofiban、SAA組分別加入20 μmol·L-1ADP于37 ℃,孵育10 min,3 000 r·min-1離心10 min,去除上清,沉淀按照組織裂解液 ∶PMSF ∶磷酸酶抑制=100 ∶1 ∶1比例加入配置好的裂解液,冰上裂解 1 h。4 ℃,15 000 r·min-1離心 20 min,收集上清,BCA 蛋白定量。電泳,用PVDF膜進行轉膜;TPBS配置脫脂牛奶(5%)在37 ℃溫箱中孵育2 h;洗膜,孵育一抗,即兔抗PI3K、p-PI3K、AKT、p-AKT、VSAP、p-VASP(1 ∶1 000)抗體,4 ℃結合12 h以上;洗膜;37 ℃孵育二抗2 h;洗膜顯影。
1.11 免疫熒光法檢測炎性趨化因子CXCL1、CXCL2的釋放將處死后小鼠的心臟剪取左心室,含室間隔部分,切片脫蠟后微波處理15 min,PBS沖洗3次×3 min后兔血清封閉切片,加入一抗CXCL1(1 ∶50)或CXCL2(1 ∶50)抗體,4 ℃ 孵育過夜。次日取出,PBST沖洗3次×3 min,和Cy3標記的熒光二抗共孵育1 h,滴加 DAPI 復染,封片。Nikon倒置熒光顯微鏡的40×物鏡鏡頭下觀察,PS軟件分析計算紅綠藍熒光比值。
1.12 流式細胞術檢測血小板CD62p的熒光強度分別于小鼠MI術前、術后3 d,采集經肝素鈉抗凝的外周血,提取分離血小板,各組分別加入生理鹽水、Tirofiban、SAA不同濃度于37 ℃,孵育20 min,將空白對照組加生理鹽水,將陽性藥和丹酚酸A組加入20 μmol·L-1ADP于37 ℃,孵育10 min,每管加入CD62p-APC 各1 μL,再加入10 μL處理過的血小板懸液及89 μL臺式緩沖液,4 ℃避光孵育30 min,加入500 μL 1% 多聚甲醛,充分混勻,于1 h內上機檢測,用FACS流式細胞儀檢測CD62p表達的細胞數,每份標本檢測10萬個細胞,以表達CD62p細胞占總細胞的比例表示外周血中血小板活化的數量,用 Cell Quest 軟件分析并記錄外周血中血小板活化的比例。

2 結果
2.1 SAA對MI小鼠心功能的影響如Tab 1超聲結果所示,與Sham相比,MI模型組(Saline)LVEF、LVFS明顯降低(P<0.05),表明心肌梗死模型造模成功。與MI模型組(Saline)比,Tirofiban組和SAA高劑量組能夠提高左心室的舒張收縮功能,射血分數、短軸縮短率均明顯高于模型組(P<0.05),其差異具有統計學意義。表明SAA能夠改善MI小鼠的心功能。
2.2 SAA對MI小鼠心臟組織形態變化的影響Fig 1的HE染色中Sham組小鼠的心肌組織和細胞結構完整清晰;Saline組小鼠心肌組織以肉芽和瘢痕組織為主,心肌組織染色較淺,呈疏松化。和Saline組相比,SAA組心肌組織和細胞結構較為完整,形態學清晰;Tirfiban組小鼠心肌組織形態和Sham組相似。表明SAA能夠明顯減輕MI誘導的小鼠心肌損傷。
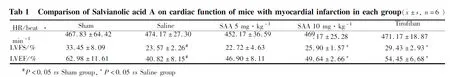
2.3 SAA對MI小鼠血小板募集及血小板活化的影響Fig 2A-B用IHC染色檢測心肌組織中CD42c的表達,應用FCM檢測小鼠血液中CD62p的表達;IHC 染色陽性表達的蛋白呈棕黃色,結果表明Sham 組小鼠心肌組織中CD42c以及小鼠血液中CD62p均有一定量的表達;Saline組小鼠心肌組織中CD42c以及小鼠血液中CD62p表達較Sham組明顯增加(P<0. 01);SAA組及Tirfiban組小鼠心肌組織中CD42c以及小鼠血液中CD62p表達均較Saline組明顯降低(P<0.05,P<0.01);提示SAA可以減少MI小鼠心臟組織中血小板的募集,抑制MI小鼠的血小板活化。通過Fig 2C結果可知,SAA對小鼠尾出血時間沒有明顯的影響。以上結果提示,SAA能夠抑制MI誘導的血小板募集及血小板活化,同時不影響小鼠的出血時間。

Fig 1 Effects of SAA on histomorphology of mice with myocardial infarction
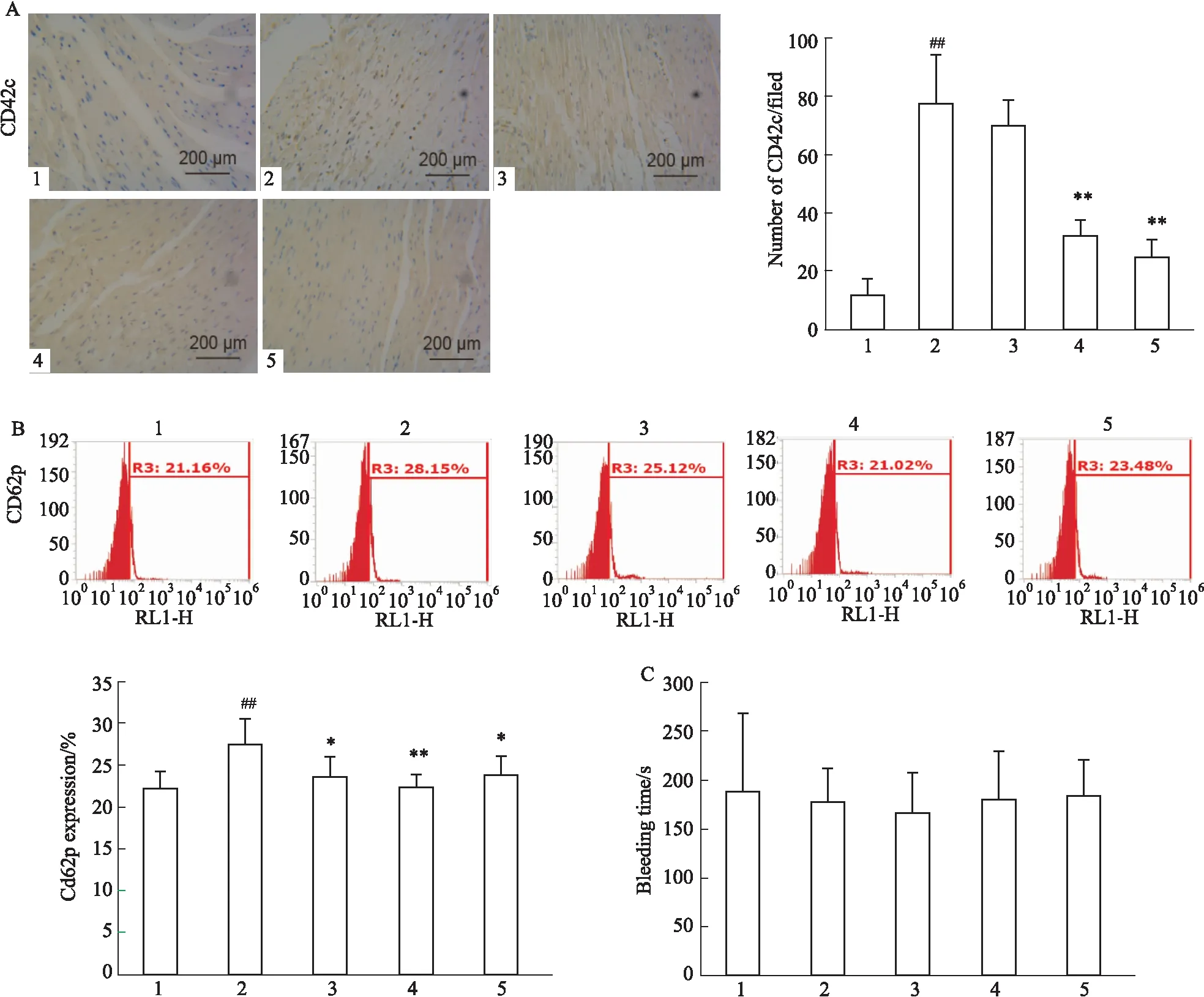
Fig 2 Effects of Salvianolic acid A on platelet recruitment, activation and tail bleeding time in infarcted area of mice with myocardial infarction
2.4 SAA對ADP誘導血小板PI3K、Akt、VASP表達的影響Fig 3采用Western blot染色檢測小鼠血液中p-VASP/VASP、p-PI3K/PI3K和p-AKT/AKT蛋白的表達變化,Sham組小鼠血液中p-VASP/VASP、p-PI3K/PI3K 和p-AKT/AKT均有一定量的表達;ADP組小鼠血液中p-PI3K/PI3K較Sham組明顯升高(P<0.01),p-AKT/AKT較Sham組明顯升高(P<0.05),p-VASP/VASP較Sham組明顯降低(P<0.05) ; SAA 組小鼠血液中p-PI3K較ADP組明顯降低(P<0.05,P<0.01),p-AKT表達較ADP組明顯降低(P<0.05,P<0.01),p-VASP/VASP較ADP 組明顯升高(P<0.01)。結果顯示,SAA可以上調ADP誘導的血小板中p-VASP的表達,下調p-PI3K和p-Akt的表達,表明SAA可通過調節PI3K、AKT、VSAP蛋白磷酸化發揮抗血小板作用。
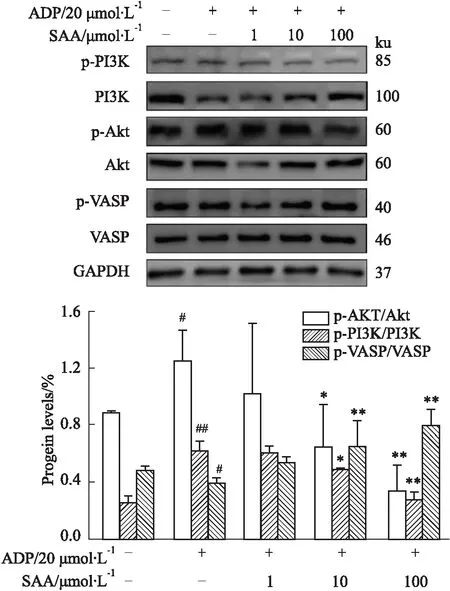
Fig 3 Effect of Salvianolic acid A on platelet activation induced by ADP
2.5 SAA對MI小鼠梗死區白細胞及中性粒細胞的影響Fig 4A-B用IHC染色檢測心肌組織中CD45以及Ly6G的表達,Fig 4C用IF染色檢測心肌組織中CXCL1、CXCL2的表達,IHC染色陽性表達的蛋白呈棕黃色,IF染色陽性表達的蛋白分別呈紅色和綠色熒光,結果表明Sham組小鼠心肌組織中CD45、Ly6G、CXCL1及CXCL2均有一定量的表達;Saline組小鼠心肌組織中CD45、Ly6G、CXCL1及CXCL2表達較Sham組明顯增加(P<0.01);SAA組及Tirfiban組小鼠心肌組織中CD45、Ly6G、CXCL1及CXCL2表達均較Saline組明顯降低(P<0.05,P<0.01);提示SAA可以使MI小鼠梗死區的白細胞以及中性粒細胞浸潤降低,降低炎性趨化因子的表達。表明SAA能夠明顯抑制MI誘導的白細胞及中性粒細胞的浸潤。
Fig 4 Effect of Salvianolic acid A on leukocyte and neutrophil infiltration in mice with myocardial infarction
2.6 SAA對C3aR的表達及C3a誘導的中性粒細胞活化的影響有研究表明,在心梗患者和實驗模型中,心肌組織和外周血中補體的激活與心梗嚴重程度密切相關[5],其中補體成分過敏毒素C3a及其受體C3aR已經成為心肌缺血后炎癥損傷的重要介質[6]。補體成分C3是補體級聯的中心成分,其活化產物C3a可以通過與中性粒細胞表面的C3a受體(complement C3a receptor,C3aR)結合,導致中性粒細胞活化進而促進局部炎癥,加重心肌損傷[7]。心肌梗死病理狀態下,C3a/C3aR途徑易激活中性粒細胞,使其活化。Fig 5A用IHC染色檢測心肌組織中C3aR的表達,IHC染色陽性表達的蛋白呈棕黃色,結果表明Saline組小鼠心肌組織中C3aR表達較 Sham組明顯增加(P<0.01);SAA組及Tirfiban組小鼠心肌組織中C3aR表達均較Saline組明顯降低(P<0.05),結果提示SAA可以抑制MI小鼠心肌組織中C3aR的表達,從而降低中性粒細胞的活化。Fig 5B-E用ELISA檢測小鼠血液中中性粒細胞活化標志物NE、MPO、MMP9、LF 的釋放,C3a模型組與對照組相比NE、MPO、MMP9、LF蛋白表達明顯升高(P<0.05,P<0.01),SAA組與C3a模型組相比,NE、MPO、MMP9、LF表達明顯降低(P<0.05,P<0.01),結果提示SAA可以抑制C3a及C3a誘導的小鼠血液中中性粒細胞活化。表明SAA可能是通過抑制C3aR及C3a的表達發揮抗中性粒細胞活化作用。
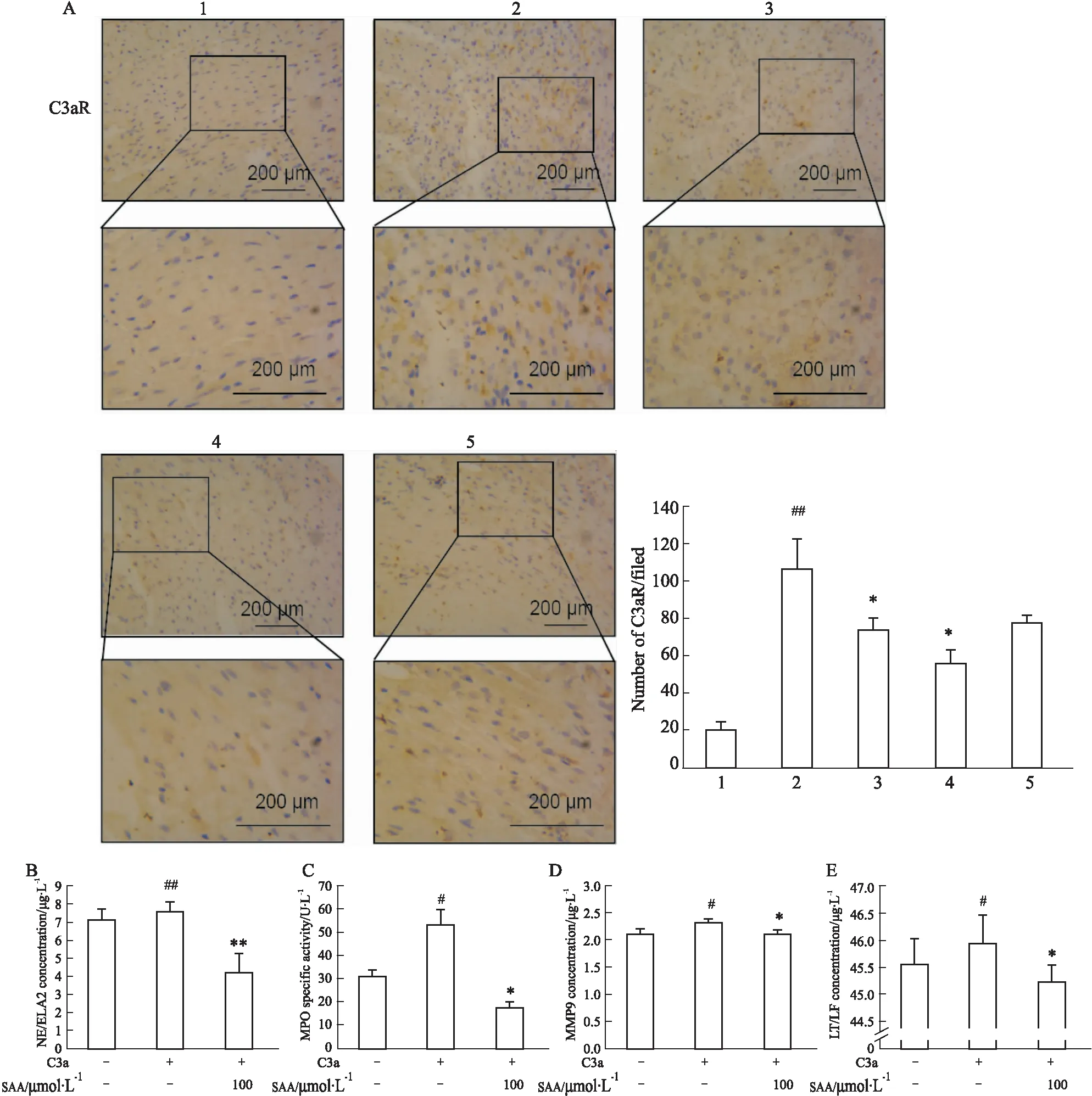
Fig 5 Effects of Salvianolic acid A on neutral particle activation
3 討論
MI等缺血性疾病嚴重威脅人類健康,近年來發病趨勢呈直線上升,是當今全球最主要的死亡原因之一[8]。在缺血性心血管疾病中,血液呈高凝狀態,并伴隨動脈及微動脈血栓,激活的炎癥性因子促進內皮通透性,介導血小板活化,同時引起免疫系統發生級聯反應,形成并擴展動脈粥樣硬化斑塊,加速動脈血栓形成[9]。中醫學理論將缺血性心血管疾病歸因于氣滯血瘀所致氣血流通受阻。傳統活血化瘀藥有疏通氣血,促進缺血組織修復的作用,廣泛應用于血瘀證的治療。丹參具有活血化瘀、除煩益氣之功。SAA是丹參重要的水溶性酚酸類化合物,研究表明其具有抗血栓[10]、抗炎[11]等作用,但其作用機制尚未清晰闡明。所以,我們探討SAA是否通過影響血小板及中性粒細胞活化來改善心肌缺血疾病。
MI導致最初的病變區,其特征是局部產生細胞因子介導的強烈炎癥反應。急性MI時,適度的炎癥反應是心肌愈合和修復過程中必不可少的,但過度的炎癥反應會加重心肌損傷,導致MI[12]。中性粒細胞為MI早期主要的炎性細胞,主要來源于骨髓中的造血干細胞,可刺激趨化因子和炎性介質的釋放,促進巨噬細胞、中性粒細胞向缺血區募集。替羅非班在研究和應用中發現具有抑制血小板活化和炎癥反應的雙重作用。SAA能夠改善MI小鼠心臟的心功能及心臟組織形態。同時SAA可以抑制缺血組織中血小板的募集、抑制外周血中血小板的活化,炎性細胞的浸潤以及炎性趨化因子CXCL1、CXCL2的釋放,從而使缺血后血栓炎癥明顯減輕,促進缺血區的組織恢復,改善心功能。
血小板是血栓形成的主要介質,對于組織損傷修復至關重要,并且在血管炎癥條件下發揮作用。止血失衡會導致動脈粥樣硬化斑塊形成,導致血栓和局部組織缺血。在正常的機體中,血小板活化處于動態平衡狀態,在心肌缺血情況下,激活的血小板可以調節不同的細胞因子和趨化因子的釋放,促進組織損傷修復[13]。CD62p從可溶性α致密顆粒中釋放,暴露血小板表面,通過白細胞分泌的P選擇素糖蛋白配體-1(P selectin glycoprotein ligand 1,PSGL1)與中性粒細胞結合[14]啟動細胞內信號,介導整合素活化,加劇細胞間的黏連,進而形成血栓。此外,活化的血小板還可以釋放血栓素A2(thromboxane A2,TXA2)及5-羥色胺等細胞因子,可以通過刺激血管使其收縮并加重血管痙攣,進而誘發血栓形成,流式結果顯示,SAA下調CD62p表達量;提示SAA抑制血小板的活化。近年來發現,體內的信號通路如PI3K/Akt、VASP與血小板活化相關,從血小板活化信號通路中研究藥物抗血小板作用成為研究重點。已有研究表明,SAA通過PI3K/Akt通路抑制血小板活化[15],本實驗結果對此進行了驗證,結果顯示SAA通過PI3K/Akt通路發揮抗血小板作用。VASP為血管擴張刺激磷酸蛋白,位于血小板細胞內,通過ADP受體P2Y12信號通路使其磷酸化,受環磷酸腺苷(cyclic adenosine monophosphate,AMP)途徑調控,VASP磷酸化水平與血小板活化呈負相關。本實驗結果表明丹酚酸A可以上調VASP磷酸化,提示SAA可以通過促進VASP的磷酸化抑制血小板的激活。
中性粒細胞是由骨髓中的造血干細胞產生,干細胞增殖并分化為裝備有大量顆粒蛋白的成熟中性粒細胞。這些顆粒蛋白使中性粒細胞能夠對微生物產生致命的打擊,但也會造成巨大的組織損傷。中性粒細胞作為休眠細胞在血液中循環。在感染部位,內皮細胞繞過中性粒細胞并引導它們通過內皮細胞間隙,由此中性粒細胞被激活和調節,以便隨后與微生物相互作用。一旦進入組織,中性粒細胞就會通過從顆粒中釋放出來的殺菌物質或代謝活化產生的殺菌物質來殺死微生物。最后,中性粒細胞可以排出附著有殺菌蛋白的DNA,作為微生物的細胞外陷阱[16]。
中性粒細胞損傷周圍組織的傾向與其激活狀態密切相關,中性粒細胞一旦被激活,就會釋放吞噬體或分泌抗菌和炎癥蛋白,這些蛋白位于細胞質顆粒中,這一過程被稱為脫顆粒反應。脫顆粒反應增強和呼吸爆發是造成重大損害的先決條件。中性粒細胞有4種不同類型的細胞顆粒,儲存不同的蛋白分子。初級顆粒主要儲存NE、MPO等,次級顆粒主要包含LF和MMP9,三級顆粒富含明膠酶,囊泡主要存儲磷酸酶和血漿蛋白等[17]。缺氧顯著上調了中性粒細胞主要顆粒的釋放,在一定程度上促進了內皮細胞損傷。脫顆粒反應衍生的蛋白質是中性細胞抗微生物以及NET釋放過程所必須的。其中NE和MPO 是 NET 形成的必要條件[18]。因此,MPO或NE的水平決定了中性粒細胞激活的程度。中性粒細胞在刺激后更容易受到C3a/C3aR的激活,發生脫顆粒反應。免疫組化結果顯示,SAA可以抑制心肌缺血組織中C3aR的表達,從而降低中性粒細胞的脫顆粒反應。ELISA 結果顯示,與C3a模型組相比,SAA可以抑制C3a誘導的中性粒細胞脫顆粒,提示SAA通過調控C3a/C3aR 通路抑制中性粒細胞活化過程中的脫顆粒反應。
綜上所述,本研究表明SAA能夠改善MI小鼠的心功能,顯著降低心肌梗死小鼠心臟梗死區的中性粒細胞浸潤活化和血小板在心臟梗死區的募集和活化,降低該區域炎癥反應。抗血小板作用是通過調節血小板相關的通路PI3K/Akt、VASP發揮作用,降低中性粒細胞活化可能是通過抑制C3aR及C3a的表達發揮作用。

