p H響應性纖維素納米纖絲/海藻酸鈉基水凝膠的制備及其釋藥性研究
陳甜甜 王 聰 劉婉嫕 欒云浩 李宇航 劉鵬濤劉 忠
(天津科技大學天津市制漿造紙重點實驗室,天津,300457)
水凝膠是由水溶性或親水性的高分子通過一定的化學交聯或物理交聯形成的具有特殊三維網狀結構的高分子材料。通過不同的條件控制將刺激響應性的官能團引入到水凝膠結構中,即可制備出pH響應性等適應各類環境變化的智能水凝膠[1-3]。由于對環境的敏感性,智能水凝膠特別是pH響應性水凝膠受到了生物醫藥領域(如藥物載體、人體器官以及組織工程支架等)研究人員的廣泛關注[4-7]。pH響應性水凝膠可以根據人體胃部和腸道酸堿度的不同實現對藥物的控釋緩釋行為。如何根據載體材料結構和藥物特性選擇合適的方法將藥物負載到載體上并達到較高的載藥量和包封率是目前醫藥領域研究的熱點之一。
纖維素來源廣泛(植物纖維、細菌等),是地球上最豐富的天然高分子材料[8]。使用纖維素材料制備的水凝膠可完美地解決合成高分子凝膠難以降解、生物相容性差的難題,因此受到醫藥領域研究人員的廣泛關注[9-10]。其中,纖維素納米纖絲(cellulose nanofibril,CNF)表面含有大量羥基,可以與藥物通過物理或化學的方式相結合;而且CNF的尺寸有助于延遲單核吞噬細胞系統的清除[11-14],并且幾乎不存在非特異性細胞攝取[15],是一種非常有應用前景的藥物載體材料。
本研究以CNF和海藻酸鈉(sodiumalginate,SA)為原料,共混后在CaCl2的交聯作用下制備了具有pH響應性的CNF/SA水凝膠。以非甾體抗炎藥阿司匹林(aspirin,ASP)為模型藥物,通過物理混合的方式成功制備出具有pH響應性的ASP/CNF/SA載藥水凝膠,并對其在不同pH值環境中進行了體外藥物釋放行為的研究。
1 實驗
1.1 主要儀器與試劑
熱重分析儀(Q 50,美國);紫外-可見分光光度計(UV-2550,日本);掃描電子顯微鏡(JSMIT300LV,日本);集熱式恒溫加熱磁力攪拌器(DF-101S,中國);超聲儀(SB-5200DTDN,中國)。
CNF,機械法制備,白色粉末狀,羧基含量接近于0,購自于北方世紀(江蘇)纖維素材料有限公司,未經進一步純化直接使用。
SA(相對分子質量7000~10000)和ASP,上海麥克林生化科技有限公司;CaCl2,國藥集團化學試劑有限公司;去離子水,實驗室自制。以上所有試劑均為分析純,未經進一步純化直接使用。
1.2 CNF/SA水凝膠的制備
稱取一定量的SA粉末和CNF粉末并配制成2%的SA和2%的CNF懸浮液。按干燥態質量CNF∶SA=2∶1的比例將上述液體于50℃下攪拌1 h,使其充分混合均勻后倒入模具中,用3.0%(w/V)的CaCl2溶液進行交聯直至全部形成水凝膠。用去離子水對水凝膠進行反復漂洗,以去除水凝膠中殘留的CaCl2。冷凍干燥48 h后,取出樣品,密封干燥。
1.3 CNF/SA水凝膠在不同pH值環境中的潤脹性能
稱量冷凍干燥后的完全干燥狀態下的CNF/SA樣品質量,記為W0;將樣品分別浸入裝有pH值=1.5、7.4和11.0的磷酸鹽緩沖溶液(PBS)的燒杯中,每隔10 min取出樣品,用濾紙迅速吸去樣品表面的水分,稱量,記為W1。此過程于恒溫恒濕箱中進行測定,設置溫度為37℃,濕度為60%。采用式(1)計算得到潤脹率[16]。
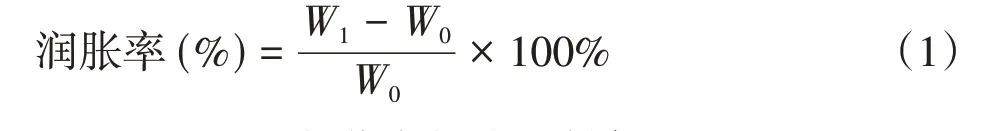
1.4 ASP/CNF/SA載藥水凝膠的制備
按照干燥態質量CNF∶SA=2∶1的比例將2%的SA和2%的CNF懸浮液混合,加熱至50℃后攪拌1 h。停止加熱,加入0.4 g的ASP后繼續攪拌1 h,使其充分混合均勻。用超聲儀超聲處理15 min以去除混合體系內的氣泡后注入模具中,加入3.0%的CaCl2溶液交聯,直至溶膠全部形成水凝膠,用去離子水對載藥水凝膠中殘留的CaCl2溶液進行漂洗,冷凍干燥48 h,取出樣品,干燥密封。
1.5 ASP/CNF/SA載藥水凝膠的熱穩定性測定
采用熱重分析儀對ASP、CNF/SA水凝膠和ASP/CNF/SA載藥水凝膠的熱穩定性進行表征分析。取5~10 mg樣品置于氧化鋁坩堝內,采用高純氮氣作為載氣,調節載氣流速為100 mL/min,設置溫度范圍為40~600℃,升溫速率20℃/min。
1.6 ASP/CNF/SA載藥水凝膠的微觀形貌分析
將ASP/CNF/SA載藥水凝膠樣品進行干燥后,取小塊粘在導電膠上進行噴金處理,利用掃描電子顯微鏡(SEM)觀察ASP/CNF/SA載藥水凝膠的微觀結構,加速電壓設定為12 kV。
1.7 ASP/CNF/SA載藥水凝膠的載藥量及包封率測定
精密稱取10 mg的ASP置于10 mL量瓶中,加入乙醇溶解并稀釋至刻度線,搖勻,作為儲備液。用移液管分別精密量取0.10、0.20、0.30、0.40和0.50 mL儲備液并加入到10 mL量瓶中,加入pH值=7.4的PBS并定容至刻度線,搖勻,在296 nm波長處測定吸光度。以吸光度(A)和質量濃度(c)作線性回歸曲線,得回歸方程A=23.094c+0.0569(R2=0.9998),說明ASP的質量濃度與其吸光度有良好的線性關系。
稱取一定量冷凍干燥后的ASP/CNF/SA樣品,用研缽研碎后,將其置于含有50 mL無水乙醇的燒杯中浸泡48 h,使得載藥凝膠中的藥物完全溶出。離心后取上清液,使用紫外-可見分光光度計測定其吸光度,并根據其回歸方程計算藥物含量后,用式(2)和式(3)計算ASP/CNF/SA載藥水凝膠的載藥量和包封率:

1.8 ASP/CNF/SA載藥水凝膠的藥物體外釋放性能
制備不同pH值(1.5、3.0、5.0、6.6、7.4、8.2、9.0和11.0)的PBS作為藥物的體外緩釋溶液。ASP在緩釋過程中發生水解產生水楊酸。用紫外-可見分光光度計在304 nm波長處測定水楊酸吸光度,并對不同pH值PBS中的水楊酸吸光度(A)和質量濃度(c)作線性回歸方程。
稱取適量ASP/CNF/SA載藥水凝膠放入透析袋中,將其置于盛有不同pH值PBS的錐形瓶中,37℃下恒溫震蕩48 h。每隔2 h使用移液槍取出5 mL混合溶液,同時用等量新的PBS補充至原溶液的量。通過紫外-可見分光光度計于304 nm波長處對緩釋過程中收集的溶液的藥物濃度進行測定,每個樣品的測定結果均由3個平行實驗的結果平均得到。
1.9 ASP/CNF/SA載藥水凝膠的藥物釋放動力學
釋藥過程由藥物分子的自由擴散及基質材料自身的降解溶蝕行為所共同控制。Korsmeyer-Peppas模型是一種用于表征藥物累積釋放速率和釋放時間的經驗模型,可根據其釋放指數確定藥物分子的釋放機制。因此,為了確定ASP/CNF/SA載藥水凝膠藥物釋放過程由哪種行為所主導,實驗選用Korsmeyer-Peppas模型(如式(4)所示)分析藥物的釋放過程。

其中,t為藥物釋放時間;Mt為t時間的累積釋放量,mg;Mn為整個藥物釋放過程中的最大藥物釋放量,mg;k和n為釋放常數和釋放指數。
為了考察該體系的藥物釋放是否符合指數定律,通常將式(4)進行變形以得到式(5)和式(6)。

用Korsmeyer-Peppas模型對不同pH值條件下的前10 h的藥物釋放過程進行分析,并對數據進行線性擬合,以確定合適的藥物釋放機制。若擬合結果為線性,則表明ASP/CNF/SA載藥水凝膠的藥物釋放規律符合指數規律。根據釋放指數n的值確定藥物的釋放機制[17-18]。
2 結果與討論
2.1 CNF/SA水凝膠在不同pH值環境中的潤脹行為
CNF/SA水凝膠在不同pH值PBS中的吸水率如圖1所示。由圖1可知,CNF/SA水凝膠在pH值=1.5的酸性環境下吸水速率最慢,且達到吸水平衡時的最大吸水率僅為其干燥態質量的7倍;隨著環境pH值的升高,CNF/SA水凝膠達到吸水平衡時的最大吸水率明顯提高,在pH值=6.6和8.2中性條件下的最大吸水率分別為其干燥態質量的14倍和15倍;在pH值=11.0堿性條件下的最大吸水率達到最大,為其干燥態質量的19倍。這說明CNF/SA水凝膠的吸水率明顯受到環境酸堿度的影響,這可能是因為在酸性條件下,H+導致CNF/SA水凝膠發生質子化轉變,形成海藻酸鹽難溶物,導致了水凝膠體系的吸水率降低。但隨著pH值不斷升高,去質子化的海藻酸鹽分子鏈中氫鍵減少而發生靜電排斥,從而導致CNF/SA水凝膠的吸水率顯著提高[19]。因此,可認為CNF/SA水凝膠在藥物的釋放行為中具有pH智能響應的潛力。
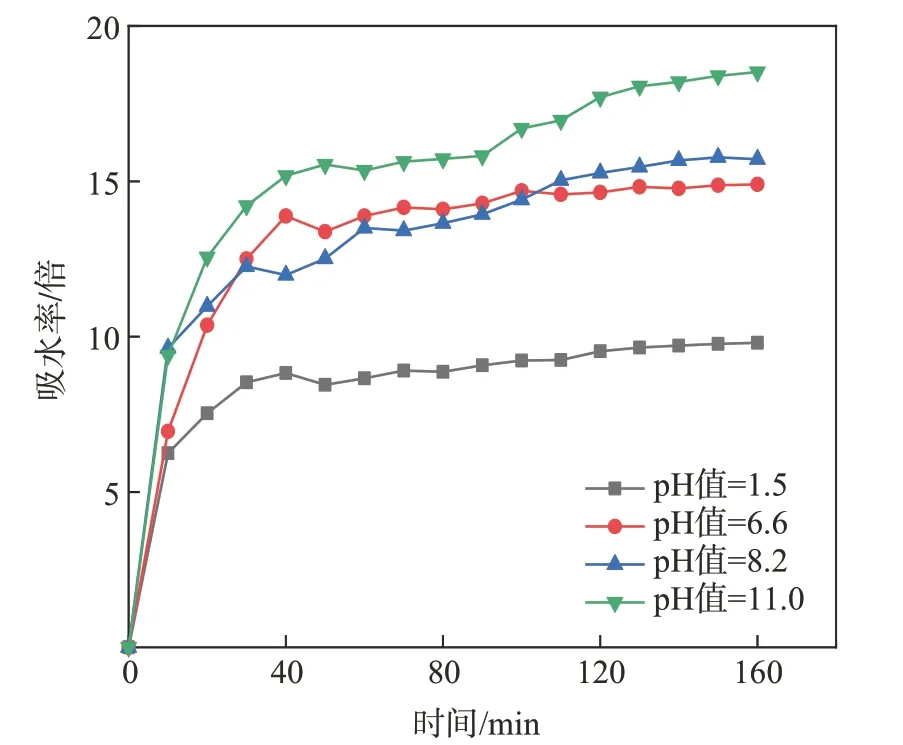
圖1 CNF/SA水凝膠在不同pH值PBS中的吸水率Fig.1 Water absorption ratio of CNF/SA hydrogel in PBS with different pH value
2.2 ASP/CNF/SA載藥水凝膠的熱穩定性分析
ASP、CNF/SA水凝膠和ASP/CNF/SA載藥水凝膠的TG和DTG曲線如圖2所示。從圖2(a)可以看出,ASP有2個快速熱降解階段。在270℃時出現第1次質量損失,質量損失率為35%。ASP熱解時失去CO2和CH2CH2,按此歷程熱解的理論質量損失率為32.9%[20],這基本與TG曲線的第一階段質量損失率35%相對應。第2個快速熱降解出現在270~420℃之間,分解物持續吸熱降解,樣品質量快速損失,最終的質量殘留量接近于0,這表明ASP的主要降解產物為CO2和水。
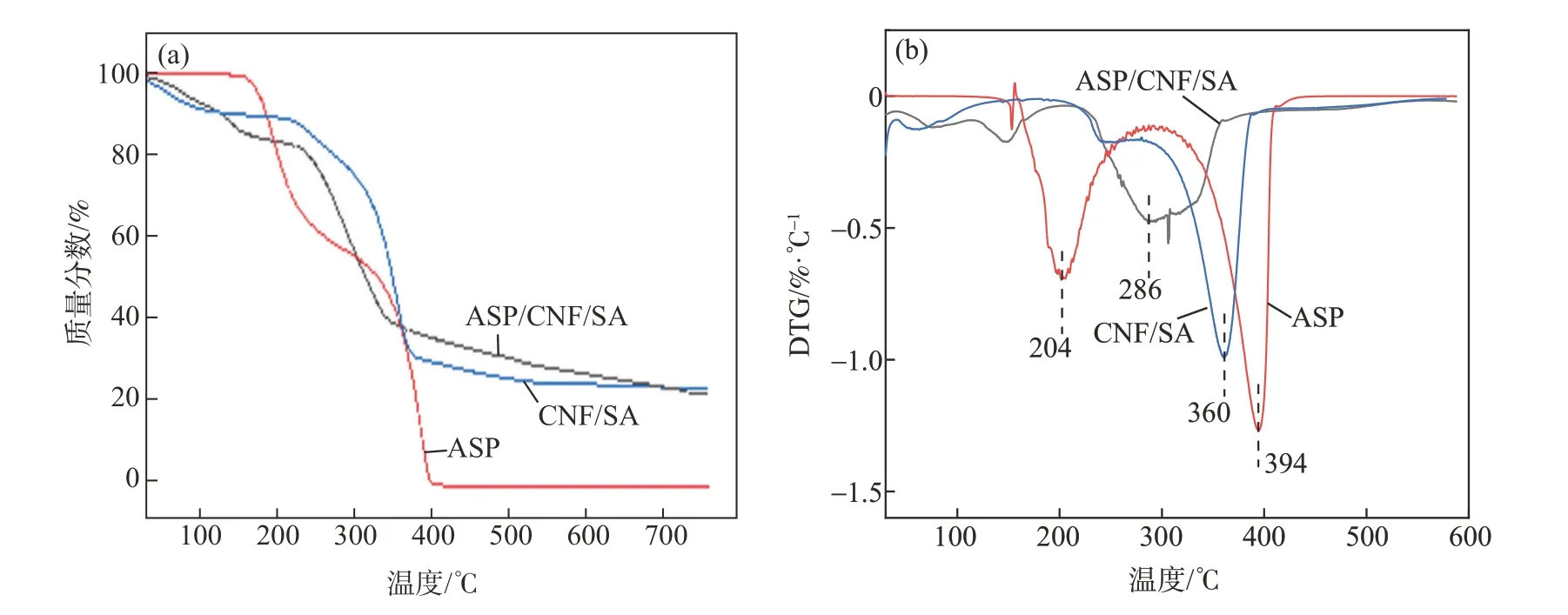
圖2 ASP、CNF/SA水凝膠和ASP/CNF/SA載藥水凝膠的TG和DTG曲線Fig.2 TGand DTGcurvesof ASP,CNF/SA hydrogel,and ASP/CNF/SAdrug-loaded hydrogel
對比CNF/SA水凝膠和ASP/CNF/SA載藥水凝膠的TG和DTG曲線可知,CNF/SA水凝膠在220℃時首次出現降解,之后在360℃時達到最大熱降解速率。ASP/CNF/SA載藥水凝膠在120~160℃之間出現了小幅度的快速熱降解,之后持續升溫吸熱,在220℃時進入第二熱降解階段,該階段主要是CNF和SA的熱解,ASP/CNF/SA載藥水凝膠最終的質量殘留量(22%)低于CNF/SA水凝膠(25%),這是由載藥體系中的ASP受熱分解所導致。
2.3 ASP/CNF/SA載藥水凝膠的形貌結構分析
圖3為ASP/CNF/SA載藥水凝膠的光學照片和SEM圖。從圖3(a)可以看出,樣品表面光滑,是一種白色軟狀凝膠。由圖3(b)可知,CNF在ASP/CNF/SA載藥水凝膠的表面均勻分布,在離子交聯劑的作用和CNF的支撐下,SA在CNF之間形成薄膜狀結構。從圖3(c)可以看出,ASP/CNF/SA載藥水凝膠內部孔隙大小均勻,呈規則的蜂窩狀結構。CNF相互纏繞,對內部的SA起到很好的固定支撐作用,使得ASP/CNF/SA載藥水凝膠截面SEM圖像呈現出一個由SA及CNF互穿交聯的復合交聯結構。這種連續穩定的多孔結構可有效增大水凝膠材料的比表面積,從而增強水凝膠體系與周圍溶液的擴散互動。

圖3 ASP/CNF/SA載藥水凝膠的照片(a)和SEM圖:(b)表面;(c)截面Fig.3 Pictureof ASP/CNF/SA drug-loaded hydrogel(a),and SEMimagesof ASP/CNF/SAdrug-loaded hydrogel:(b)surface,(c)crosssection
2.4 ASP/CNF/SA載藥水凝膠的載藥量及包封率
用紫外-可見分光光度計在296 nm波長處測定ASP的吸光度。用50 mL無水乙醇充分浸泡0.01 g ASP/CNF/SA載藥水凝膠后取其上清液,測定其吸光度為0.952,根據其回歸方程A=23.094c+0.0569(R2=0.9998)和式(2)計算得到其載藥量為194 mg/g。
用電子天平精確稱量0.40 g ASP并與32 g 2%的CNF懸浮液和16 g 2%的SA混合均勻,制得水凝膠后冷凍干燥48 h。精密稱量冷凍干燥后樣品質量為0.9258 g,根據其載藥量可知該載藥體系中含有ASP 179.6 mg,根據式(3)計算得到其包封率為49.9%。
2.5 ASP/CNF/SA載藥水凝膠的體外釋放結果分析
圖4為ASP/CNF/SA載藥水凝膠中的ASP在不同pH值環境中的緩釋結果。其中,圖4(a)為ASP在酸性環境中的累積釋放率曲線。從圖4(a)可以看出,ASP/CNF/SA載藥水凝膠的ASP累積釋放率隨著環境pH值的升高而增加。ASP在0~12 h內迅速釋放,在12~20 h內的釋放速度較緩慢,在20~24 h內基本達到釋藥平衡狀態。ASP在24 h且pH值=1.5、3.0、5.0和6.6條件下的最大累積釋放率分別為59.6%、64.9%、70.3%和76.8%。可見,ASP/CNF/SA載藥水凝膠在中性條件下的ASP釋放速率明顯快于酸性條件下,這可能是由于酸性條件下纖維素分子鏈間的作用力增大而使CNF產生集聚,導致ASP的擴散和溶蝕作用減慢。
圖4(b)所示為ASP/CNF/SA載藥水凝膠在堿性條件下的ASP累積釋放率曲線。從圖4(b)可以看出,ASP/CNF/SA載藥水凝膠在堿性條件下的ASP釋放速率明顯快于中性條件下的;在12 h時,各pH值條件下的ASP累積釋放率均已超過60%;隨著釋放行為的繼續進行,在12~24 h內ASP的釋放速率明顯降低;在24 h達到釋藥平衡時,ASP/CNF/SA載藥水凝膠在pH值=7.4、8.2、9.0和11.0條件下的ASP累積釋放率分別為74.2%、89.8%、91.1%和93.1%,明顯高于酸性條件下的ASP最大累積釋放率。這是因為堿性條件有助于CNF的溶解,加快對ASP/CNF/SA載藥水凝膠的溶蝕作用,加快ASP的釋放。
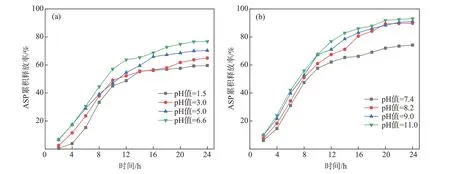
圖4 ASP/CNF/SA載藥水凝膠在不同pH值環境中的ASP緩釋曲線Fig.4 ASPsustained release curves of ASP/CNF/SA drug-loaded hydrogel in different pH value environments
ASP的釋放行為表明ASP/CNF/SA載藥水凝膠具有明顯的pH響應性,能根據釋放環境pH值不同而刺激藥物的釋放,有望被開發成傷口敷料或栓劑。
2.6 ASP/CNF/SA載藥水凝膠的藥物釋放動力學研究
將實驗過程中所測得的ASP累積釋放量與對應時間分別取對數后進行線性擬合,并根據線性擬合數據得到ASP/CNF/SA載藥水凝膠在不同pH值條件下的ASP體外釋放擬合曲線(見圖5)。從圖5可以看出,擬合結果具有良好的線性關系,表1中的擬合方差R2(R2越接近1,表明擬合程度越高)也證實了這一點,表明ASP/CNF/SA載藥水凝膠在不同pH值下的ASP釋放符合Korsmeyer-Peppas模型。n值大小決定藥物的釋放機制:當n<0.45時,藥物的釋放為Fickian擴散;當0.45<n<0.89時,藥物的釋放為Fickian擴散與溶蝕協同作用;當n>0.89時,藥物的釋放為溶蝕作用。根據表1中的數據可以看出,ASP/CNF/SA載藥水凝膠在pH值=1.5、3.0、5.0、6.6、7.4、8.2、9.0和11.0環境中的ASP釋放擬合曲線的n值均大于0.89,說明其ASP的釋放均為溶蝕作用。
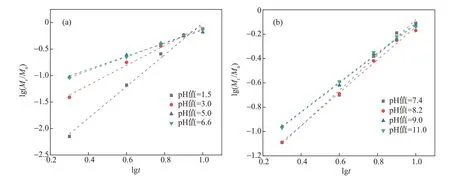
圖5 ASP/CNF/SA載藥水凝膠在不同pH值環境中的ASP釋放擬合曲線Fig.5 Fittingcurvesof ASPreleaseof ASP/CNF/SA drug-loaded hydrogel in different pH valueenvironments
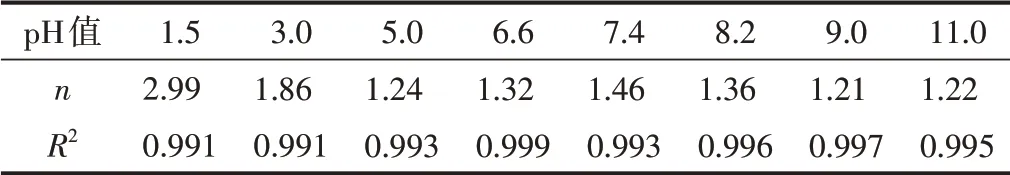
表1 ASP/CNF/SA載藥水凝膠的體外ASP釋放動力學參數Table 1 In vitro ASP release kinetic parameters of ASP/CNF/SA drug-loaded hydrogel
3 結 論
3.1 將纖維素納米纖絲(CNF)和海藻酸鈉(SA)共混,然后在CaCl2的交聯作用下,制得具有pH響應性的CNF/SA水凝膠,通過物理包裹的方式將阿司匹林(ASP)、CNF和SA三者混合均勻后,在CaCl2的交聯作用下制得載藥量為194 mg/g、包封率為49.9%的ASP/CNF/SA載藥水凝膠。
3.2 掃描電子顯微鏡分析結果表明,ASP/CNF/SA載藥水凝膠內部孔隙大小均勻,呈規則的蜂窩狀結構。體外緩釋結果顯示,ASP/CNF/SA載藥水凝膠的藥物釋放具有pH響應性,藥物分子的釋放速率隨著環境pH值的升高而加快。
3.3 動力學研究結果表明,在pH值為1.5~11.0的緩釋條件下,ASP/CNF/SA載藥水凝膠的藥物釋放行為均為溶蝕作用。這種特性使得ASP/CNF/SA載藥水凝膠有望被開發為傷口敷料或栓劑。

