阿司匹林、氯吡格雷抵抗相關基因多態性及其與復發性腦梗死的關系
劉德彬,陳曉璞,陳文杰,黃銀婷,何文貞
(1.汕頭大學醫學院,廣東 汕頭 515041;2.汕頭大學醫學院第一附屬醫院 神經內科二區,廣東 汕頭 515041)
腦卒中的病死率、致殘率較高,腦梗死約占腦卒中的80%,嚴重威脅到患者生命安全。主要采取抗血小板聚集藥物阿司匹林及氯吡格雷對腦梗死進行二級預防。雖然阿司匹林及氯吡格雷對患者的治療有一定幫助,但是上述兩種抗血小板聚集藥物治療不同腦梗死患者的療效差異顯著,不能在所有患者中充分發揮抗血小板聚集的作用,依然存在腦梗死復發風險。這在一定程度上是受抗血小板聚集藥物反應性降低的影響,醫學上將這種對抗血小板聚集藥物呈現低應答或者無應答的現象稱之為“抵抗”[1]。既往研究表明,藥物有效性降低可能與藥物的劑量、個體吸收的差異、患者的依從性、基因多態性、性別等有關[2-5]。本研究通過探討阿司匹林及氯吡格雷抵抗相關基因多態性及其與復發性腦梗死的關系,旨在為腦梗死的治療提供幫助。
1 資料與方法
1.1病例選擇 選取2019年4月至2020年12月我院神經內科收治的腦梗死患者98例,其中男64例,女34例,年齡30~88歲,平均年齡為(49.45±11.12)歲。納入標準:①滿足腦梗死診斷標準(頭顱CT或頭顱MRI有腦梗死病灶,并有相對應的臨床表現,TOAST病因分型為大動脈粥樣硬化型及小動脈閉塞型);②遵醫囑規律服用腦梗死二級預防藥物治療;③血小板計數為100~350×109/L。排除標準:①不明原因型及其他明確病因型的腦梗死;②短暫性腦缺血發作;③血小板異常;④凝血功能異常;⑤心房顫動;⑥器質性心臟病;⑦血液系統疾病或者惡性腫瘤;⑧嚴重心、肝、腎功能不全;⑨氯吡格雷、阿司匹林過敏者。
1.2方法 通過我院信息數據系統,回顧性分析患者臨床資料,包括阿司匹林及氯吡格雷抵抗相關基因檢測結果、性別、是否為復發性腦梗死。阿司匹林藥物相關基因型:①中度抵抗型:血小板膜糖蛋白Ⅲa(glycoprotein Ⅲa,GPⅢa)(PLA1/A1)+ 血小板內皮聚集受體1(platelet endothelial aggregation receptor 1,PEAR1)(GA)+前列腺素內過氧化物合酶1(prostaglandin-endoperoxide synthase1,PTGS1)(AA);②重度抵抗型: GPⅢa(PLA1/A1)+ PEAR1(AA)+PTGS1(AA);③敏感型: GPⅢa(PLA1/A1)+ PEAR1(GG)+PTGS1(AA)。氯吡格雷藥物相關基因型:①中代謝型:CYP2C19*1*2型[GG/GA]及CYP2C19*1/*3型[GA/GG];②慢代謝型:CYP2C19*2/*2型[GG/AA]及CYP2C19*2/*3型[GA/GA];③快代謝型:CYP2C19*1/*1型[GG/GG]。
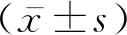
2 結 果
2.1阿司匹林、氯吡格雷基因型分布 氯吡格雷中代謝型合并阿司匹林中度抵抗型、重度抵抗型、敏感型分別為22例、7例、13例。氯吡格雷慢代謝型合并阿司匹林中度抵抗型、重度抵抗型、敏感型分別為12例、7例、11例。氯吡格雷快代謝型合并阿司匹林中度抵抗型、重度抵抗型、敏感型分別為10例、10例、6例。不同氯吡格雷基因型合并不同阿司匹林基因型差異無統計學意義(P>0.05),見表1。

表1 阿司匹林、氯吡格雷基因型分布[例(%)]
2.2阿司匹林抵抗相關基因型與復發性腦梗死關系 與阿司匹林敏感型相比,阿司匹林重度抵抗型腦梗死占比較高,差異有統計學意義(P<0.05);不同性別阿司匹林抵抗相關基因型分布差異無統計學意義(P>0.05),見表2。

表2 阿司匹林抵抗藥物相關基因型與性別、復發性腦梗死關系[例(%)]
2.3氯吡格雷抵抗相關基因型與復發性腦梗死關系 不同氯吡格雷抵抗相關基因型復發性腦梗死占比差異無統計學意義(P>0.05);不同性別氯吡格雷抵抗相關基因型分布差異無統計學意義(P>0.05),見表3。

表3 氯吡格雷抵抗相關基因型與性別、復發性腦梗死關系[例(%)]
2.4阿司匹林基因型聯合氯吡格雷基因型與復發性腦梗死的關系 阿司匹林中/重度抵抗型合并氯吡格雷中/慢代謝型復發性腦梗死占比高于阿司匹林敏感型和(或)氯吡格雷快代謝型,差異有統計學意義(P<0.05),見表4。

表4 阿司匹林基因型聯合氯吡格雷基因型與復發性腦梗死的關系[例(%)]
3 討 論
腦血管疾病、心臟疾病及惡性腫瘤是目前世界上病死率最高的3類疾病,腦梗死具有極高的發病率、致殘率及病死率,嚴重地威脅人們的身體健康。雖然,抗血小板聚集治療可在很大程度上對缺血性腦卒中起到二級預防作用,能夠將腦梗死復發風險與死亡風險控制在一定范圍,從而提升治療效果。但是,一部分患者雖然嚴格按照醫囑規律服用抗血小板聚集藥物,卻依舊存在腦梗死復發的情況,主要原因是患者對抗血小板藥物出現了抵抗現象[6-8]。研究表明,氯吡格雷及阿司匹林抵抗與其基因多態性相關[9-35]。
氯吡格雷作為噻吩吡啶類抗血小板聚集藥物中最重要一員,是一種高選擇性、不可逆的二磷酸腺苷(adenosine diphosphate,ADP)受體拮抗劑,其活性代謝物主要通過與血小板的ADP受體(P2Y1及P2Y12受體)特異性結合,抑制血小板膜ADP受體的表達及結合,從而發揮抑制血小板活性的作用。而氯吡格雷作為一種無活性的前體藥品,經腸道吸收進入人體后,大部分(約85%)經酯酶水解成無活性的羧酸衍生物,剩余約15%在肝臟中通過CYP2C19、CYP1A2、CYP2B6轉化為中間代謝產物2-氧-氯吡格雷,再經CYP2C19等肝酶催化生成活性硫醇代謝物起到抗血小板聚集作用。CYP2C19作為氯吡格雷代謝關鍵酶,對氯吡格雷的活化至關重要,對氯吡格雷的代謝物水平、治療過程中的血小板反應性、心腦血管事件風險等均可產生一定影響,而其活性與自身基因多態性密切相關[10-12]。相關研究證實,與快代謝型(CYP2C19*1/*1)相比,中代謝型(CYP2C19*1/*2、CYP2C19*1/*3)、慢代謝型(CYP2C19*2/*2、CYP2C19*2/*3)CYP2C19活性降低,氯吡格雷的活化代謝產物生成減少,抗血小板聚集作用減弱,復發性腦梗死風險升高;而快代謝型抗血小板效果較好,同時還能在一定程度上降低心腦血管疾病的復發風險,但不良反應發生率增加[13-17]。黃麗云等[18]通過對比口服氯吡格雷7天后患者最大血小板聚集率進行研究發現,氯吡格雷快代謝型組最大血小板聚集率明顯下降(約下降了43.5%),慢代謝型組最大血小板聚集率僅下降了11.7%,差異有統計學意義(P<0.05)。與郁金鳳[19]研究結果類似。而Guirgis等[20]研究證實,氯吡格雷抵抗是預測缺血性事件的重要因素,CYP2C19功能喪失的患者再發缺血性事件的風險增加30%。許宏磊等[21]對226例急性腦梗死患者的前瞻性研究顯示,氯吡格雷快代謝型患者應用氯吡格雷治療后,預后良好的概率約為慢代謝型患者的3.4倍。從以上研究結果可以看出,氯吡格雷抵抗相關基因多態性對抗血小板效果影響顯著,攜帶功能缺失的等位基因,可導致治療后殘余血小板的高反應性,引起復發性腦梗死的概率升高。本研究結果顯示,氯吡格雷抵抗相關基因型對復發性腦梗死無影響(P>0.05),與以上研究結果存在一定差異,可能與研究對象的篩選標準不同或研究樣本量較小有關,后續可進一步細化入選標準、增加樣本量進行深入研究。
而作為血栓素A2抑制劑的阿司匹林,同樣是缺血性腦卒中二級預防中重要的抗血小板聚集藥物,在心腦血管疾病防治中擁有基石地位。阿司匹林可以有效抑制血小板的活化和聚集,預防血栓形成,有效降低缺血性腦卒中患者再發腦梗死的風險。盡管各國指南均對阿司匹林的療效給予了極大肯定,但仍有部分患者在規范接受阿司匹林治療后無法達到預期療效。阿司匹林抵抗受眾多因素影響。研究表明,GPⅢa、PEAR1、PTGS1等基因的基因多態性與阿司匹林抵抗、腦梗死復發風險密切相關[22-25]。①GPⅢa是細胞黏附受體整合素家族成員之一,介導血小板聚集的最后途徑。血小板通過 GPⅢa與纖維蛋白、纖維連接蛋白等黏附蛋白特異性結合,參與血小板的聚集,導致血栓形成。不同GPⅢa基因型(PLA1/PLA1、PLA1/PLA2、PLA2/PLA2)導致血小板功能各異。Papp等[26]研究發現,在阿司匹林抵抗的受試者中,PLA2等位基因出現頻率要顯著高于對阿司匹林敏感的受試者,同時該研究結果顯示,所有基因型為PLA2/PLA2的受試者對阿司匹林的抗血小板效果不佳。Szczeklik等[27]研究發現,與PLA1等位基因比較,PLA2等位基因更容易導致血栓形成,與Papp等研究結果一致。②PEAR1是一種在血小板和內皮細胞中高度表達含有表皮生長因子的重復跨膜受體,通過調控PI3K/PTEN通路,影響血小板的活化、聚集[28]。國內外多項研究證實,PEAR1基因的多態性(野生型:GG,突變型:AG、AA)與阿司匹林抵抗有密切關系。李建設等[29]研究發現,基因純合突變增加標準治療方案患者腦梗死的復發風險。相比于PEAR1的GG基因型,AA和GA基因型血小板聚集率顯著升高,對阿司匹林的敏感性下降,且突變位點越多,血小板聚集率越高,對阿司匹林敏感性越差[30-31]。我國的一項相關研究發現,在PEAR1基因型中攜帶A等位基因的患者在服用相同阿司匹林的情況下更容易發生復發性腦梗死[32]。③PTGS1又稱環氧化酶-1(COX-1),是花生四烯酸轉變為前列腺素過程中的限速酶。阿司匹林通過不可逆地抑制COX-1,阻止花生四烯酸的有效轉化,從而抑制血栓素A2的形成,發揮抗血小板功能。Maree等[33]研究表明,PTGS1基因多態性與阿司匹林抵抗相關,PTGS1基因突變下調了其轉錄水平,導致個體對阿司匹林無應答的風險增高,從而引起心腦血管不良事件的發生風險增高。PTGS1中AA基因型患者的血小板聚集率低于AG及GG基因型患者, 阿司匹林治療有效率高于AG及GG基因型患者[34]。同時,許海寧等[35]發現,PTGS1基因突變是急性腦梗死患者阿司匹林抵抗的危險因素之一。阿司匹林抵抗相關基因多態性與缺血性腦血管事件的復發相關,本研究結果提示,阿司匹林重度抵抗型患者在規律抗血小板治療的情況下仍容易出現復發性腦梗死,與上述研究結果相符。
本研究結果顯示,阿司匹林重度抵抗型患者及阿司匹林為中/重度抵抗型合并氯吡格雷中/慢代謝型患者在規律抗血小板治療情況下仍容易出現復發性腦梗死,而不同性別阿司匹林基因型分布和氯吡格雷基因型分布差異無統計學意義,氯吡格雷抵抗相關基因型分布與阿司匹林抵抗相關基因型分布無明顯聯系。因此,臨床醫師在治療腦梗死時,需要綜合考慮多方面因素,盡可能完善抗血小板藥物相關基因檢測,并根據患者實際情況,制定個體化治療方案,從而更好地預防復發性腦梗死。本研究不足之處:①為回顧性研究,未能進行隨機設計,可能存在選擇偏倚;②樣本量較少,僅在單個醫療中心中篩選樣本,代表性較差。后續可納入多個醫療中心,并通過設計隨機對照研究,進一步深入對比阿司匹林及氯吡格雷抵抗相關基因多態性與復發性腦梗死的關系。

