基于高基元SSR構建黍子DNA分子身份證
丁藝冰,丁雨格,陳 凌,王海崗,陳喜明,王瑞云,,喬治軍
(1.山西農業大學 農學院,山西 太谷 030801;2.山西農業大學 玉米研究所,山西 忻州 034099;3.山西農業大學農業基因資源研究中心/農業農村部黃土高原作物基因資源與種質創制重點實驗室/雜糧種質資源發掘與遺傳改良山西省重點實驗室,山西太原 030031)
在植物學分類中,黍(Panicum miliaceumL.)屬于禾本科黍屬的單子葉植物、1年生草本植物,亦稱糜子,是起源于我國最古老的農作物之一,具有生育期短、耐旱、耐貧瘠等特點,是抗災備荒、復種增收、調節農業種植結構的先鋒作物[1]。黍子抗逆、抗旱,且對環境、耕地要求不高,適應性廣,是旱作地區最主要的糧食生產種類之一[2],比其他作物更容易在高原高海拔或者其他不良環境中生存下來,常常作為比較穩產的糧食作物,在干旱地區種植也常常因其作物特點作為其他作物失敗或者種植延遲時的補救作物,避免造成糧食短缺對其進行深入研究,對于我國干旱地區的農業發展具有重要的價值[3-7]。
黍子脫殼后為黃米,可釀酒、制糕、煮粥,黃米含有豐富的營養成分,富含人體稀缺的維生素B族、銅、鋅、錳等,有調理脾胃、明目安神、益陰利肺、預防糖尿病和心血管病的功效[8]。黍子營養價值和藥用價值均有很高的水平,黍子所含的蛋白質、脂肪、膳食纖維、灰粉等主要營養成分含量比大米高[9],維生素B1、B2以及β-胡蘿卜素略高于大米,富含錳、鎂、鈉、鈣、銅、鐵、鋅等微量元素;蛋白質以清蛋白、谷蛋白、球蛋白為主,氨基酸含量豐富,超出玉米、小麥、水稻的氨基酸含量[10]。黍子粳性品種的各個生長階段的直鏈淀粉積累量均高于糯性品種,對開發黍子食品具有重要意義[11]。從黃土高原的峽谷溝壑到內蒙古高原的丘陵山地,均有黍子種植,其擁有非常發達的根系,能從深層的土壤中吸收水分,莖稈葉片上的絨毛和蠟質層能減少自身水分的蒸發,這樣能充分利用有限的水熱資源,躲過旱季,在很短時間內完成一生并獲得一定的產量[12]。相關研究表明,我國栽培黍的伴生雜草種群會導致馴化黍的種群變異,且佐證了野生以及馴化的黍子種群結構模式存在至少有2個獨立馴化區的假設[13]。關于黍子的起源地,相關研究表明[14],我國的華北夏糜子區、黃土高原春夏糜子區、東北春糜子區的糜子遺傳相關性較大,遺傳關系也較為復雜,這為闡明我國是黍子作物的起源中心提供了有力證據。
隨著各種分子標記技術的發展,育種家加強了對新品種的保護意識,促進了作物DNA指紋圖譜研究的發展,但早期的指紋圖譜大都是基于少數品種和有限標記識別位點,其應用的廣度非常有限,而且指紋圖譜鑒定在于對比圖片中的眾多差異,不易快速區分不同品種。近幾年,分子身份證的概念應運而生,其與指紋圖譜的功能相同,但分子身份證原則上是以廣泛基因組覆蓋度的最少共顯性特異變異位點或標記為基礎,提取每份種質有代表性、穩定和特異的遺傳信息,并通過數字化處理和軟件分析建立分辨不同種質的字符串形式,以達到簡單明了區分品種間差異、在廣度上更直觀地進行品種檢索的目的,并能更有效利用。
簡單序列重復(Simple Sequence Repeat,SSR)分子標記技術,是一種基于DNA長度多態性的分子標記技術,具有豐富的多態性,且重復性優良,被廣泛應用于對群體進行遺傳結構的分析和遺傳圖譜的構建[15]。其在基因定位[16]、檢測種子純度[17]、品種鑒定[18]、研究親緣關系的遠近[19]等方面已有廣泛的應用。
近年來,SSR分子標記技術的快速發展,為我國的現代分子技術作出了巨大貢獻。許多不同品種農作物的真實性和純度也通過SSR分子標記得到 鑒 定,例 如 大 麥(Hordeum vulgareL.)[20]、甘 蔗(Saccharum officinarum)[21]、南美蟛蜞菊(Wedelia trilobata)[22]、芥菜(Brassica juncea)[23]、亞麻(Linum usitatissimumL.)[24]、李 子(Prunus salicina)[25]、棉 花(Gossypium hirsutum)[26]等。何 杰 麗 等[27]用80個SSR評估144份種質,基于聚類分析(UPGMA)將資源劃分為3個。現有的黍子DNA分子水平的研究不夠成熟,且部分研究供試種質材料范圍及數量均較小,該問題更明顯;而對于黍子這樣一個種質數量大、體系繁雜的類群來說,基于黍子SSR構建DNA的分子身份證構建研究尚未見報道[28-29]。
當前,由于世界經濟全球化的發展,人民生活水平不斷提高,國與國之間的交流日漸頻繁,綜合國力的競爭越來越激烈,糧食生產已成為提高一個國家綜合國力的重要環節,提高糧食作物生產產量也是提高國際競爭力的途徑之一。隨著農業產業的迅速發展,農作物新品種也在日益發展,農作物新品種的必備特征是特異性、一致性和穩定性,誕生過程中會出現某些形態特征相似、血緣關系相近、適應環境能力相同的情況,一般的鑒定性狀指標大多是存在連續變異、易受環境影響的數量性狀,很難做出明確描述。
艾呈祥等[30]利用10對SSR引物對38份甜櫻桃種質進行擴增,將分子指紋賦值后構建了其分子身份證。高運來等[31]利用9對SSR引物構建了83份黑龍江部分大豆品種的分子身份證。地方品種、農家種、育成品種和野生資源中異物同名和同物異名現象大量存在,嚴重影響著資源的高效利用。關于作物品種的認定工作既繁瑣而且花費時間較長,市場流通的品種魚龍混雜,農家品種流通不夠或者是無法發揮品種的最大價值,造成種質資源嚴重浪費,創建準確可靠而且操作便捷的資源鑒定系統勢在必行,需為黍子品種制定一份專屬的DNA分子身份證,以便更好地開發和利用黍子種質資源。
本研究選取華北平原、黃土高原、東北平原等不同地理區域的20份黍子材料,利用30對高基元SSR引物構建20份資源的分子身份證,旨在為黍子資源的高效系統管理和合理應用提供理論基礎。
1 材料和方法
1.1 試驗材料
供試材料為來自于華北平原、黃土高原、東北平原等不同地理區域的20份黍子(表1),選取各份材料的適量種子在適宜的人工條件下播種,待各份材料的幼苗長至三葉期時,取葉片約0.3 g,液氮保存至-80℃冰箱備用。
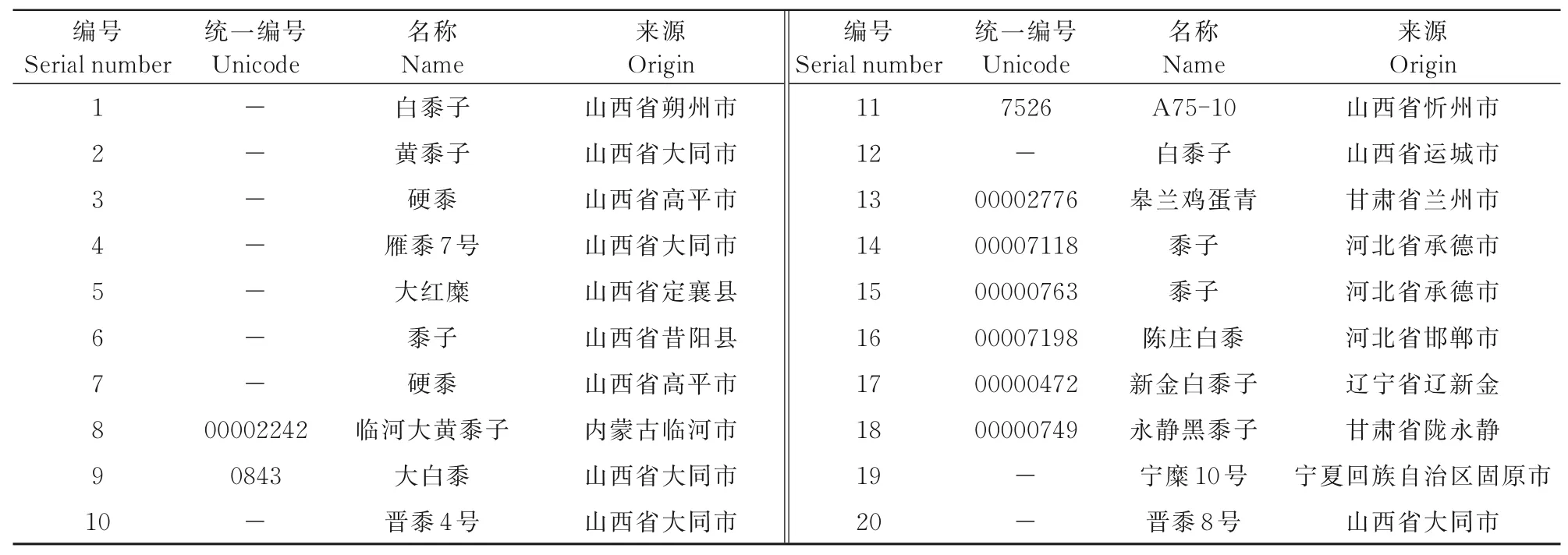
表1 20份黍子試驗材料明細Tab.1 The detail of 20 accessions of Panicum miliaceum in this exper iment
1.2 黍子基因組DNA的提取及PCR擴增
剪取三葉期黍子葉片,采用改良CTAB法[32]提取基因組DNA。DNA的完整性及濃度檢測方法參見文獻[27]進行。利用35對高基元引物[33](表2)對來自我國不同地理區劃的20份黍子材料進行擴增,選取擴增結果穩定、多態性高、條帶完整清晰的引物構建黍子DNA身份證。
PCR擴增反應體系如表3所示。輕彈混勻,瞬時離心收集管壁上的液滴至管底,在PCR擴增儀上進行PCR反應。反應程序為:94℃4 min;94℃40 s,不同Tm(表2)退火40 s,72℃1 min,36個循環;72℃8 min[34]。反應完成后,取3μL產物進行聚丙烯酰胺凝膠電泳。

表2 SSR引物及退火溫度Tab.2 Sequence of SSR primers and annealing temperature
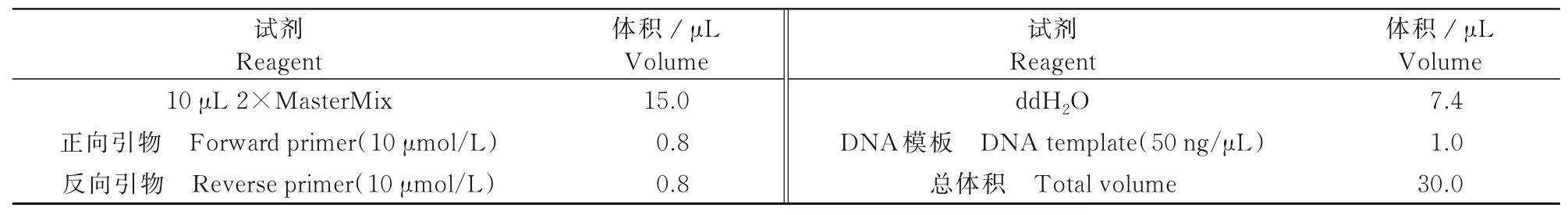
表3 PCR擴增反應體系Tab.3 Reaction system of PCR amplification
1.3 數據統計與分析
取出染色好的凝膠,將其平鋪在LED燈膠片觀片臺上讀取凝膠電泳結果,在凝膠同一位置,有擴增條帶的記為1,無擴增條帶的記為0;而后通過軟件Pop Gen 1.32(Yeh and Boyle,1997)、MEGA 5.0(Tamura et al.,2011)、PowerMarker 3.25(Liu and Muse,2005)計算SSR遺傳多樣性參數。品種分子身份證由東北農業大學研發的資源特征分析軟件ID Analysis 4.0建立。對應字符串通過在線條形碼生成(http://barcode.cnaidc.com/app/html/bcgcode128.php),生成可掃描的條形碼用作DNA分子身份證;黍子材料的基本信息和DNA分子身份證代碼等相關文字信息通過二維碼在線技術(http://cli.im)生成二維碼DNA分子身份證。
2 結果與分析
2.1 引物篩選
選取的材料是來自于華北平原、黃土高原、東北平原等不同地理區域的20份黍子材料,用35對SSR引物進行擴增,結果發現,30對引物(RYW1、RYW2、RYW3、RYW4、RYW5、RYW6、RYW7、RYW8、RYW9、RYW10、RYW11、RYW12、RYW13、RYW14、RYW15、RYW16、RYW17、RYW18、RYW19、RYW20、RYW21、RYW22、RYW23、RYW24、RYW25、RYW27、RYW29、RYW33、RYW34、RYW35)可擴增出條帶清晰、穩定多態性較高的引物,其可作為候選核心引物用于分子身份證的構建。其中,RYW5引物對20份黍子材料的聚丙烯凝膠電泳結果如圖1所示。

2.2 引物多態性及遺傳參數分析
用30對SSR引物對20份黍子資源實行擴增,得到表4中10對引物用于構建分子身份證。
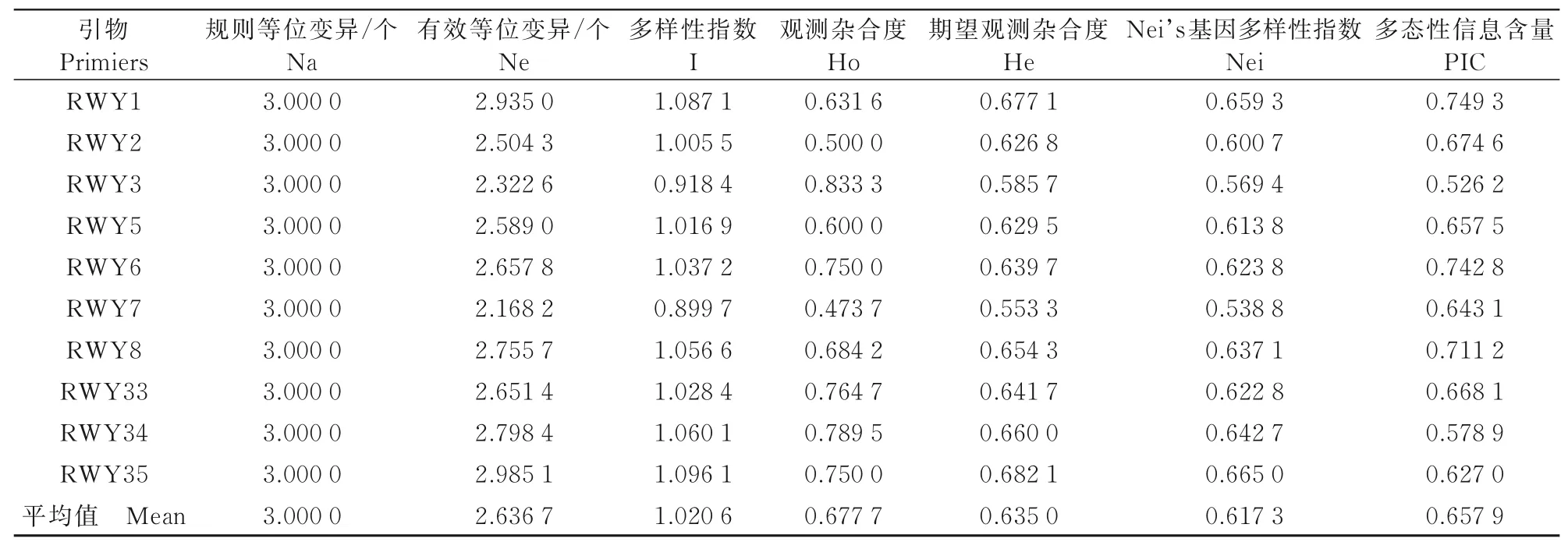
表4 10對SSR引物的遺傳多樣性參數Tab.4 Genetic parameters of 10 pairs of SSR markers
由表4可知,20份材料在30個位點共檢測出30個觀測等位變異,每一個位點都檢測到3個等位基因(平均3個);有效等位變異為2.168 2(RYW7)~2.985 1(RYW35)個,平均為2.636 7個;Shannon多樣性指數為0.899 7(RYW7)~1.096 1(RYW35),平均為1.020 6;觀測雜合度為0.473 7(RYW7)~0.833 3(RYW3),平均為0.677 7;期望觀測雜合度為0.553 3(RYW7)~0.677 1(RYW1),平均為0.635 0;Nei's基因多樣性指數為0.538 8(RYW7)~0.665 0(RYW35),平均為0.617 3;多態性信息含量為0.526 2(RYW3)~0.749 3(RYW1),平均為0.657 9;根據BOTSTEIN[35]提出的理論,10對引物都具備高度多態性(>0.5),可用于分子身份證的構建,其余20對引物多態性較低,不可用于分子身份證的構建。
2.3 黍子種質的分子ID構建
將全部黍子的供試材料利用5對引物(RYW8、RYW12、RYW5、RYW2、RYW1)組合構建字符串DNA分子身份證,結果如表5所示。例如供試材料1的分子身份證為01111,代表該引物次序下的供試材料1在引物RYW8擴增產物電泳后同一凝膠位置中表現為無條帶、而引物RYW12、RYW5、RYW2、RYW1的擴增產物表現為有條帶,即為供試黍子材料1的DNA分子身份證。以此類推,可得到20份供試黍子材料的DNA分子字符串。
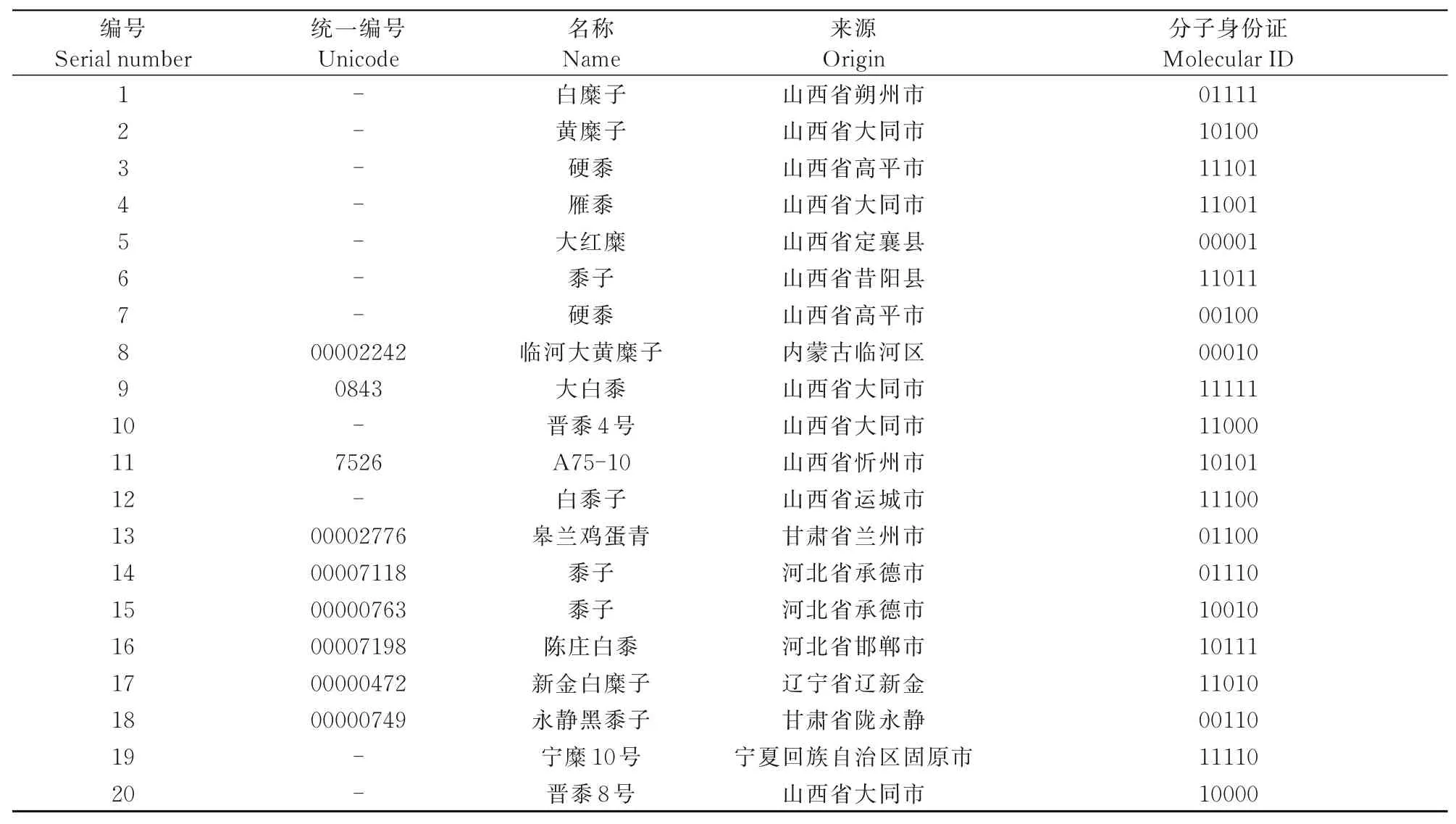
表5 20份黍子資源的分子身份證編碼Tab.5 Code of molecular ID of 20 Panicum miliaceum resources
將試驗獲得的各黍子供試材料字符串DNA分子身份證在在線條形碼生成器中輸入,獲得DNA分子身份證的條形碼(圖2);將各黍子供試材料的基本信息如名稱、統一編號、生態區、來源、字符串DNA身份證號、備注等在在線二維碼生成器中輸入,得到DNA分子身份證二維碼(圖3)。


3 結論與討論
近年來,對黍子的遺傳多樣性分子標記非常有限,尤其是多態性高、檢測能力強的SSR標記更少[36]。利用SSR分子標記,可從分子水平上探究物種遺傳的多樣性,加上群體遺傳特點,可探討品種內及其近緣種屬之間的起源、變異及進化[11]。構建的核心種質資源被要求用最少的數目來最大范圍地包含供試植物資源的遺傳多樣性。查閱已有研究文獻,得到黍子基因多樣性指數分別為0.859 9[27]、0.628 4[27]、0.841 5[37]、0.768 6[38]、0.736 0[39]、0.847 8[40],多態性信息含量分別為0.457 3[27]、0.587 4[41]、0.427 9[37]、0.566 7[38]、0.471 4[39]、0.554 4[40];而本試驗檢測到這2個指標分別為1.020 6和0.657 9,均高于已有研究結果,可能與研究材料及樣本數量差異有關。在2017年,王瑞云等[27]用85個高基元SSR檢測到96份黍子資源的基因多樣性指數和多態性信息含量分別為0.770 8和0.472 3,均低于本研究,這可能與本研究的20份供試材料有關。
目前,SSR標記的檢測方法有聚丙烯酰胺凝膠電泳和熒光毛細管電泳法2種。楊文娟等[42]用這2種方法檢測芝麻應用核心種質發現,對于多態性條帶較少、條帶間分子量差異大和擴增帶型清晰的標記,聚丙烯酰胺凝膠電泳法和熒光毛細管電泳法的電泳結果基本一致。聚丙烯酰胺凝膠電泳法無需昂貴的試驗器材,試劑費用低;而熒光引物僅能保存1~2 a(常規引物則為3~5 a),且熒光毛細管電泳法的合成成本遠高于聚丙烯酰胺凝膠電泳法。限于經濟條件,加之試驗材料數量少,用聚丙烯酰胺凝膠電泳法構建黍子的DNA分子身份證可行。
DNA分子身份證是基于DNA指紋圖譜,運用多種編碼數字化處理電泳圖譜獲得字符串,并輔以條形碼/二維碼等科學表述,在資源鑒定方面應用廣泛[43-44]。用SSR構建資源分子身份證有3種編碼方法:第1種為0/1代碼類型,根據電泳條帶有無賦值1/0形成0/1字符串;第2種為等位基因賦值編碼類型,編碼擴增等位基因;第3種為基因型賦值編碼類型,編碼擴增帶型[45]。本研究采用第1種方法編碼,統計方便、書寫簡潔,字符串長度適中,易于檢索。
以往研究多使用低基元SSR構建作物資源的分子身份證。顏靜宛等[40]利用24對SSR引物對121份水稻常規品種和16個雜交水稻品種進行了多態性信息含量分析,其平均為0.520 0;李紅琴等[46]用212對SSR引物辨別了66份小麥供試材料,多態性信息含量平均為0.510 0。而本試驗對20份來源于華北平原、黃土高原、東北平原的黍子材料用30對高基元SSR引物進行擴增,多態性信息含量為0.657 9,高于已有低基元SSR引物研究結果。隨著新品種研發的不斷深入和新種質資源的認定完成,以往的作物數據庫存在一定的局限性,之后應不斷完善、擴充數據庫的規模及增加核心引物構建的組合數量;同時,分子身份證的構建不僅需要包含其遺傳學信息,還需要包含該作物的社會屬性,只有這樣才能準確描述一個品種,為作物品種的研究與鑒定提供參考依據,實現資源管理的科學化和規范化。

