miR-9-5p對奶牛乳腺上皮細胞乳脂合成的影響
劉青悅,張巖,劉杰,魏祥飛,曲波,姜毓君,王春梅,張莉
(東北農業大學 乳品科學教育部重點實驗室,哈爾濱150030)
0 引言
乳脂肪和乳蛋白是牛奶中重要的營養物質。因此,乳脂肪與乳蛋白的含量與組成是決定牛奶營養品質的重要指標[1]。非編碼RNAs(miRNAs)是基因表達的重要調節因子,參與了各種生物學過程,在動物的生長、發育等方面發揮著重要作用[2-4]。近幾年,miRNAs在奶牛乳腺發育和泌乳方面的研究也有一些進展。越來越多的證據表明,miRNAs通過多種方式調節乳合成相關蛋白基因的表達從而影響乳成分的合成與分泌[5-6]。miR-9-5p在哺乳動物體內普遍存在并參與多種細胞活動和代謝過程,有研究證實miR-9-5p可以抑制骨骼肌衛星細胞和人肥厚瘢痕成纖維細胞的增殖和分化[7-8]。目前關于miR-9-5p的研究主要集中在其在癌癥發生發展中的作用方面,研究發現miR-9-5p可以抑制胰腺癌[9]、乳腺癌[10]、肝癌[11]等癌細胞的增殖和侵襲。本實驗室在前期研究工作中檢測發現miR-9-5p在高乳品質和低乳品質奶牛乳腺組織中的表達存在顯著差異,但是miR-9-5p在奶牛乳腺上皮細胞中的作用及作用機制尚不明確,所以本實驗主要對miR-9-5p對奶牛乳腺上皮細胞乳脂合成的影響進行了研究。
1 材料與方法
1.1 主要試劑
膠原酶IV,sigma;胎牛血清,BI;培養液干粉,胰酶,Giboc;LipofectaminceTM3000轉染實驗,Thermo Fisher;MTT溶液、Formazan,Sdartion。
1.2 奶牛乳腺上皮細胞的獲取與鑒定
使用膠原酶消化組織塊,分離得到奶牛乳腺上皮原代細胞(DCMECs)。將細胞置于含有10%血清、100 U/mL青霉素和100μg/mL鏈霉素的DMEM-F12培養液中,并處于5%CO2、37℃無菌環境中培養。使用0.25%胰酶進行純化去除成纖維細胞后,得到奶牛乳腺上皮細胞。采用免疫熒光染色法對細胞進行角蛋白18染色鑒定[12]。
1.3 奶牛乳腺上皮細胞中miR-9-5p的過表達檢測
將狀態良好的奶牛乳腺上皮細胞均勻接種于6孔板中,并保持生長密度一致。待細胞增長至70%后使用轉染試劑(LipofectamineTM3000)向6孔板中轉染miRNA。miR-9-5p處理組:3μL Lip3000、100 nmol/L miR-9-5p mimics;陰性對照組:3μL Lip3000、100 nmol/L miR-9-5p NC。
1.4 miR-9-5p對奶牛乳腺上皮細胞增殖影響的檢測
將對數生長期細胞接種于96孔板中,計算每孔細胞數為3 000~10 000個細胞。置于37℃、5%CO2無菌環境培養6 h。分別向奶牛乳腺上皮細胞中轉染miRNA和NC(每組處理3個重復),細胞在37℃、5%CO2環境中培養24 h后,加入90μL新鮮培養液,再加入10μL MTT溶液,繼續培養4 h,然后吸棄上清,每孔加入110μL Formazan溶解液。置搖床上低速震蕩10 min,使結晶物充分溶解。在酶聯免疫檢測儀490 nm處測量各孔的吸光度值。
1.5 miR-9-5p對奶牛乳腺上皮細胞乳脂合成的影響
分別用1 00 nmol/L的miR-9-5p mimics和NC處理細胞,48 h后收取細胞蛋白樣品,采用western blotting技術檢測乳脂合成相關信號通路蛋白SREBP1的表達變化。使用SDS-PAGE凝膠快速配制試劑盒配制凝膠,按說明書操作。樣品電泳后進行濕轉,轉膜時間90 min。之后進行抗體孵育,一抗SREBP1(Santa Cruz)在4℃條件下過夜孵育,二抗(HRP-山羊抗兔IgG)在37℃條件下孵育2 h。一抗和二抗孵育完成后進行顯色。蛋白條帶的顯色結果使用Sag Capture獲得,再通過軟件Image J讀取蛋白灰度值。
同樣,向6孔板中轉染mi R-9-5p mimics和NC,培養48 h后去除細胞培養基,用PBS清洗一遍細胞。每孔細胞中加入150μL RIPA裂解液,裂解后的樣品(1000~1500)g離心5 min取上清。使用甘油三酯酶聯測定試劑盒(普利萊)在酶聯免疫檢測儀562 nm處測量各孔的吸光度,并計算甘油三脂的含量。
1.6 數據處理與統計分析
所有數據均采用GraphPad Prim 8.0.2統計軟件進行分析,數據結果用平均數±標準差來表示,組間比較采用單因素方差分析,組內比較采用t檢驗并對多組進行了單因素方差分析。p<0.01表示具有統計學顯著性差異,p<0.01表示具有統計學極顯著性差異。
2 結果
2.1 奶牛乳腺上皮細胞的分離培養與鑒定結果
本實驗使用細胞免疫熒光染色法檢測奶牛乳腺上皮細胞中角蛋白18的表達。如圖1所示,細胞核(藍色熒光)周圍有大量的角蛋白18(綠色熒光)表達。實驗結果表明分離純化后得到的細胞為奶牛乳腺上皮細胞。
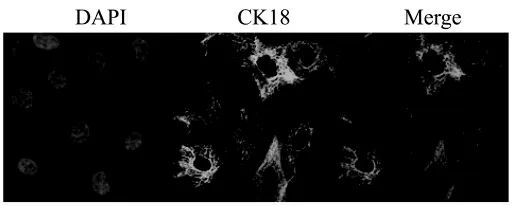
圖1 奶牛乳腺上皮細胞角蛋白18的鑒定(400×)
2.2 miR-9-5p轉染奶牛乳腺上皮細胞
MiRNA處理細胞24 h后,提取各組細胞總RNA進行反轉錄。使用熒光定量PCR技術分別檢測miRNA處理組(mi R-9-5p組)、陰性對照組(NC組)和空白細胞對照組(Control組)的奶牛乳腺上皮細胞中miR-9-5p的表達量變化情況如圖2所示。結果可見miR-9-5p組的奶牛乳腺上皮細胞中miR-9-5p的表達量顯著增高,且差異性極顯著(p<0.01)。

圖2 miR-9-5p過表達后奶牛乳腺上皮細胞中的miR-9-5p的表達水平
2.3 miR-9-5p對奶牛乳腺上皮細胞增殖的影響
為驗證miR-9-5p是否會對奶牛乳腺上皮細胞的正常生長產生影響,本實驗使用MTT細胞增殖檢測試劑盒檢測了miR-9-5p對奶牛乳腺上皮細胞增殖的影響。實驗結果如圖3所示mi R-9-5p顯著抑制了奶牛乳腺上皮細胞的增殖(p<0.01)。
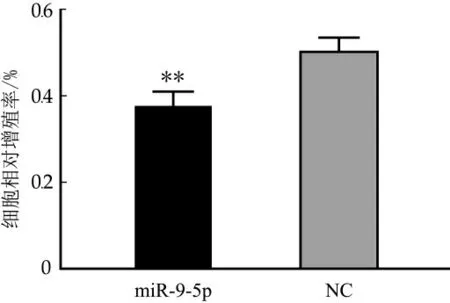
圖3 miR-9-5p對奶牛乳腺上皮細胞增殖的影響
2.4 miR-9-5p對奶牛乳腺上皮細胞乳脂合成的影響
2.4.1 miR-9-5p對乳脂合成信號通路蛋白SREBP1表達的影響
SREBP1是重要的乳脂合成信號通路蛋白,主要通過調控參與乳脂肪合成的多種酶和轉運蛋白的表達影響細胞中甘油三脂的合成和分泌。為確定mi R-9-5p是否會影響奶牛乳腺上皮細胞中SREBP1的表達,本實驗使用western blotting技術分別檢測miRNA處理組和陰性對照組的奶牛乳腺上皮細胞中SREBP1蛋白的表達變化情況。實驗結果如圖4可見,在miR-9-5p作用下,奶牛乳腺上皮細胞中SREBP1蛋白的表達量顯著低于陰性對照組(p<0.01),說明miR-9-5p會抑制奶牛乳腺上皮細胞中SREBP1的表達,并可能因此引起細胞中乳脂合成的下降。
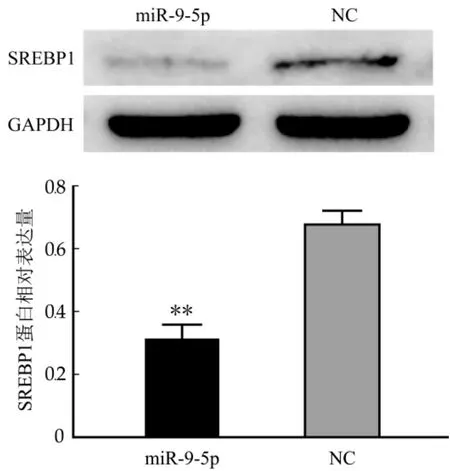
圖4 miR-9-5p處理奶牛乳腺上皮細胞后SREBP1蛋白的表達量檢測
2.4.2 miR-9-5p對甘油三脂合成的影響
為進一步確定miR-9-5p對奶牛乳腺上皮細胞乳脂合成的影響,本實驗使用酶聯免疫檢測儀分別檢測了miRNA處理組和陰性對照組的細胞中甘油三脂的含量(μmol/mL)變化情況。通過繪制標準曲線分別計算兩組細胞中甘油三酯的含量。結果如圖5所示,與NC組相比,miR-9-5p組的奶牛乳腺上皮細胞中甘油三酯的含量明顯降低,且差異性極顯著(p<0.01),表明miR-9-5p能顯著抑制奶牛乳腺上皮細胞中乳脂的合成。
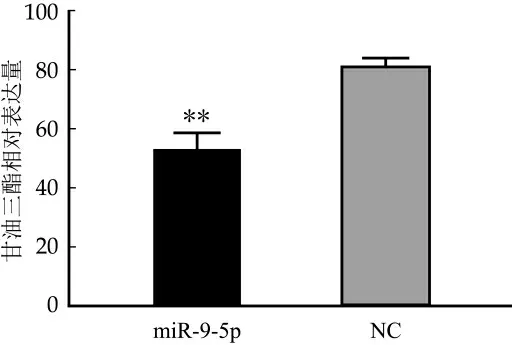
圖5 miR-9-5p處理奶牛乳腺上皮細胞后甘油三脂含量的檢測
3 討論
miRNA是長度大約21~25個核苷酸的一種短的、非編碼的RNA分子,可以在轉錄后水平調節基因的表達[13]。已有研究表明,miRNA參與了調控細胞增殖[7]、分化[14]和凋亡[15]等過程,并同糖代謝[16]、脂代謝[17]、蛋白質代謝[18]及器官發育[19]等多種機體生命活動密切相關。近年來,miRNA在動物乳腺發育和乳成分代謝中的調控作用也不斷地被報道。2017年Lei等[20]報道了Let-7g-5p在小鼠乳腺中抑制β-酪蛋白的表達。張等[4]發現miR-3880過表達具有促進小鼠乳腺細胞甘油三酯合成的作用。在牛乳腺上皮細胞中,研究人員發現miR-497通過調節LATS2的表達抑制甘油三酯和不飽和脂肪酸的產生,以此調控細胞的脂肪代謝[6]。固醇調節元件結合蛋白1(Sterol regulatory element-binding protein 1,SREBP1)是人和動物乳脂肪合成的主要轉錄因子,它主要通過調控參與乳脂肪合成的多種酶和轉運蛋白的表達影響細胞中甘油三脂的合成和分泌[21]。有研究表明,miR-138-5p能抑制SREBP1的表達和穩定性,從而抑制細胞脂質代謝[22]。Lu等[23]研究發現,在奶牛乳腺上皮細胞中miR-212可調節脂肪酸合成酶(FASN)和SREBP1的表達,促進乳腺上皮細胞中脂肪的生成。本實驗的研究結果發現miR-9-5p可以顯著抑制細胞的增殖,降低SREBP1蛋白的表達量,并且顯著降低奶牛乳腺上皮細胞中甘油三酯的表達。近幾年許多研究表明SREBP1的合成與多個信號通路相關[24-26]。因此,miR-9-5p如何通過影響細胞增殖和SREBP1的表達影響奶牛乳腺上皮細胞乳脂合成的具體機制還有待進一步研究。
4 結論
miR-9-5p能夠抑制奶牛乳腺上皮細胞的增殖,降低乳脂合成調控蛋白SREBP1的表達,同時抑制甘油三酯的合成,表明miR-9-5p對奶牛乳腺上皮細胞的乳脂合成具有抑制作用,并且可能通過影響細胞增殖和下調SREBP1的表達發揮作用。

