高考中反應歷程(機理)題初探
云南 趙旭東
一、化繁為簡認識反應歷程(機理)
反應歷程(機理)試題能較好考查考生獲取信息的能力,在近幾年的高考中高頻出現。為方便教學,符合高中學生的認知水平,筆者在這里對“反應歷程(機理)”作化繁為簡處理:基元反應就是一步完成的反應;一個復雜反應可以由若干個基元反應按照一定規律組合起來;反應歷程是化學中用來描述某一化學變化所經由的全部基元反應的學科名詞,所表達的意思就是反應物究竟按什么途徑、經過哪些步驟得到了最終產物;反應歷程又被稱為反應機理。
二、反應歷程(機理)題高頻出現的原因
1.化學的應用價值使然
化學的應用價值決定了化學必須要研究化學反應來應用于實際生產實踐,化學反應要應用于生產實踐主要有兩個方面的問題:一是要了解反應進行的方向和最大限度以及外界條件對反應平衡的影響;二是要知道反應進行的速率和反應的歷程(機理)。
2.《課程標準》的要求
《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課程標準》)在主題2化學反應的方向、限度和速率中提出明確要求“知道化學反應是有歷程的,認識基元反應活化能對化學反應速率的影響”。
3.新教材的要求

4.《中國高考評價體系》的要求
《中國高考評價體系》中對高考中反應歷程(機理)提出了比《課程標準》、教材更高的要求,通過“立德樹人,服務選才,引導教學”的這“一核”將教學、高考、高校人才選拔融合成一個結構嚴謹的整體系統。《中國高考評價體系說明》在闡述創新性時以化學為例——“高考對化學創新思維能力的考查就包括推測反應現象或物質性質、設計物質合成或分離路線、闡釋機理或總結規律等”。足見反應歷程(機理)承載創新性的考查要求有獨到之處。不僅如此,筆者對照《中國高考評價體系》及其說明分析近年高考化學題中的反應歷程(機理)題,發現它還能很好地承載基礎性、應用性、綜合性的考查要求,包括核心價值、學科素養、關鍵能力和必備知識的考查內容。此外,反應歷程(機理)題還能輕松實現解題向解決問題的轉變。
三、反應歷程(機理)題的發展
2013年教育部啟動了普通高中課程修訂工作,2017年《課程標準》頒布,2019年部分地區開始使用新教材,2019年11月《中國高考評價體系》及其說明頒布,2020年落實新高考,這期間高考中的反應歷程(機理)題經歷了出現、完善、基本定型的發展過程。2018年高考全國卷反應歷程(機理)題就閃亮登場,如2018年全國卷Ⅱ第8題,情境是氮氧化物和二氧化硫在形成霧霾時與大氣中的氨的關系示意圖。彼時未將其稱為“反應歷程(機理)”,原因是2007年人版教版教材選修4《化學反應原理》中,有“催化劑能加快反應速率,是因為它能改變反應的路徑,使發生反應所需的活化能降低”的敘述,未出現“反應歷程(機理)”這一名詞。也正是因為舊版教材對于《課程標準》和《中國高考評價體系》的考查要求的滯后,導致“反應歷程(機理)”題在2019年至2021年的高考全國卷中“猶抱琵琶半遮面”地示人。2019年高考全國卷Ⅰ第28題(3)有“反應歷程”的稱謂,第10題同樣屬于反應歷程(機理)題,以“表面吸附和溶解過程”謂之;2020年高考全國卷Ⅱ第11題以“反應機理”謂之;2021年高考全國甲卷28題(1)最后兩空的考查屬于反應歷程(機理),高考命題老師用學生容易接受的敘述替換了陌生名詞“反應歷程(機理)”。這些現象既體現了《中國高考評價體系》以及《課程標準》的要求,又考慮到了2019年版教材尚未全部啟用的實際教學情況,同時清晰地傳達了反應歷程(機理)題將在高考中高頻考查的信息。
四、反應歷程(機理)題的類型
反應歷程(機理)題可以是選擇題、也可以是非選擇題。反應歷程(機理)題多以圖像形式呈現信息,也可以是全文字的題。反應歷程(機理)題的圖像分為能壘圖、循環圖、直線圖。圖中可以用物質名稱、微粒符號或微粒模型(微粒模型圖以下簡稱“模型圖”)來表示所發生的化學反應或變化。2018年至2021年高考全國卷圖像題類型統計情況見表1。

表1 2018年至2021年高考全國卷圖像題類型統計表
2019年全國卷Ⅰ第10題情境是HCl氣體分子在253 K 冰表面吸附和溶解過程的示意圖,從物質變化看是物理過程,因涉及催化領域的研究將其歸為反應歷程(機理)題,從表達微粒的形式看屬于模型圖,從反應過程是否閉合看屬于直線圖。此題與其他年份的反應歷程(機理)題相比,較為獨特。
五、例析反應歷程(機理)題
情境是考查的載體,情境通常分為兩類,一是生活實踐情境,即與日常生活、生產實踐密切相關的試題情境;二是學習探索情境,即源于真實的研究過程或實際的探索過程的試題情境。筆者分析近年反應歷程(機理)題的情境,這兩類情境都有,題目設問圍繞以下考查方向設置:歷程中某一陌生方程式的書寫,找活化能、催化劑、中間體,判斷反應的快慢,判斷反應的決速步驟,判斷焓變的正負或找焓變值。這些反應歷程(機理)題很好地體現了高考評價體系中“四層”“四冀”的要求。下面筆者以2021年全國甲卷第28題(1)為例進行說明。
二氧化碳催化加氫制甲醇,有利于減少溫室氣體二氧化碳.回答下列問題:
(1)二氧化碳加氫制甲醇的總反應可表示為

該反應一般認為通過如下步驟來實現:


總反應的ΔH=________kJ·mol-1;若反應①為慢反應,圖1示意圖中能體現上述反應能量變化的是________(填標號),判斷的理由是。
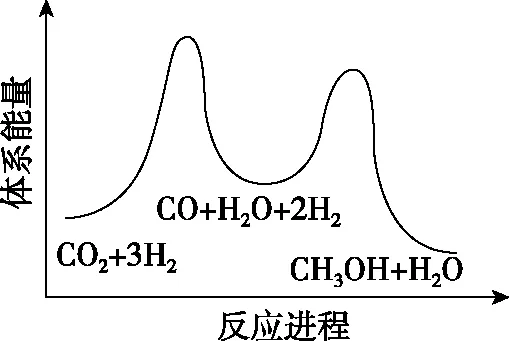
A
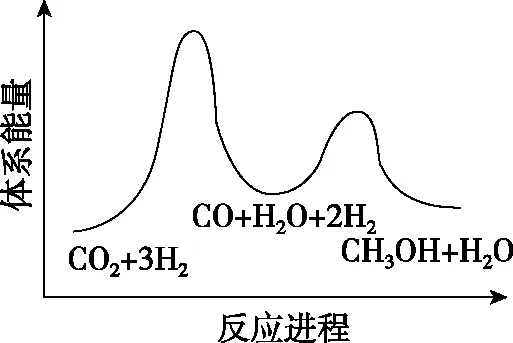
B
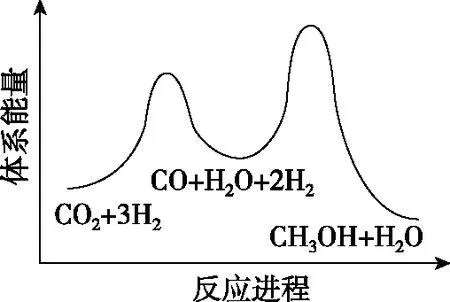
C
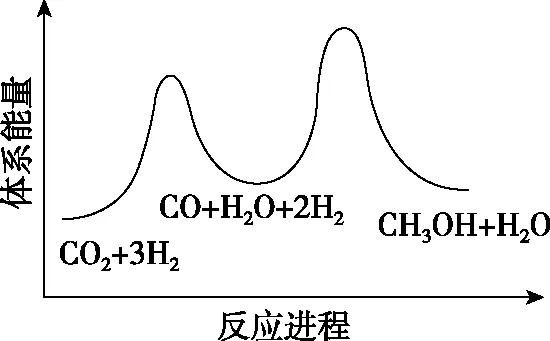
D
【試題情境】屬于“生產新能源+環保”情境,利用二氧化碳加氫制得新能源甲醇,同時減少溫室氣體二氧化碳。
【必備知識】考查了化學用語(熱化學方程式)、概念(能壘、活化能)、運用蓋斯定律計算反應熱、物質轉化及利用。
【關鍵能力】主要考查了學生的理解與辨析能力、分析與推測能力、語言表達能力。第一空利用蓋斯定律計算反應熱可得出,觀察并找到總反應=①+②,計算出反應熱ΔH=41+(-90)=-49 kJ·mol-1。第二空圖形為能壘圖,結合總反應ΔH=-49 kJ·mol-1<0即總反應為放熱反應,故能壘圖中產物能量低,正確選項在A、C中;由已知“反應①為慢反應”,所以反應①的能壘(活化能)比反應②的高,故選A。第三空考查學生第二空是不是真正懂了、化學學科化的語言表達有沒有掌握。
【學科素養】本題考查了證據推理與模型認知化學學科核心素養,側重考查思維方法。學生利用總反應與①②的關系,聯想到用蓋斯定律計算反應熱;把能壘圖和已知信息有機地聯系在一起,用圖解釋已知信息,用已知信息讀懂圖。
本題很有新意,將蓋斯定律求算反應熱的結果與能壘圖巧妙地綜合在一起,層層深入,落實了基礎性、應用性、綜合性和創新性的考查;教材上學生沒有學過的知識高考中也可以考。這對教師的化學新課教學和高考備考提出了新的要求,教材中有關能壘、快(慢)反應、決速步驟等概念、知識雖然未明確表示,但活化能、催化劑、碰撞理論等知識點的考查繞不開這些概念和知識,新課教學時教師應以碰撞理論為突破口,引導、促成學生建構起相關的知識網絡,在備考中做必要的針對性練習。
2018—2020年高考化學試題中的反應歷程(機理)題的分析與本題相似,筆者在這里就不再贅述。
六、反應歷程(機理)題的解題模型
1.切入點:先從設問開始,再回已知和歷程中讀題、審題。
2.重點:物質(微粒)的變化。物質觀、微粒觀、變化觀是串起歷程的主線,抓住這條線,解決問題就會很容易。
3.難點:循環圖。閉合的環讓學生懵“圈”,解決方法是可記住反應物就是起點,最終產物就是終點,失而復得的是催化劑,自生自滅的是中間產物。
4、易失分點:敘述理由。教師可在教學中向學生歸納、總結學科化的表述。
七、反應歷程(機理)題的遷移應用
以2021年高考全國甲卷第13題為例:
乙醛酸是一種重要的化工中間體,可采用如圖2所示的電化學裝置合成。圖中的雙極膜中間層中的H2O解離為H+和OH-,并在直流電場作用下分別向兩極遷移。下列說法正確的是( )
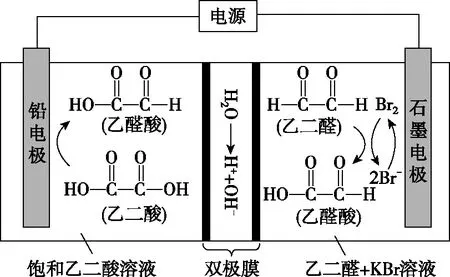
圖2
A.KBr在上述電化學合成過程中只起電解質的作用
C.制得2 mol乙醛酸,理論上外電路中遷移了1 mol電子
D.雙極膜中間層中的H+在外電場作用下向鉛電極方向遷移
高考中這類題很多,如2020年全國卷Ⅱ第9題二氧化碳過量排放可對海洋生物的生存環境造成很大影響……再往前追溯,如2016年全國卷Ⅰ第11題電解池中電解后濃Na2SO4溶液變為稀Na2SO4溶液。這類題學科特點非常明顯,情境都是研究物質組成、結構、變化規律、用途,這類題被統稱為“物質(微粒)變化題”。這類題很像反應歷程(機理)題,反應歷程(機理)題研究基元反應,而物質(微粒)變化題研究的是任意反應。它們有兩個共同點:一是常用圖來表示物質(微粒)的變化;二是串起反應過程的主線是物質觀、微粒觀、變化觀。這兩類題解決問題的思維和方法是相同的,不同的僅僅是必備知識。兩類題型相互借鑒、融會貫通,能大大提高學生解決問題的能力。筆者在這里用反應歷程(機理)題的解題模型驗證一下。
【答案】D

解題模型是一種“套路”,2021年高考后有一種說法是高考題要反“套路”,教師與學生要辯證地看待這種說法。若學生只會生搬硬套,遇到新情境“套路”肯定就毫無用處。若學生在套路的基礎上會舉一反三,遇到新情境時運用“套路”就能快速有效地解題。物質(微粒)變化題出現的時間比反應歷程(機理)題早得多,如果學生建構起物質(微粒)變化題的解題模型,當反應歷程(機理)題出現時就能很容易解決。教師不能把學生教“死板”,不能只是教學生簡單地記憶和套用解題模型,要讓學生去發現、領悟、完善這個解題模型。一個解題模型用于新情境,雖然是“舊瓶裝新酒”,卻能“日久彌香”。

