腹部術后合并膿毒癥患者死亡風險因素聯合預測的價值
何天慧 李書文 沈鋒 王迪芬
貴州醫科大學附屬醫院重癥醫學科(貴陽 550004)
膿毒癥是宿主對感染作出的反應失調并由此引起的危及生命的器官功能障礙[1],是重癥醫學科(intensive care unit,ICU)收治的常見疾病。盡管近些年膿毒癥的診療取得了長足的進展,但由于該病發病機制復雜,疾病進展快,其病死率仍高達28%~50%[2]。
膿毒癥是外科圍手術期危及生命的常見并發癥[3],尤其是腹部手術[4]。因腹腔內臟器結構與功能的復雜性[5],患者存在手術創傷、手術應激以及高感染風險[6],盡管ICU 早期實施多臟器支持等重要治療措施,但此類患者的管理仍是ICU 醫師面臨的棘手問題。目前腹部術后合并膿毒癥患者死亡的風險因素研究報道較少。因此,積極探索該類患者死亡的風險因素,并針對風險因素盡早進行干預,以期降低該類患者病死率。本文通過回顧性病例對照研究的方法,分析腹部術后合并膿毒癥患者臨床資料及相關實驗室指標等,結合單因素和多因素回歸分析,探索引起該類患者死亡的風險因素,同時探討這些影響因素在該類患者預后判斷中的臨床應用價值。
1 對象與方法
1.1 研究對象 回顧性選取2018年1月1日至2020年12月30日期間貴州醫科大學附屬醫院綜合ICU 收治的腹部手術后并發膿毒癥患者納入研究。納入標準:腹部術后轉入ICU的患者,由ICU醫師以Sepsis3.0 膿毒癥診斷標準篩選,且序貫器官衰竭評分(sequential organ failure assessment,SOFA)得分≥2 分者;評估診斷其合并有膿毒癥或膿毒性休克[7-8]。排除標準:(1)年齡<18 周歲;(2)妊娠和哺乳期婦女;(3)合并血液疾病患者;(4)免疫缺陷的患者。根據患者在ICU 內預后分為非存活組和存活組。本研究符合醫學倫理學標準,并經醫院倫理委員會批準(審批號:2021 倫審第653 號),所有治療和檢測均獲得患者或家屬的知情同意。
1.2 處理方法 患者入ICU 后處置:(1)合并膿毒癥休克患者給予抗休克治療;(2)納入患者均為ICU 醫師經驗性抗感染,或根據病原學及患者病情調整抗生素使用。(3)其他:包括機械通氣、內環境穩定及營養支持等。
1.3 觀察指標 記錄患者性別、年齡、體質指數(Body MassI ndex,BMI)、轉入ICU 時的心率、平均動脈壓、入ICU 第一個24 h 的急性生理與慢性健康評分(acute physiology and chronic health evaluation,APACHEⅡ)、SOFA 評分、血常規、生化、血氣分析、降鈣素原(procalcitonin,PCT)、入院至開始手術時間、手術部位、手術時間、術中出血量、術中是否輸血、住ICU 時間、機械通氣時間、總住院時間等資料。
1.4 統計學方法 采用SPSS 23.0 軟件進行統計學分析,計量資料符合正態分布以均數±標準差表示,方差齊性采用t檢驗,方差不齊采用校正t'檢驗;計量資料不符合正態分布以中位數(四分位數)表示,比較采用非參數曼-惠特尼U檢驗;計數資料表示為例(%)。對膿毒癥預后進行單因素分析,采用條件向前法對差異有統計學意義的指標進行多因素logistic 回歸分析,篩選出在預測模型擬合度與自變量個數之間達到最佳平衡時的自變量并建立預測模型,分析各變量與腹部術后膿毒癥短期臨床預后的關系。并繪制工作特征曲線(ROC),計算曲線下面積(AUC)、靈敏度和特異度評估其預測價值。P<0.05 為差異有統計學意義。
2 結果
2.1 病例資料 共256 例患者納入研究,其中男160 例,女96 例。平均年齡為64(19,93)歲;死亡57 例,病死率22.3%。按預后不同分為存活組199 例和非存活組57 例。非存活組患者的心率、乳酸、入ICU 時的APACHEⅡ評分與SOFA 評分均明顯高于存活組,血紅蛋白、碳酸氫根、血小板較存活組低,合并膿毒性休克及合并高血壓的病死率更高(P<0.05);兩組性別、年齡、入ICU 時的白細胞、中性百分比、住ICU 時間以及機械通氣時間入院至手術開始時間、手術時間及術中是否輸血差異無統計學意義(P>0.05)。術中出血量超過1 000 mL 患者27 例,死亡4 例;出血量在600 ~1 000 mL 患者16 例,死亡4 例;出血量<600 mL 有213 例,死亡49 例,兩組出血量差異也無統計學意義(P=0.607)。見表1。
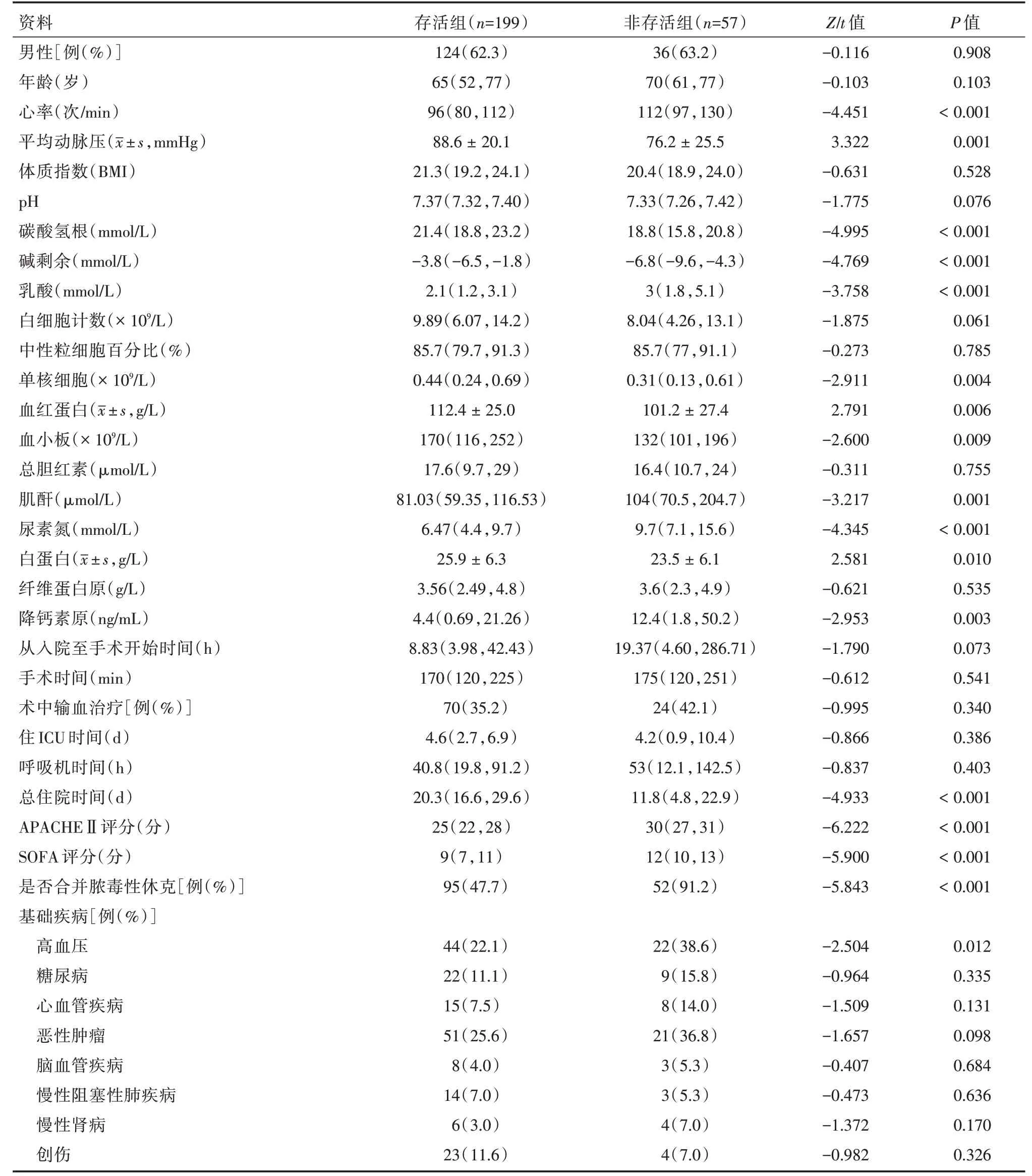
表1 存活組與非存活組患者臨床資料比較Tab.1 Comparison of clinical data between survival group and non-survival group M(P25,P75)
2.2 影響腹部術后并發膿毒癥患者預后的多因素logistic 回歸分析 高APACHEⅡ評分、心率增快及合并休克是患者在ICU 內死亡的危險因素,而高血紅蛋白、高碳酸氫根是其保護因素(P<0.05),見表2。
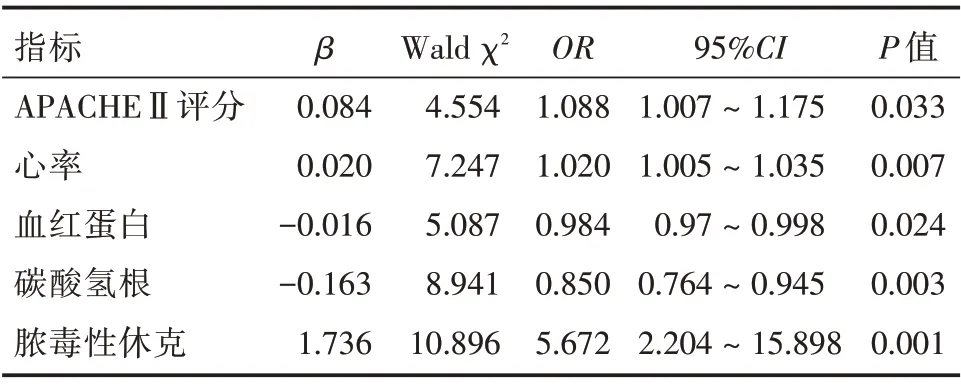
表2 腹部術后并發膿毒癥患者死亡多因素logistic 回歸分析Tab.2 Multivariate logistic regression analysis of risk factors for death in patients with sepsis after abdominal surgery
2.3 ROC曲線分析 采用ROC曲線來分析APACHEⅡ評分、心率、血紅蛋白、碳酸氫根、合并膿毒性休克以及聯合5 個變量對腹部術后并發膿毒癥死亡預測價值,結果顯示APACHEⅡ評分的AUC 為0.77,敏感度73.7%,特異度73.4%;心率的AUC 為0.697,敏感度66.7%,特異度65.3%;血紅蛋白的AUC 為0.623,敏感度36.8%,特異度88.9%;HCO3-的AUC 為0.717,敏感度77.2%,特異度55.8%;休克的AUC 為0.717,敏感度91.2%,特異度52.3%;聯合變量預測的AUC 為0.856,敏感度為82.5%,特異度為72.4%。見圖1、表3。
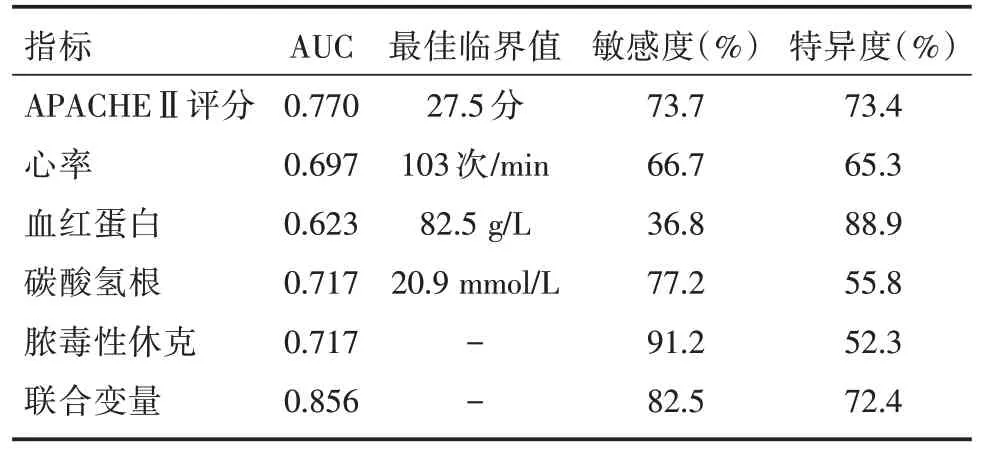
表3 腹部術后膿毒癥患者ICU 死亡危險因素預測預后的ROC 曲線分析Tab.3 ROC curve analysis of risk factors for ICU death in patients with sepsis after abdominal surgery to predict prognosis
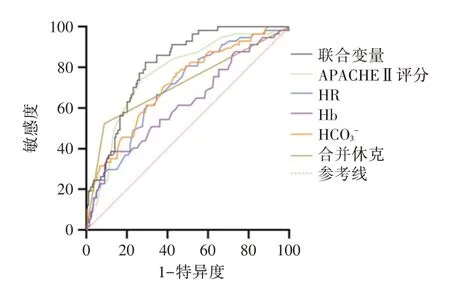
圖1 腹部術后膿毒癥患者ICU 死亡危險因素的ROC 曲線Fig.1 ROC curve of risk factors for ICU mortality in patients with sepsis after abdominal surgery
2.4 腹部手術的部位及病因 256例腹部術后患者中,胃部手術45 例(17.6%),十二指腸手術10 例(3.9%),空、回腸61 例(23.8%),結、直腸及闌尾81 例(31.6%),膽道27 例(10.5%)及其他腹部術后32 例(12.5%),十二指腸術后病死率高于其他部位,高達60%。病因分析發現胃、十二指腸及膽道病變以穿孔為主;空、回腸主要包括小腸扭轉、疝、小腸缺血壞死等;而惡性腫瘤是結、直腸手術的主要病因。
3 討論
發生在外科手術后或術后住院期間的膿毒癥,通常稱為術后或外科膿毒癥。擇期或急診手術后的膿毒癥是一種嚴重且相對常見的并發癥,與術后預后較差、住院時間延長有關,其病死率可高達25 倍[9]。所以及時發現患者危險因素,盡早干預尤為重要。但影響術后膿毒癥患者的因素頗多,從術前患者合并的基礎疾病如慢性心功能衰竭、糖尿病、慢性腎病,到術中患者手術部位、手術方式[10]、腹腔內污染程度,手術時長,術中出血、輸血以及術后患者并發癥的出現,如腸瘺、腸缺血等[11]。抗生素的及時使用[12]、病原菌的監測及抗生素的調整均可能影響膿毒癥的預后。
本研究發現患者合并高血壓病史,術后轉入ICU時心率增快、乳酸和降鈣素原升高、APACHEⅡ評分和SOFA 評分的升高及血紅蛋白、碳酸氫根、血小板、白蛋白等降低以及合并膿毒性休克均是其影響因素。多因素分析得出APACHEⅡ評分、心率、休克是引起腹部術后膿毒癥患者死亡的獨立危險因素,而血紅蛋白及碳酸氫根是預后的保護因素。APACHEⅡ評分包含了危重疾病和膿毒癥的要素,是ICU用作快速判斷患者的病情嚴重程度較為可靠指標[13-14]。本研究結果顯示,腹部術后膿毒癥患者非存活組的APACHⅡ評分顯著高于存活組患者。既往研究認為,APACHEⅡ>27.5分可明顯增加膿毒癥∕膿毒性休克患者的死亡風險[14-15]。轉入ICU的患者及時給予APACHEⅡ評分的評估,可對病情做出初步的判斷。
心臟作為膿毒癥的易損器官,在感染初期,由于全身應激反應,兒茶酚胺分泌增加,使得心率增快,心肌氧耗增多,舒張期時間縮短并進而減少冠狀動脈灌注及心肌氧供的減少[16-17]。心動過速是膿毒癥及多器官功能障礙綜合征患者的重要臨床表現,也是重癥患者院內死亡的獨立危險因素[18-19]。當然,對于心臟功能指標中,心肌酶譜、肌鈣蛋白的變化,心臟超聲、動態心電圖的監測也是進一步對患者心率及心律變化的補充[20],能夠更全面地評估患者心臟情況。
膿毒性休克是膿毒癥最嚴重的并發癥之一,以循環系統衰竭及嚴重代謝紊亂為主要臨床表現[21]。它使膿毒癥的病死率大大增加,從31.8%升高至55.5%[22]。本研究數據也表明,發生膿毒性休克可使腹部術后并膿毒癥患者的死亡風險增加5 倍。因此,對于該類患者早期干預,快速糾正休克,對降低病死率有重要價值。
血紅蛋白降低是ICU 膿毒癥患者的常見臨床現象[23]。既往研究表明,貧血與ICU 重癥患者的不良預后有關[24]。本研究顯示,非存活組患者血紅蛋白水平明顯低于存活組。研究通過ROC 曲線的最佳截斷值發現,當血紅蛋白值≥82.5 g∕L 時,可能是保護此類患者最佳臨界值。引起本組患者貧血的原因可能與術中失血、靜脈補液后稀釋、術后引流以及本身病情嚴重等有關。也有研究提出,膿毒癥可造成血清鐵水平下降、紅細胞生成素減少以及紅細胞壽命縮短等,且炎癥狀態下內皮細胞的激活可能導致血管通透性增加和間質的液體分隔等,從而引起不同程度的貧血[25]。血紅蛋白降低最直接的危害是患者氧輸送能力減弱,引起組織細胞缺氧。因此,腹部術后合并膿毒癥患者維持適當的血紅蛋白水平可能更為重要。
本研究中還發現非存活組的HCO3-較低。HCO3-作為另一個保護因素,當HCO3-≥20.9 mmol∕L時,可能是其最佳臨界值。代謝性酸中毒是膿毒癥最常出現的酸堿代謝紊亂,是機體各個組織器官的缺血、缺氧造成的酸性物質的堆積[26]。酸中毒狀態下,血管壁平滑肌對兒茶酚胺的敏感性下降,使得休克進行性加重且難以糾正。有研究通過建立膿毒癥小鼠模型觀察到死亡組小鼠的HCO3-較存活組低,并認為HCO3-可作為預測膿毒癥早期死亡的標記物[27]。
通過ROC 曲線評價APACHEⅡ評分、心率、血紅蛋白、碳酸氫根、是否合并休克以及聯合評價上述5 個變量對膿毒癥患者在ICU 內結局的預測能力,結果發現合并休克的敏感度最高,但特異度最低;而血紅蛋白的特異度最高,敏感度較低;聯合5 個變量預測的AUC 最大,為0.856,敏感度為82.5%,特異度72.4%,提示多變量聯合預測腹部術后膿毒癥短期結局的準確性更高。在既往研究中也提到與單項指標相比,聯合實驗室指標及APACHEⅡ評分對膿毒癥患者的死亡風險具有更高預測價值[28]。
此外,本組數據顯示,在轉入ICU 的腹部術后膿毒癥患者中,以結、直腸手術居多,然而在不同手術部位引起的病死率中,以十二指腸術后最高,達60%。但既往研究發現,因十二指腸穿孔引起的膿毒癥病死率為38.2%[29],與本研究結果差異較大,分析其原因可能與此類患者轉入ICU 的數量及被納入分析的研究對象不同有關。
綜上所述,APACHEⅡ評分、心率、膿毒性休克是腹部術后并膿毒癥患者死亡的獨立危險因素,血紅蛋白與碳酸氫根是其保護因素。通過上述多因素聯合預測腹部術后膿毒癥短期結局的價值最大。本文存在一些不足:(1)本研究回顧性研究,樣本有限;(2)所有指標都是入ICU 24 h 之內的指標,還應追蹤治療過程中各個指標的動態發展過程以及處理后的影響;(3)手術部位的病例數不均一,對病死率的評估存在影響。需加大樣本量進行觀察研究。

