基于天然植物骨架構建各向異性水凝膠
袁浩田, 金 鑫, 姚 遠, 林紹梁, 朱新遠
(1.上海交通大學化學化工學院, 上海 200240;2.華東理工大學材料科學與工程學院, 上海 200237)
水凝膠是一種高含水量的三維聚合物網絡“軟”材料。各向異性水凝膠具有取向性的微觀或介觀結構,能夠在不同的方向表現出不同的性能,因而在致動器、組織工程、放生肌肉等方面有著廣闊的應用前景[1-4]。目前,賦予水凝膠各向異性的方法有很多,通常是施加強磁場[5]、電場[6]、定向冷凍[7,8]、光誘導[9]、擴散誘導[10]等。近年來出現了以樹木為模板制備各向異性水凝膠的新思路。胡良兵課題組[11]報道了具有規則結構的各種木質水凝膠:首先對木材進行前處理去除木質素,然后用丙烯酰胺(AM)化學水凝膠填充木材通道,從而制得木材水凝膠。基于木材本身的高剛性,木材水凝膠表現出優異的拉伸強度。此后,Sun課題組[12]在此基礎上開發了一種拉伸各向異性的木材水凝膠,將離子導電聚電解質引入木材基質后,將其應用于電容式壓力傳感器(CPS),其切向CPS的感測應力值為0.1~1.3 MPa。
上述工作中,水凝膠的取向結構源自木材的生長取向。其實,常見的植物中存在大量具有生長取向的各向異性結構。我們嘗試從更多的天然植物中獲取各向異性結構,并以此為骨架,通過向其中引入水凝膠構建各向異性水凝膠。我們的研究工作主要包括以下方面:
(1)篩選天然植物的各向異性結構。根、莖、果是植物的三大重要組成器官,分別承擔著營養物質的吸收、運輸和儲存三大功能。首先,根據其功能推測其是否具備有序結構,我們選取了胡蘿卜(根類植物)、茄子(果實類植物)、萵筍(莖類植物)、芹菜(莖類植物)、杏鮑菇(菌類)5種代表性蔬菜。接著,運用光學顯微鏡、掃描電鏡和低場核磁等手段,分析并研究了上述植物的微觀和介觀結構的取向性、組織含水率等。最后,綜合考慮結構的各向異性和組織含水率,篩選胡蘿卜和芹菜進行后續研究。
(2)探索出普適性的預處理方法,得到植物基各向異性骨架結構。分別運用超聲、酸處理和脫木質素的方法對胡蘿卜和芹菜進行處理,得到植物骨架。預處理的目的是在不破壞植物各向異性組織結構的基礎上,除去細胞質、色素、木質素等,增加纖維素鏈和半纖維素鏈之間的距離。比較了處理后的胡蘿卜骨架和芹菜骨架,發現芹菜骨架強度極弱,不適合繼續加工,故選擇胡蘿卜骨架進行后續研究。
(3)以各向異性骨架為模板復合水凝膠,制備各向異性水凝膠。以胡蘿卜骨架為基礎,探索單體灌注、單體比例和成膠條件的影響,最終制備了具有胡蘿卜骨架的各向異性水凝膠,并運用掃描電鏡、萬能拉力機、傅里葉變換紅外光譜分析等一系列手段對其性能和結構進行表征。
1 實驗部分
1.1 原料和試劑
丙烯酰胺(AM)、N,N’-亞甲基雙丙烯酰胺(MBA)、過硫酸銨(APS)、N,N,N',N'-四甲基乙二胺(TMEDA):Sigma-Aldrich公司;亞氯酸鈉、醋酸、無水乙醇和氯化鉀(KCl):國藥集團化學試劑有限公司。以上藥品均為分析純,使用前未經處理。實驗全程使用去離子水。天然植物(胡蘿卜、茄子、萵筍、芹菜、杏鮑菇)購自農貿市場,天然植物使用時進行簡單加工,取出需要的組織:胡蘿卜芯、茄子肉、萵筍莖、芹菜莖、杏鮑菇柄。
1.2 篩選植物骨架
取胡蘿卜芯、茄子肉、萵筍莖、芹菜莖、杏鮑菇柄分別作切片處理,切片厚度為0.1~0.2 mm,用光學顯微鏡進行觀察,確定細胞結構以及是否存在纖維組織取向。然后,從這5種蔬菜組織中分別取1 cm×1 cm×0.5 cm的長方塊,并做好標記,平行于生長方向標記為L,垂直于生長方向標記為R。用液氮進行淬冷,冷凍干燥48 h,待水分完全除去后,將其固定在樣品臺上,噴金處理后用掃描電鏡進行觀察。
1.3 植物預處理
1.3.1 物理方法 利用超聲方法對植物組織進行物理破壁處理。將植物組織在25 °C 、100 Hz條件下分別超聲30、60、90 min,取出后用蒸餾水沖洗干凈,用光學顯微鏡觀察細胞組織。
1.3.2 酸處理法 將植物組織置于冰醋酸溶液中,25 °C環境下分別放置30、60、90 min;然后,取出植物組織并用蒸餾水反復沖洗,做成植物切片,用光學顯微鏡觀察。
1.3.3 去木質素法 制備胡蘿卜骨架的具體操作過程如下:先將胡蘿卜洗干凈去皮,去除胡蘿卜木質部外皮,留下胡蘿卜芯,將胡蘿卜芯加工成0.6~0.8 mm厚的片狀;然后用NaClO2溶液(該溶液用醋酸調節pH至4.8)對胡蘿卜進行脫木質素處理,加熱至45 °C浸泡24 h;用體積分數為75%的乙醇反復洗滌浸泡,直至除去胡蘿卜芯中所有的化學物質,再將胡蘿卜芯放入蒸餾水中浸泡直至形貌復原。最后,將胡蘿卜芯放置在?20 °C冰箱中冷凍12 h,待其完全凍住后,用冷凍干燥機冷凍干燥72 h,得到胡蘿卜骨架。
1.4 植物水凝膠的制備
水凝膠預制液的制備:配制質量分數為25%的AM單體溶液,取30 mL單體溶液并向其中通入氮氣排出空氣,隨后加入引發劑APS(質量為單體質量的1%),待攪拌均勻后再加入交聯劑MBA(質量為單體質量的1.5%),繼續攪拌,得到混合均勻的預制液。
胡蘿卜復合聚丙烯酰胺(PAM)水凝膠的制備:將制備好的胡蘿卜骨架在水凝膠預制液中浸泡30 min后,于400 Pa下進行脫氣,每隔20 min釋放真空讓預制液充分地進入骨架中,隨后脫氣,整個過程重復5次。然后將胡蘿卜骨架和預制液同時放置于模具中,并放入45 °C的烘箱中交聯反應4 h,待完全交聯后,得到胡蘿卜復合PAM水凝膠(carrot gel)。隨后將復合水凝膠從模具中剝離出來,冷卻到室溫后用去離子水將未反應的AM單體等洗去。利用胡蘿卜、芹莖構筑各向異性水凝膠的示意圖如圖1所示。
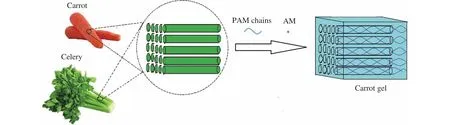
圖1 利用胡蘿卜、芹菜構筑各向異性水凝膠的示意圖Fig.1 Schematic diagram of the construction of anisotropic hydrogels using carrots and celeries
1.5 測試與表征
用日本Nikon公司 Eclipse LV100N Ci-POL型偏光顯微鏡和Nikon DS-Fi3型攝像機以及Matrox Intellicam軟件觀察胡蘿卜芯、茄子肉、芹菜莖、萵筍莖、杏鮑菇柄切片;用浙江寧波新芝冷凍設備有限公司SCIENTZ-12N型冷凍干燥機對胡蘿卜芯、茄子肉、芹菜莖、萵筍莖、杏鮑菇柄、PAM凝膠、植物復合凝膠進行冷凍干燥;用德國 Brucker 公司 Vertex70 型紅外光譜儀測定植物復合凝膠的紅外光譜;用美國FEI公司& 英國Oxford公司 Sirion 200 高分辨場發射掃描電子顯微鏡觀察植物及植物復合凝膠的形貌。
2 結果與討論
2.1 天然植物骨架篩選
圖2(a)是胡蘿卜樣品在垂直于生長方向的光學顯微鏡成像,顯示胡蘿卜細胞直徑為50~100 μm,細胞之間呈蜂窩狀緊密排列。圖2(b)是胡蘿卜樣品在平行于生長方向的光學顯微鏡成像,細胞直徑為80~100 μm,細胞大小較為規整,直徑相差較小,同時可以看出細胞在平行于生長方向有著明顯的取向排列。這樣的取向結構在掃描電鏡圖片(圖2(c,d))中能夠得到更清晰的呈現。如圖2(c)所示,在垂直于生長方向,胡蘿卜樣品存在通道結構,直徑為50~100 μm,且呈現蜂窩狀緊密排列,通道具備貫通取向結構。如圖2(d)所示,胡蘿卜組織在平行于生長方向具有明顯的取向結構,且通道在取向方向呈現貫通狀態。

圖2 胡蘿卜樣品的(a,b)光學顯微鏡細胞形態和(c,d)掃描電鏡下的結構形貌Fig.2 (a,b) Cell observation images under optical microscopes and (c,d) scanning electron micrographs of carrot samples
圖3(a)是芹菜樣品在垂直于生長方向的光學顯微鏡成像,細胞直徑在100 μm左右,細胞之間排列緊密但欠缺規律性。芹菜樣品在平行于生長方向的光學成像(圖3(b))顯示細胞呈長條狀有序排列,且排列緊密,相鄰列細胞之間間隙較小。圖3(c)是芹菜樣品垂直于生長方向的掃描電鏡圖,芹菜骨架存在大量介孔結構,介孔的截面端口朝向整齊,呈圓形,直徑為60~100 μm,但介孔之間難以觀察到貫通結構。在平行于生長方向,芹菜骨架通道較少且難以觀察到貫通結構(圖3(d))。綜上,芹菜組織細胞緊密排列,且細胞壁之間有縫隙結構,沿著生長方向呈現有規律的排列,但芹菜骨架的各向異性不明顯,可能適合作為構建各向異性水凝膠的骨架。

圖3 芹菜樣品的(a,b)光學顯微鏡細胞形態和(c,d)掃描電鏡下的結構形貌Fig.3 (a,b) Cell observation images under optical microscopes and (c,d) scanning electron micrographs of celery samples
圖4(a,d)分別是茄子樣品在光學顯微鏡和掃描電鏡下的細胞狀態與結構形貌。茄子的果肉由海綿組織膨大形成,果肉細胞呈管狀松散排列,細胞間隙大,質地細膩,其中管狀細胞的直徑大約為10~15 μm,沒有觀察到取向結構。管束細胞具有類似端口的形貌,直徑為10~15 μm,管束細胞相互交錯排列,分布散亂不均,無明顯取向性。圖4(b,e)分別是杏鮑菇樣品在光學顯微鏡和掃描電鏡下的細胞形態與結構形貌。杏鮑菇組織的纖維排列非常緊密,菌絲質地柔軟,韌性強。無論是沿著菌柄生長方向還是垂直于菌柄生長方向,杏鮑菇菌絲組織生長均勻且致密。可以觀察到杏鮑菇中不規則的空洞結構,空洞大小不一,分布散亂無規律,同時觀察到菌絲附著于其表面,組織不存在取向性結構。圖4(c,f)分別是萵筍樣品在光學顯微鏡和掃描電鏡下的細胞形態與結構形貌。與芹菜的組織結構明顯不同的是,萵筍細胞排列雜亂無序,細胞之間緊密排列,無明顯規律與取向,細胞壁之間無貫通,但萵筍的細胞體積相較于芹菜更小。綜上所述,茄子、杏鮑菇、萵筍的管束細胞分布雜亂,取向混亂,組織結構排列緊密,不存在各向異性結構,不適宜作為構建各向異性水凝膠的植物骨架。

圖4 茄子、杏鮑菇和萵筍樣品(a,b,c)在光學顯微鏡下的細胞形態和(d,e,f)掃描電鏡下的結構形貌Fig.4 (a,b,c) Cell observation images under optical microscopes and (d,e,f) scanning electron micrographs of eggplant, pleurotus eryngii and lettuce samples
對植物組織中的水分分布情況進行可視化處理,由于成像的信號強度取決于樣品中的質子數,而水分子又是蔬菜組織中質子數的主要來源,因此樣品中含水量高的地方,其質子圖像信號越強,核磁圖像的亮度也越高。由圖5可以看出胡蘿卜、芹菜和萵筍的圖像信號清晰明亮,含水量較高;杏鮑菇圖像亮度最低,含水量最低。
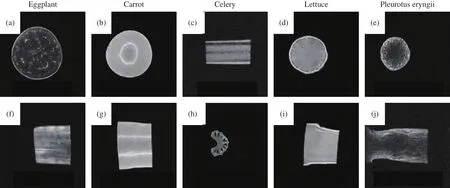
圖5 茄子、胡蘿卜、芹菜、萵筍、杏鮑菇樣品的低場核磁成像Fig.5 Low-field NMR imaging of eggplant, carrot, celery, lettuce, and pleurotus eryngii samples
通過以上對比實驗,從結構角度分析,胡蘿卜芯和芹菜莖的植物組織具備明顯的各向異性結構,茄子肉、杏鮑菇柄、萵筍莖的植物組織不具備各向異性結構;從含水量角度分析,胡蘿卜、萵筍和芹菜的含水量較高。綜合以上分析,作為植物根部的胡蘿卜芯以及芹菜莖具有明顯的各向異性組織結構,并具備較高的含水量。因此,我們選取胡蘿卜芯和芹菜莖作為獲取植物骨架的材料。
2.2 天然植物骨架預處理方法的探索
以胡蘿卜和芹菜為各向異性結構來源,探索從天然植物中獲取各項異性植物骨架的方法。預處理的思路是將植物中的細胞破碎,除去細胞質、色素等,并適當擴大植物組織纖維素鏈之間的空隙。物理處理方法是用超聲震蕩方式破壞細胞壁以及纖維素鏈之間的連接,超聲雖然可以增加細胞間距離,但對細胞壁基本沒有破壞,無法提供貫穿通道;酸處理方法使細胞壁明顯變薄,細胞間隙增大,但仍不能破壞細胞壁,不能提供貫穿的取向通道;脫木質素法可去除植物組織中細胞質、色素,細胞壁間隔明顯變寬,能夠提供更多的空隙和取向通道。因此,我們確定用脫木質素法作為植物的預處理方法,并對處理后的結構進行凍干處理,以此法制備一系列天然植物骨架。在處理過程中,我們發現由于芹菜莖本身呈弧形結構,在凍干過程中結構容易破裂,造成取向結構的不完整,因此后續實驗選定胡蘿卜骨架為植物骨架。
2.3 天然植物水凝膠成膠方法篩選
為了在植物骨架中引入水凝膠,構建各向異性植物水凝膠,我們分別選取了單體質量分數分別為20%、25%、30%、40%的4組溶液,交聯劑MBA的質量為單體質量的0.5%,成膠溫度分別設置為25、45、60 °C,結果如表1所示。在低單體質量分數(20%和25% )下,在25、45°C下均能成膠,繼續升高溫度至60 °C,雖然同樣能夠成膠,但由于溫度過高導致植物骨架坍塌,失去植物骨架的剛性。當單體質量分數達到30% 時,在25、45、60 °C下均能成膠;加熱到45 °C會發生爆聚現象,導致凝膠中存在大量氣泡,無法使用。當單體質量分數達到40%后,溶液系統不穩定,在常溫下也會發生爆聚現象,聚合過程劇烈放熱,膠體充滿大量氣泡,導致膠體無法使用。因此,我們選擇單體質量分數25%、成膠溫度45 °C為最佳的成膠條件。
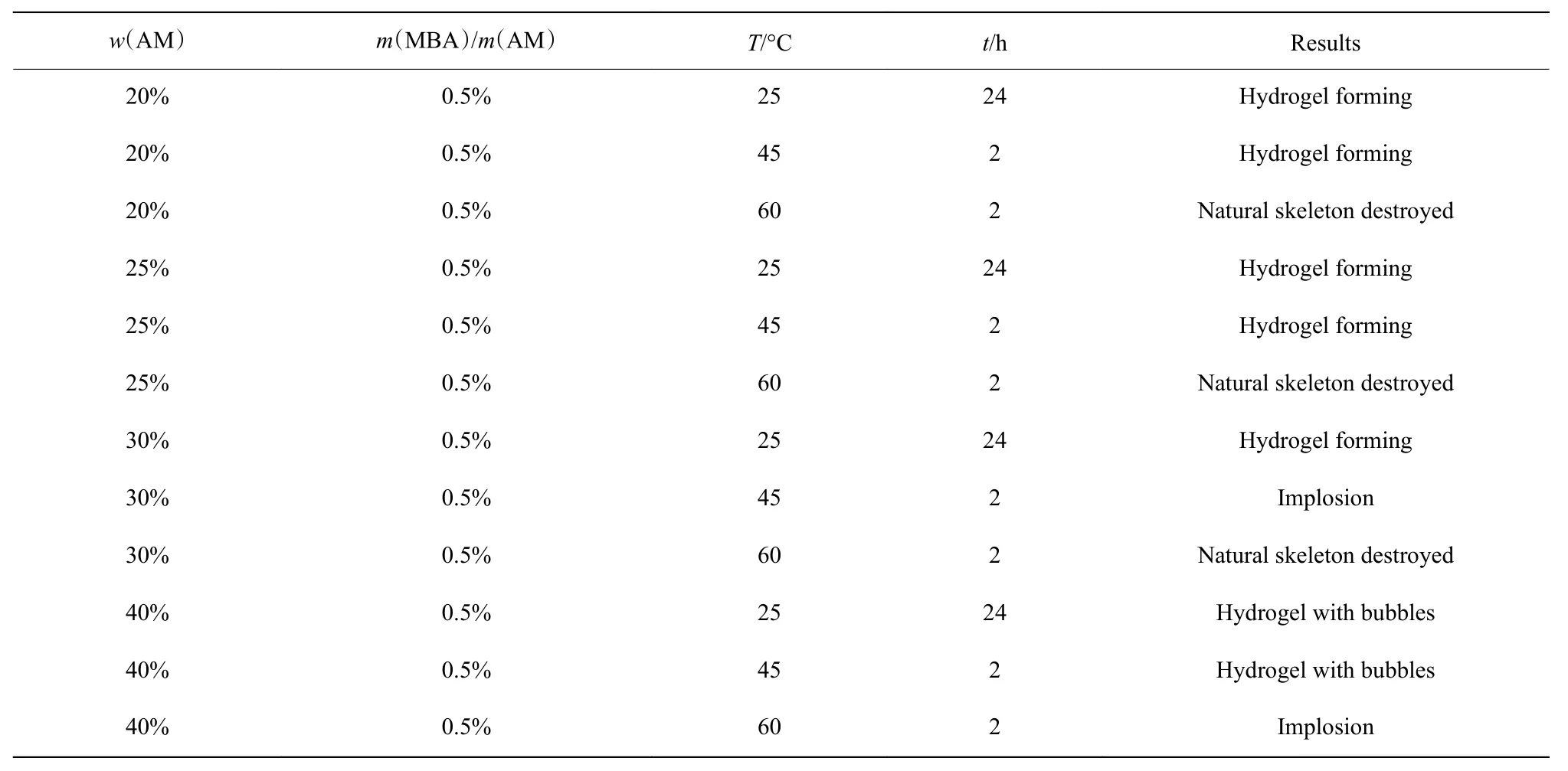
表1 各向異性植物水凝膠的構建條件對比Table 1 Comparison of construction conditions for obtaining the anisotropic hydrogels
2.4 紅外分析
圖6為胡蘿卜、PAM水凝膠和胡蘿卜復合PAM水凝膠的紅外光譜。在胡蘿卜的紅外光譜中,3 422、1 168、1 083 cm?1處的吸收峰分別對應-OH伸縮振動,C-O伸縮振動和C-O-C的不對稱伸縮振動;在PAM水凝膠的紅外光譜中,在3 420 cm?1和3 192 cm?1處是N-H的伸縮振動特征峰;1 666 cm?1處對應C-O的特征吸收峰;1 394 cm?1和1 112 cm?1處的吸收峰分別對應于C-N的伸縮振動和-NH2的平面振動[13]。胡蘿卜復合PAM水凝膠的紅外光譜中既能觀察到胡蘿卜的特征吸收峰,又有PAM的特征吸收峰,證明胡蘿卜植物骨架與PAM水凝膠的成功復合。同時,進一步觀察發現屬于胡蘿卜的-OH伸縮振動吸收峰由3 422 cm?1轉移到了3 197 cm?1,并且峰變得更寬,表明了胡蘿卜復合PAM水凝膠中的纖維素鏈與PAM鏈之間形成了強氫鍵作用[14]。在PAM水凝膠紅外光譜中,C-O、N-H 和-NH2吸附峰分別從1 666,1 625,1 112 cm?1轉移到 1 690, 1615, 1 196 cm?1, 表明 PAM分子鏈與纖維素支架之間形成了分子間氫鍵。
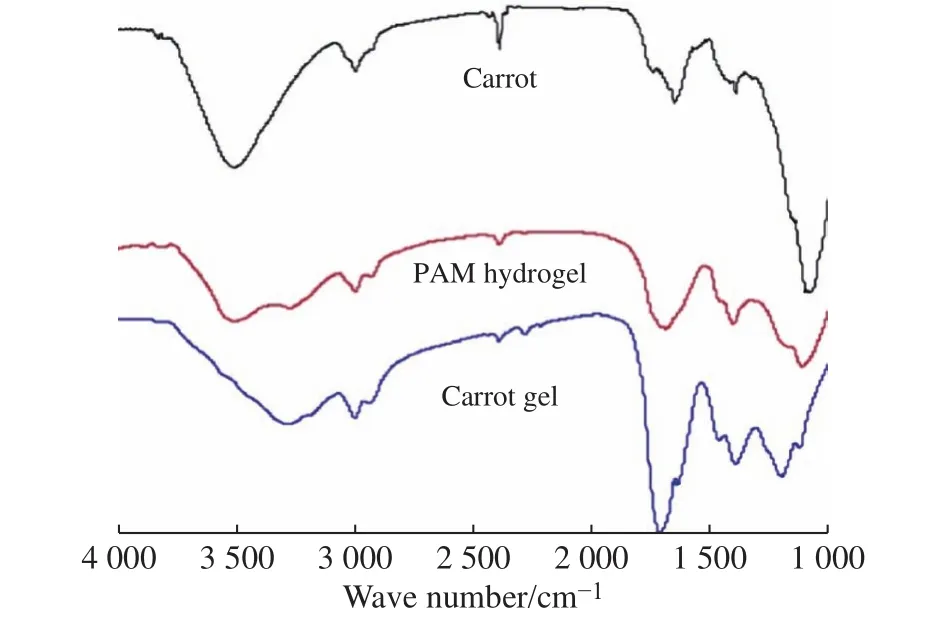
圖6 胡蘿卜、PAM水凝膠和胡蘿卜復合PAM水凝膠的紅外光譜Fig.6 FT-IR spectra of carrot, PAM hydrogel and carrot gel
2.5 胡蘿卜水凝膠的微觀形態
圖7(a,b)為胡蘿卜骨架的掃描電鏡圖,骨架的通道直徑為30~50 μm,孔道貫通且各向異性結構明顯,說明去除木質素后,平行于胡蘿卜生長方向的通道保持良好,證明在脫除木質素后胡蘿卜纖維素納米纖維管道的有序排列結構并未被破壞,并且保證了 PAM凝膠預制液能夠充分地進入胡蘿卜骨架中。圖7(c,d)是胡蘿卜復合PAM水凝膠的掃描電鏡圖,可以看到胡蘿卜的孔道被PAM水凝膠網絡填充,并且胡蘿卜骨架的結構在浸潤過程中能夠保持完整,從而為PAM水凝膠網絡提供強有力的支撐。同時也表明PAM水凝膠網絡與胡蘿卜骨架網絡之間有著良好的結合,PAM水凝膠貫通整個胡蘿卜通道,與胡蘿卜骨架形成雙網絡結構。

圖7 (a,b)胡蘿卜骨架和(c,d)胡蘿卜復合PAM水凝膠的掃描電鏡圖Fig.7 Scanning electron micrograph of (a,b)carrot skeleton and (c,d) carrot gel
2.6 胡蘿卜復合PAM水凝膠的力學強度
胡蘿卜復合PAM水凝膠、PAM水凝膠、胡蘿卜骨架的拉伸應力-應變如圖8所示。胡蘿卜復合PAM水凝膠在平行于生長方向的最大拉伸應變為80%,斷裂強度達到160 kPa;在垂直于生長方向,最大拉伸應變接近100%,斷裂強度達到100 kPa。PAM水凝膠是各向同性水凝膠,其拉伸斷裂強度為60 kPa。通過對比可知,胡蘿卜復合PAM水凝膠的力學各向異性是胡蘿卜骨架賦予的,其顯著增強的力學強度,是天然植物骨架的引入對PAM水凝膠起到了力學增強作用。我們猜測:PAM聚合物鏈的強度雖然較弱,但分子鏈上氨基具備形成強氫鍵的潛在條件,通過與胡蘿卜纖維素形成強大的氫鍵作用,既加強了定向排列纖維素鏈之間的相互作用,也提高了胡蘿卜復合PAM水凝膠的機械強度。同時,胡蘿卜復合PAM水凝膠表現出明顯的力學各向異性,其力學各向異性源自胡蘿卜骨架結構的各向異性。與胡蘿卜骨架相比,胡蘿卜復合PAM水凝膠在平行和垂直于生長方向的力學性能均有顯著提升,這源于骨架中有序排列的纖維素結構以及纖維素納米纖維鏈上的羥基和PAM鏈上的氨基之間的強氫鍵作用。

圖8 (a)胡蘿卜復合 PAM水凝膠,(b)PAM 水凝膠,(c)胡蘿卜骨架的拉伸應力-應變曲線(L、R分別表示平行、垂直于生長方向)Fig.8 Tensile stress-strain curves of (a) carrot gel, (b) PAM hydrogel and (c) carrot ( L and R stand for parallel and vertical directions,respectively)
圖9示出了PAM水凝膠和胡蘿卜復合PAM水凝膠的壓縮曲線。PAM水凝膠在形變量為80%時的抗壓強度為 0.2 MPa;胡蘿卜復合PAM水凝膠沿著生長方向抗壓強度為 0.3 MPa,垂直于生長方向抗壓強度為0.8 MPa,這是由于引入胡蘿卜組織結構后,作為骨架與PAM水凝膠共同構建成胡蘿卜復合水凝膠,胡蘿卜纖維素分子鏈上的羥基與PAM聚合物分子鏈上的氨基之間形成強氫鍵作用,而胡蘿卜復合PAM水凝膠抗壓強度表現出的各向異性是由于胡蘿卜骨架組織的定向排列所致。由于胡蘿卜的自身各向異性結構,胡蘿卜復合PAM水凝膠在壓縮測試中也展現出非常明顯的各向異性。
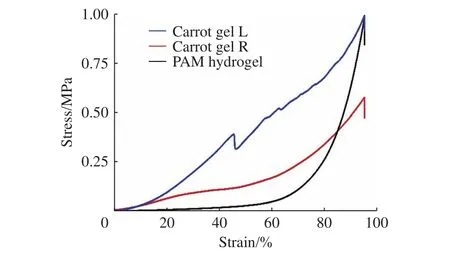
圖9 PAM水凝膠、胡蘿卜復合PAM水凝膠的壓縮應力-應變曲線(L、R分別表示平行、垂直于生長方向)Fig.9 Compression stress-strain curves of PAM hydrogel and carrot gel (L and R stand for parallel and vertical directions,respectively)
3 結 論
(1)提出了基于天然植物骨架構建各向異性水凝膠的思路:篩選天然的各項異性結構作為骨架;探索天然各向異性骨架與化學凝膠的復合方法;最終以植物骨架為基礎、化學凝膠為填充成功構筑了各向異性水凝膠,并對其結構和力學性能進行了研究。
(2)胡蘿卜復合PAM凝膠的力學各向異性來源于胡蘿卜骨架自身結構的各向異性,PAM聚合物鏈上的氫鍵與胡蘿卜纖維素納米纖維上的羥基之間形成強氫鍵作用,從而使得水凝膠表現出優異的力學各向異性。
(3)提供了具備普適性的植物組織預處理方法——脫木質素法,用這一預處理方法能獲取一系列各向異性植物骨架,從而豐富了各向異性水凝膠的制備方法。

