外泌體PD-L1 在非小細胞肺癌患者血清中的表達及其臨床意義
童晶濤,張三典,賀婷婷,鄭璐,楊梓汝,許權,章慧
免疫治療在多種腫瘤中取得了顯著 的療效,其中包括非小細胞肺癌(NSCLC)。腫瘤組織中的PD-L1 表達水平是目前免疫治療的重要預測因子。有研究發現,PD-L1不僅存在于腫瘤細胞膜表面,還存在于細胞外,主要包括可溶型PD-L1(sPD-L1)和外泌體PD-L1(ePDL1)[1]。本研究檢測分析NSCLC 患者血清中ePD-L1 的陽性表達及其與患者臨床病理參數的關系,探索其在不同特征NSCLC患者中的表達情況,現報道如下。
1 資料與方法
1.1 一般資料 收集2019 年1 月至2020 年12 月寧波市醫療中心李惠利醫院放療科和呼吸科收住的經病理確診的NSCLC 肺癌患者82 例,男62 例,女20例。收集同期20 例健康人血清樣本。記錄所有研究對象的臨床資料,包括患者性別、年齡、吸煙狀況、腫瘤大小、淋巴結轉移、遠處轉移、臨床分期及病理類型等。本研究通過醫院醫學倫理委員會審批。
1.2 方法
1.2.1 外泌體的提取 用EDTA管采集全血,用1900 r/min 轉速離心10 min,轉移上清到新的離心管中。離心機4 ℃預冷,3000 r/min 離心15 min,棄沉淀。將上清液移至新的離心管內,2000 r/min離心30 min。取上清,4℃,10000 r/min 離心45min。將上清置于0.45 m 濾膜過濾,后4 ℃,100000r/min 離心70min。取沉淀用10 ml PBS 重懸,再次4℃,100000r/min 超速離心70min,得到外泌體沉淀物。去上清后用150 l預冷的PBS重懸,-80℃保存。
1.2.2 外泌體的鑒定 取外泌體10 l,銅網上沉淀1 min,加醋酸雙氧鈾10 l沉淀1 min,濾紙吸凈殘余液體。常溫干燥數分鐘后進行電鏡檢測。
1.2.3 外泌體徑粒檢測 將外泌體取出20 l,加入980 lPBS 中并充分混勻。1ml注射器吸取所有液體加入馬爾文儀器加樣槽,設置好樣本名稱及稀釋度后進行NTA 檢測。最終測得粒子濃度為50 倍稀釋后的濃度。
1.2.4 外泌體總蛋白提取 將外泌體與6×RIPA裂解液混勻,冰上裂解30min。取5 l 樣品加入到BCA 試劑中混勻,37 ℃孵育30 min。上機測量,調節酶標儀吸光度值為562 nm 處,測量吸光度值,計算蛋白濃度。
1.2.5 Western-Blot 檢測外泌體中PDL1 的表達 配制濃度12%SDSPAG電泳膠;將電泳裝置裝好后,加入適量電泳緩沖液。取出蛋白樣品,進行上樣。采用濕轉方式,300mA 轉膜60min,5%脫脂牛奶室溫下搖床封閉1 h。將配制好的一抗溶液(抗體稀釋比例均為1∶1000)加入抗體盒中,4 ℃孵育過夜。回收一抗后用TBST洗3 次,再進行牛奶封閉3 次。加入按1∶5000 配在5%脫脂牛奶PBS 溶液中的二抗溶液,室溫搖床孵育1 h。回收二抗后用TBST 室溫下洗膜3 次。用等體積混合的ECL A/B 液混合液浸泡PVDF膜,按照規范,設置好參數,進行曝光。
1.2.6 ELISA 法檢測外泌體中PD-L1表達量 采用酶聯免疫吸附試驗(ELISA)檢測ePD-L1,試劑盒購自美國Raybiotech 公司,嚴格按試劑盒說明書操作,每份樣本重復檢測3 次。
1.3 統計方法 采用SPSS20.0 統計軟件進行分析,計量資料以均數±標準差表示,采用t 檢驗。P <0.05 為差異有統計學意義。
2 結果
2.1 NSCLC 患者血清中外泌體鑒定透射電鏡下外泌體的形態呈明顯的茶托狀,納米顆粒跟蹤分析結果顯示外泌體粒子直徑范圍在131 nm左右,呈現正態性分布。見圖1。
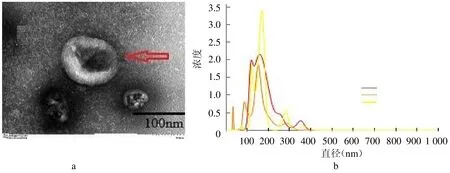
圖1 NSCLC 患者血清中外泌體
2.2 NSCLC 患者與健康人群血清中ePD-L1 蛋白的表達差異 NSCLC患者血清中ePD-L1 蛋白表達較健康人群對照組明顯增高,外泌體標記物CD9 在兩組中的表達無明顯差異。見圖2。
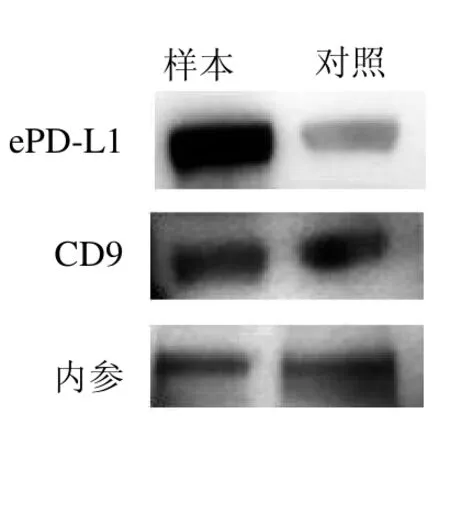
圖2 NSCLC 患者血清中的外泌體ePD-L1 表達
2.3 NSCLC 患者與健康人群血清中ePD-L1 的表達差異 NSCLC患者血清中ePD-L1 表達濃度較健康人群明顯增高,見圖3。以ePD-L1 與外泌體總蛋白的比值作為校正濃度(ePD-L1/pro),結果顯示NSCLC 患者血清中ePD-L1/pro 較健康人群明顯增高,見圖4。
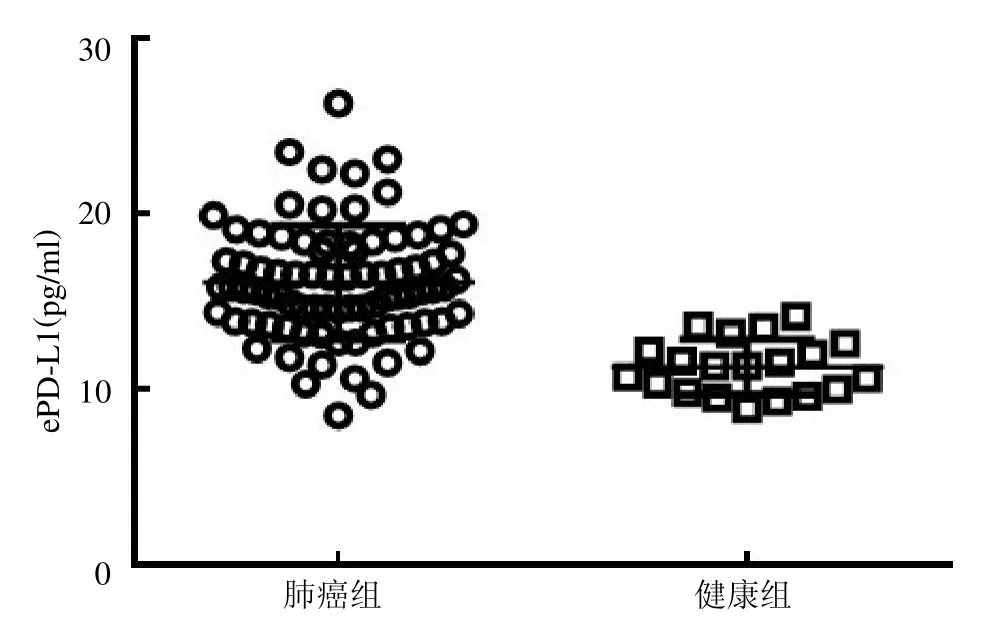
圖3 NSCLC 患者血清中的ePD-L1 表達量
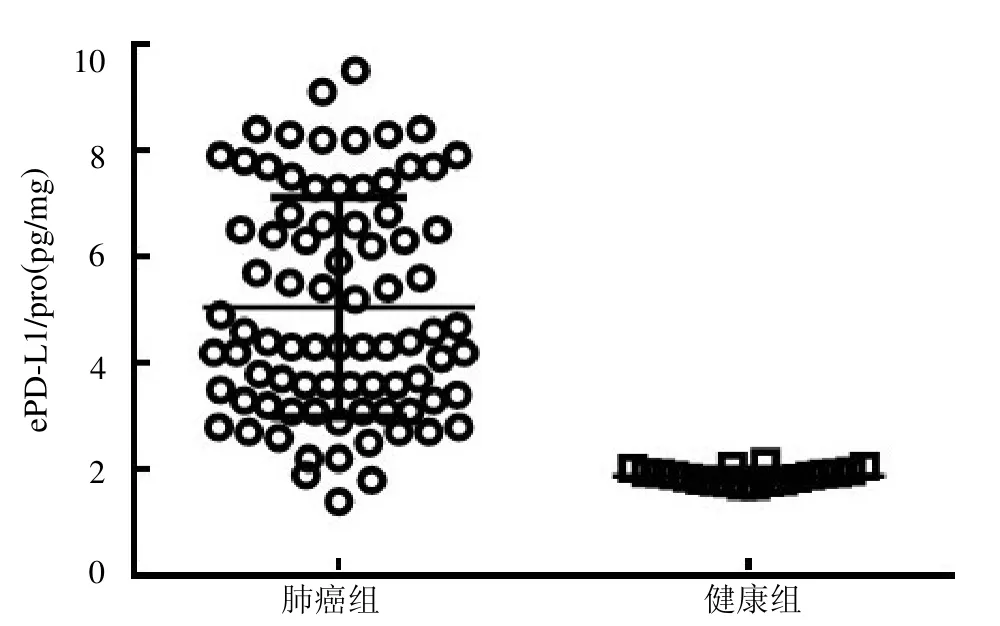
圖4 NSCLC 患者血清中的ePD-L1/pro
2.4 血清外泌體PD-L1 表達與NSCLC患者臨床病理特征的關系 血清ePD-L1表達在性別、病理類型上差異均無統計學意義(均P>0.05);但在年齡、吸煙、腫瘤大小(T 分期)、淋巴結轉移(N 分期)、遠處轉移(M 分期)及腫瘤INM 分期中差異均有統計學意義(均P <0.05)。血清ePD-L1/pro 表達在年齡、性別、病理類型及吸煙上差異均無統計學意義(均P >0.05);在T 分期、N 分期、M 分期及腫瘤INM 分期中差異均有統計學意義(均P<0.05)。見表1。
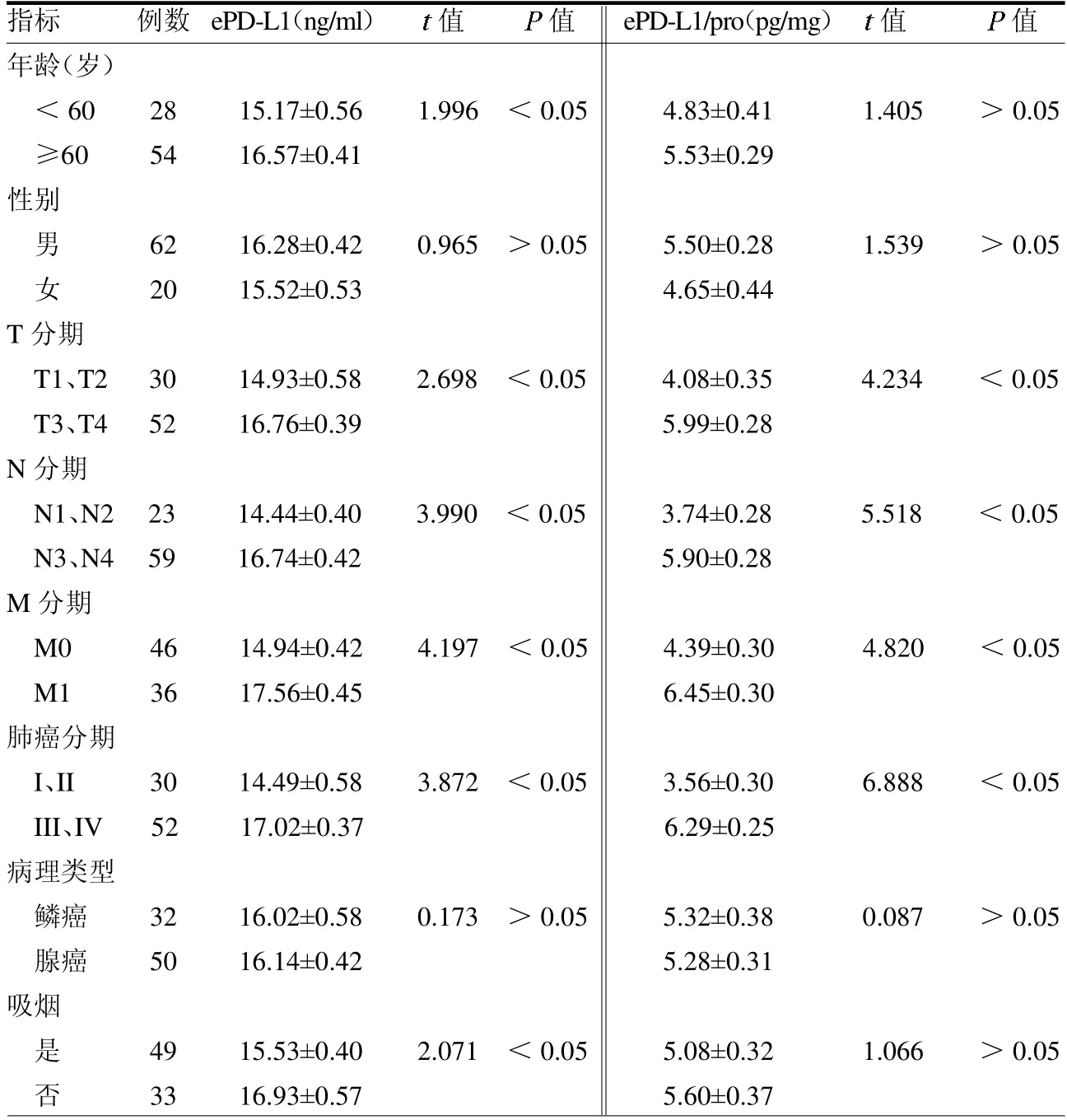
表1 血清ePD-L1 表達與NSCLC 患者臨床病理特征的關系
3 討論
外泌體是細胞分泌的一種微小的膜性囊泡物質,直徑50~150 nm,密度介于1.12~1.19 g/ml,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中,通過胞吞進入臨近細胞,釋放其中的DNA、miRNA及蛋白質和脂質成分,在細胞之間進行信息傳遞,繼而影響細胞的生長、增殖及遷移等多種生物學活動[2-3]。而PD-L1 作為目前免疫治療的重要靶點,通常表達于腫瘤細胞膜,與T 細胞膜上的PD-1 相結合,激活PD-1/PD-L1 的抑制信號通路,抑制T細胞的活化,促進腫瘤細胞的生長[4]。近期研究發現,腫瘤細胞除了在胞膜上表達PD-L1 外,還能釋放含有PD-L1 的外泌體,如惡性黑色素瘤、頭頸部腫瘤、乳腺癌及腦膠質瘤等腫瘤中均發現了ePD-L1 的表達[1,5-7]。ePDL1 相對于細胞膜PD-L1 更穩定,不易被蛋白水解酶降解[8],因此在誘導腫瘤免疫抑制的微環境和生物功能的調節上發揮了重要作用,有望成為腫瘤臨床治療的新靶點[9]。
本研究結果顯示透射電鏡下外泌體呈明顯的茶托狀,粒子直徑范圍在131nm左右,呈現正態性分布,與文獻[10]報道類似。本研究還發現在腫瘤患者和健康對照者血清中ePD-L1 的表達差異明顯,腫瘤患者血清中ePD-L1 的表達明顯高于健康對照者。同時,ELISA 定量分析結果顯示腫瘤患者血清中ePD-L1 的表達濃度明顯高于健康對照者。為了更精準地顯示兩者的差異,本研究設定了ePD-L1與外泌體總蛋白比值作為校正濃度,結果發現腫瘤患者血清中的ePD-L1/pro 也明顯高于健康對照者,進一步提示兩類人群中ePD-L1 的表達差異。
本研究結果發現腫瘤患者血清中ePD-L1 及ePD-L1/pro 表達濃度在T 分期、N 分期、M 分期及腫瘤TNM 分期中差異均有統計學意義(均P <0.05),這表明ePD-L1 的表達與腫瘤進展有關。這結果與文獻[11-13]類似,提示ePD-L1在腫瘤的發生發展中同樣有著重要的作用。

