錳中毒小鼠黑質中m6A甲基化及其相關因子的表達研究*
廖嘉家,羅 曼,黃夏杰,黃 婉,李滋虎,覃海蘭,甘玉清,肖友生,王 進
(廣西醫科大學第一附屬醫院神經內科,南寧 530021)
錳是人體必需的微量金屬元素,在各種生理過程的正常運作中發揮重要作用,但過量接觸錳可導致錳中毒。錳中毒的患者可產生類似帕金森病的癥狀,如精神障礙、認知功能障礙及運動障礙等[1],這些典型癥狀的出現主要與神經元損傷有關。目前錳對神經細胞的詳細毒性機制尚不清楚。N6-甲基腺苷(N6-methyladenosine,m6A)是存在于mRNA上的甲基化修飾,是目前最常見和最豐富的真核mRNA甲基化修飾類型之一[2]。目前m6A酶系統中有3 種酶蛋白:催化m6A 甲基化的“書寫器”(writers)、催化去甲基化的“擦除器”(erasers)和識別甲基化的“閱讀器”(readers)[3]。Writers是指m6A甲基轉移酶,主要作用是催化m6A 對mRNA 的修飾,包括甲基轉移酶3(methyltransferase-like 3,METTL3)、甲基轉移酶14(methyltransferase-like 14,METTL14)、Wilms腫瘤1合蛋白(Wilms′tumor1-associating protein,WTAP)等。而erasers 是將m6A 轉化為腺苷的去甲基化酶,在真核生物中包括脂肪與肥胖相關基因蛋白(fat mass and obesity-associated,FTO)和AlkB 同源蛋白5(Alk B homologue 5,ALKBH5)等[4]。近年來,m6A 甲基化在神經系統疾病中的作用受到越來越多的關注,但m6A甲基化是否在錳中毒中發揮作用尚未見相關報道。本研究擬建立慢性錳中毒小鼠模型,檢測m6A甲基化及其相關因子在錳中毒小鼠黑質中的表達變化,為m6A甲基化在錳中毒中的研究提供依據。
1 材料與方法
1.1 實驗動物及處理 實驗動物選用成年清潔級雄性昆明小鼠28只,體重(30~35)g,由廣西醫科大學實驗動物中心提供。實驗動物生產許可證號:SCXK 桂2020-0003,實驗動物使用許可證號:SYXK 桂2020-0004。本動物實驗已獲得廣西醫科大學實驗動物倫理委員會批準,審批號:202011011,嚴格遵循“3R 原則”進行。實驗前飼養小鼠1 周以適應環境。晝夜交替環境下單籠飼養,自由攝取食物和水。將28只小鼠按照隨機數字表法分為4組:對照組和MnCl2低、中、高劑量組,每組7 只。根據課題組前期研究及相關文獻報道[5-6],MnCl2低、中、高劑量組染毒劑量分別為10 mg/kg、20 mg/kg、30 mg/kg,對照組給予等量無菌生理鹽水。各組每天稱量體重并記錄;經腹腔注射染毒,1 次/d,共4 周,末次注射觀察3 d后頸椎脫臼法處死,取材。
1.2 主要試劑 二氯化錳分析純購自廣東省汕頭化學制品廠;反轉錄試劑盒、熒光定量試劑盒、Trizol試劑均購自南寧科迪生物科技有限公司;m6A RNA甲基化定量檢測試劑盒(比色法)購自武漢艾美捷科技有限公司;RNase-free ddH2O、DEPC水、無水乙醇、異丙醇等均購自天根生化科技(北京)有限公司。
1.3 黑質總RNA 提取及cDNA 合成 使用Trizol法提取處理后的小鼠黑質總RNA。NanoDrop1000微量分光光度計檢測總RNA的純度和濃度,-20 ℃冰箱保存備用。按照反轉錄試劑盒說明書進行操作,反應體系為20 μL(冰上操作),反轉錄合成好的cDNA于-20 ℃冰箱保存備用。
1.4 實時熒光定量聚合酶鏈式反應(RT-qPCR)實驗檢測m6A 甲基化相關基因METTL3、METTL14、WTAP、ALKBH5、FTO的表達 使用RT-qPCR試劑盒檢測m6A 甲基化相關基因METTL3、METTL14、WTAP、ALKBH5、FTO的表達。以β-actin為內參,2-△△CT法計算mRNA 相對表達量。RT-qPCR 擴增程序設定為95 ℃30 s,然后95 ℃5s和60 ℃30 s進行40個循環,最后根據儀器默認溶解曲線采集程序保存。引物信息為:β-actin,正向引物5’-TTGCTGACAGGATGCAGAAG-3’,反向引物5’-ACTCCTGCTTGCTGATCCACAT-3’;METTL3,正向引物5’-ATCCAGGCCCATAAGAAACAG-3’,反向引物5’-CTATCACTACGGAAGGTTGGG-3’;METTL14,正向引物5’-CAGGCAGAGCATGGGATATT-3’,反向引物5’-TCCGACCTGGAGACATACAT-3’;ALKBH5,正向引物5’-AGTTCCAGTTCAAGCCCATC-3’,反向引物5’-CTGGCAGAGGAGGTAGTAGTTA-3’;WTAP,正向引物5’-CTGGCAGAGGAGGTAGTAGTTA-3’,反向引物5’-ACTGGAGTCTGTGTCATTTGAG-3’;FTO,正向引物5’-TCAGCAGTGGCAGCTGAAAT-3’,反向引物5’-CTTGGATCCTCACCACGTCC-3’。
1.5 各組小鼠黑質m6A 甲基化水平檢測 提取染毒后的小鼠黑質組織總RNA,采用EpiQuik m6A RNA Methylation Quantification Kit(Colorimetric)檢測各組小鼠黑質m6A 甲基化水平,步驟如下:取檢測板,每孔加80 μL 結合液,然后將2 μL 陰性對照、2 μL陽性對照和200 ng待測樣品RNA分別加入指定孔中,封口膜封口,37 ℃孵育90 min;移除結合液,每孔加入150 μL洗滌緩沖液,洗滌后移除,重復3 次;加入50 μL抗體捕獲液,室溫下孵育60 min;移除抗體捕獲液,加150 μL 洗滌緩沖液洗滌3 次;加入50 μL抗體檢測液,室溫下孵育30 min;移除抗體檢測液,加150 μL洗滌緩沖液洗滌4 次;加入50 μL增強液,室溫下孵育30 min;移除增強液,加150 μL洗滌緩沖液洗滌5 次;每孔加入100 μL developer溶液,室溫避光孵育1~10 min,當顏色變成中度藍色時,每孔加100 μL終止液,多功能酶標儀測量450 nm處吸光值,繪制標準曲線,根據標準曲線計算各樣品總RNA m6A相對含量。
1.6 統計學方法 采用SPSS 20.0統計軟件分析數據,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 各組小鼠一般情況及體重變化 從第2 周開始,與對照組相比,MnCl2高劑量組體重降低(P<0.05)。從第3 周開始,MnCl2低、中、高劑量組小鼠體重均低于對照組(均P<0.05),見表1。染毒第2 周后,MnCl2高劑量組小鼠出現毛發失去光澤、活動減少、反應下降等現象,染毒第4 周可觀察到小鼠肢體震顫;染毒第3 周后,MnCl2低、中、高劑量組小鼠均出現活動減少、反應下降。
表1 各組小鼠不同時間體重變化情況g,n=7,±s
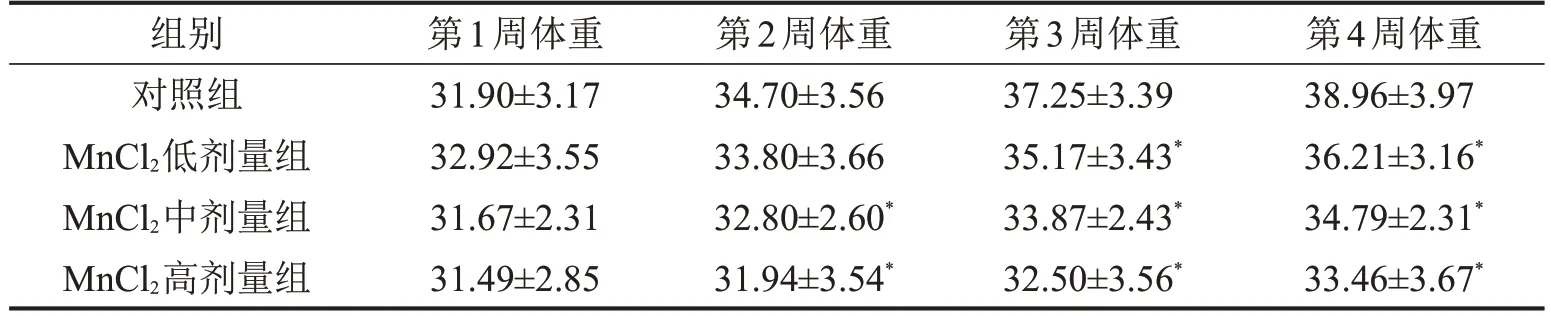
表1 各組小鼠不同時間體重變化情況g,n=7,±s
與對照組比較,*P<0.05。
2.2 對照組與MnCl2高劑量組黑質TH免疫熒光染色結果比較 TH免疫熒光染色結果顯示,與對照組相比,MnCl2高劑量組小鼠TH 細胞數減少,說明高劑量MnCl2對小鼠黑質造成了損傷,也進一步支持錳中毒模型的成功建立,見圖1。
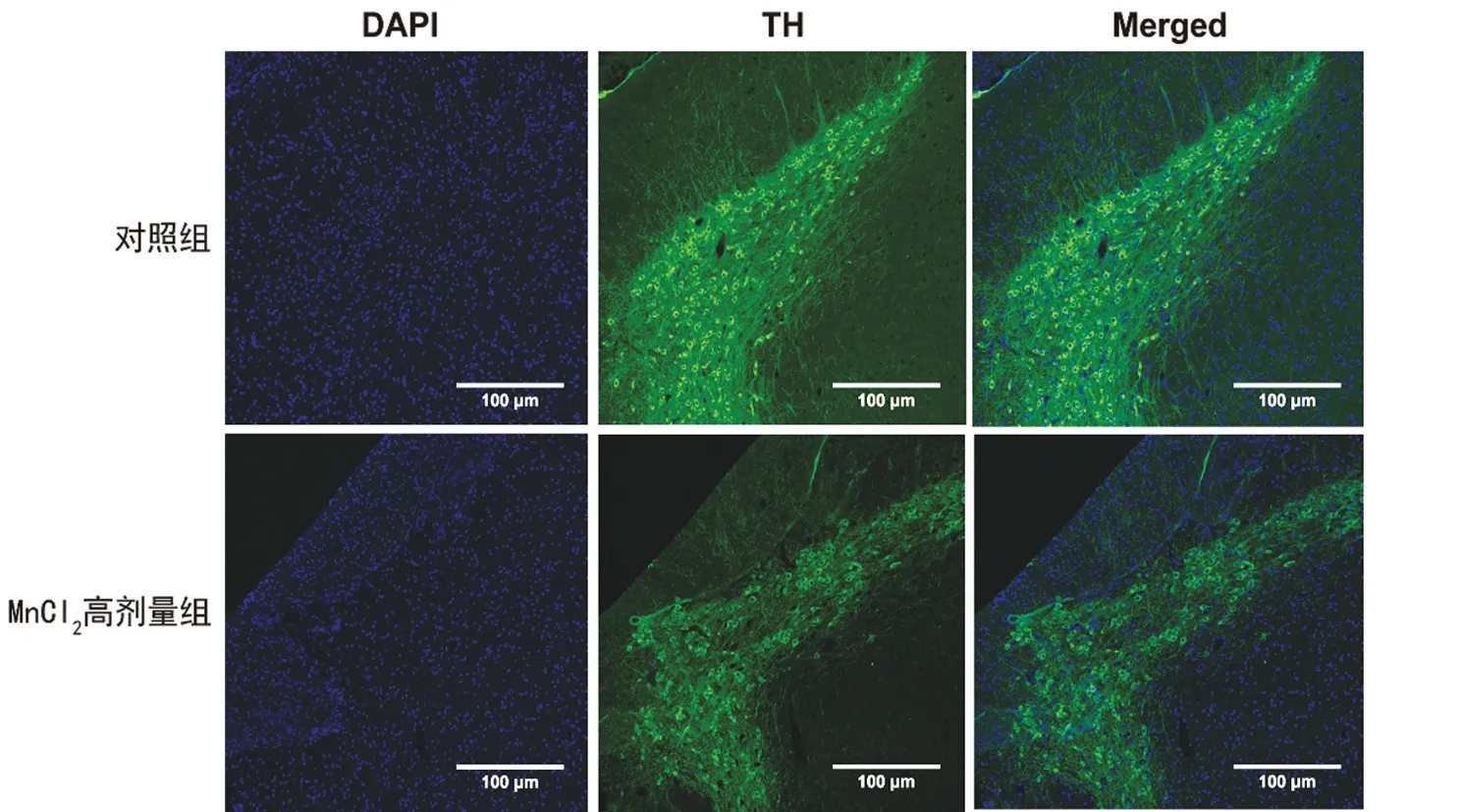
圖1 對照組與MnCl2高劑量組黑質TH免疫熒光染色情況(×100)
2.3 各組小鼠黑質m6A 甲基化水平分析 MnCl2各劑量組隨著染毒劑量的增加,黑質組織m6A甲基化水平呈現上升的趨勢,且MnCl2高劑量組m6A甲基化水平與對照組比較,差異有統計學意義(P<0.05),見圖2。
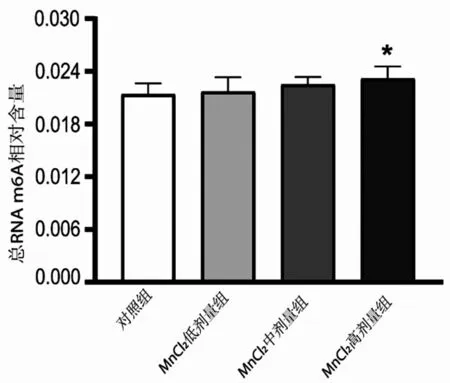
圖2 各組小鼠黑質m6A甲基化水平
2.4 m6A 甲基化相關基因在MnCl2高劑量組與對照組小鼠黑質中的表達分析 與對照組比較,MnCl2高劑量組促m6A甲基化基因WTAP及METTL14表達水平比較差異無統計學意義(均P>0.05);MnCl2高劑量組促m6A 甲基化基因METTL3及去甲基化基因ALKBH5、FTO在MnCl2高劑量組的表達高于對照組(均P<0.05),見圖3。
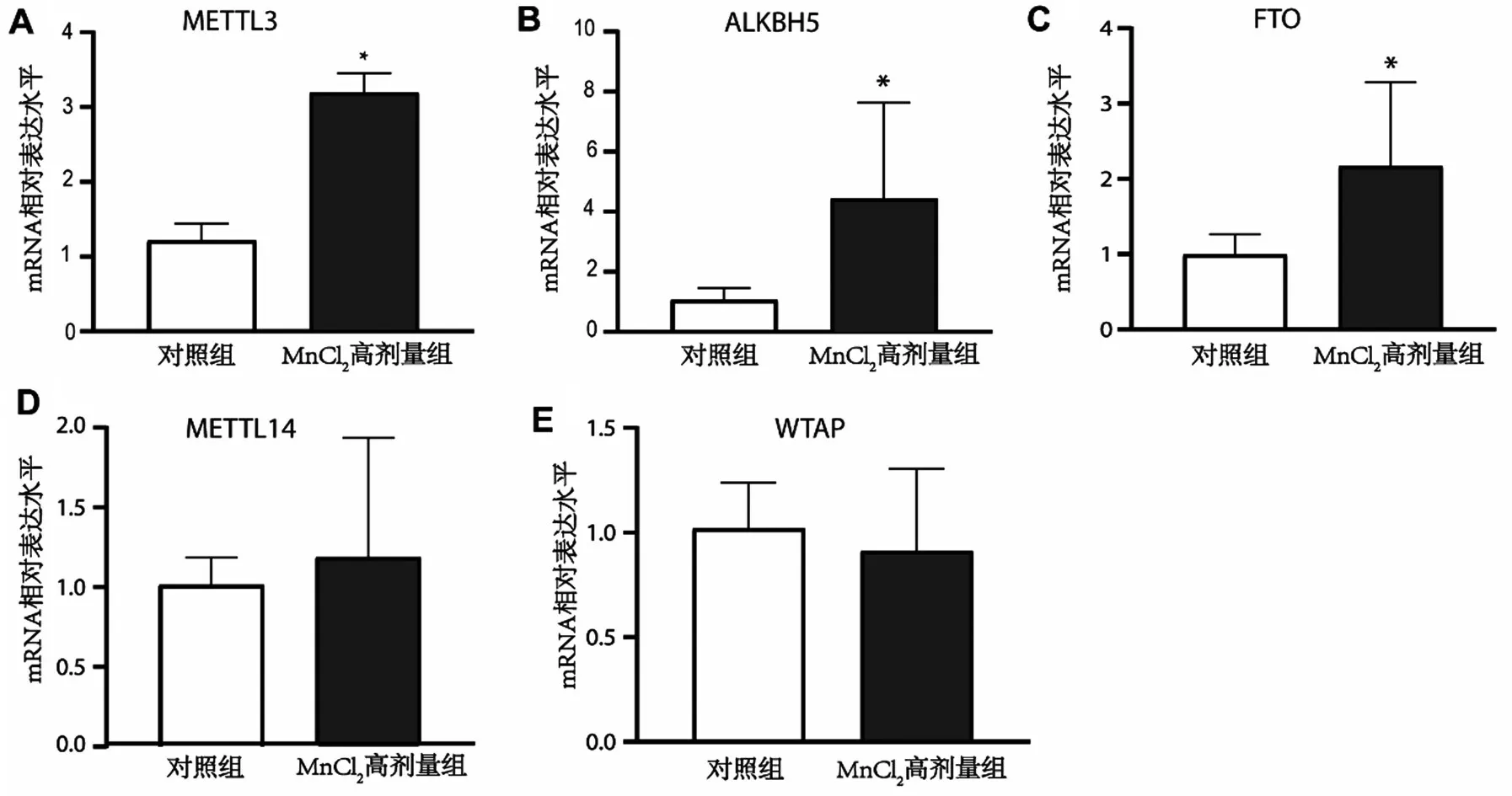
圖3 m6A甲基化相關基因在MnCl2高劑量組及對照組小鼠黑質中的表達情況
3 討論
RNA甲基化被認為是繼DNA和組蛋白甲基化之后的又一重大發現,現已發現m6A甲基化修飾與多種神經系統疾病相關,例如,帕金森病(Parkinson’s disease,PD)細胞模型中m6A 甲基化含量降低[8],并且METTL14還可通過損害紋狀體功能而導致類PD癥狀的發生[9]。此外,mRNA m6A甲基化修飾還與阿爾茨海默病(AD)[10-11]、膠質母細胞瘤[12-13]、學習記憶[14-16]等相關。
錳過度暴露除可引起神經功能障礙為主的帕金森綜合征,也可促進PD的進展,研究發現,在PD患者的腦脊液中錳含量升高[17],且暴露于錳的非人靈長類動物也可表現出類似PD 和AD 的特征[18-19]。近年來,m6A 甲基化在神經系統疾病中的作用受到極大關注,但其在錳中毒中的相關作用尚未見報道。本研究擬通過腹腔注射染毒的方式構建錳中毒小鼠模型,研究m6A甲基化及其相關因子在錳中毒小鼠黑質中的表達變化,以期為錳致神經毒性的研究提供新的角度。在模型制備過程中觀察到染毒小鼠出現體重下降、活動減少、肢體震顫等現象,并黑質TH 陽性細胞數明顯減少,可判定成功制備錳中毒小鼠模型。隨著染毒劑量的增加,小鼠黑質m6A 甲基化水平呈現上升的趨勢,且MnCl2高劑量組小鼠黑質m6A 甲基化水平與對照組比較上調。研究發現,m6A去甲基化基因ALKBH5缺失可能影響神經祖細胞增殖和分化[19],敲低另一個m6A去甲基化基因FTO后不僅提高AD小鼠Tau蛋白的磷酸化水平,并可通過激活mTOR 信號通路調控Tau 蛋白磷酸化[10]。錳積聚可導致線粒體功能障礙、細胞內氧化應激、多巴胺能神經元死亡等過程,已有研究表明,敲除FTO可減少PD 大鼠模型的細胞凋亡[8]。在本研究中,ALKBH5和FTO在MnCl2高劑量組小鼠黑質中的表達高于對照組,根據以上文獻報道,我們推測在錳中毒中ALKBH5和FTO可能通過影響神經細胞發育和參與細胞凋亡通路從而導致多巴胺能神經元細胞的死亡,進而產生神經毒素效應。本次研究還發現m6A 甲基化酶METTL3在MnCl2高劑量組小鼠黑質中的表達顯著高于對照組,目前關于METTL3在神經退行性疾病中的研究尚少,有研究發現其在AD 小鼠皮質和海馬區的表達升高[11]。
本研究存在一定局限性,雖然發現了m6A甲基化修飾與錳神經毒性相關,但具體的機制尚不明確;此外,已有研究證實m6A甲基化相關基因METTL3、ALKBH5、FTO可在細胞炎癥反應、神經細胞發育和細胞凋亡中發揮作用,但METTL3、ALKBH5、FTO是否通過上述途徑或其他途徑在錳神經毒性中發揮作用還有待進一步深入研究。
綜上,本研究在錳中毒小鼠模型的基礎上,進一步闡述了m6A 甲基化及其相關基因METTL3、ALKBH5、FTO在錳致多巴胺能神經元功能失調中可能發揮的作用,為錳中毒發病機制的深入研究提供了新的方向和治療靶點。

