磁共振T1mapping與T2mapping序列在類風濕關節炎兔模型骨髓水腫中的定量研究*
丁 浩,袁文昭,莫志青,龍嬌玲,許 華,曾自三
(廣西醫科大學第一附屬醫院放射科,南寧 530021)
類風濕關節炎(rheumatoid arthritis,RA)是一種以關節侵蝕為主要臨床表現的慢性自身免疫性疾病,可發生于任何年齡并以30~50 歲為其發病高峰,常以小關節受累為主的對稱性、持續性且多發性的關節炎。RA 在病理上表現為滑膜炎、血管翳形成,并逐漸出現關節軟骨和骨質破壞,其結局最終是導致關節畸形和功能喪失[1]。有研究表明骨破壞起始于骨髓水腫(bone marrow edema,BME),并且BME是早期診斷RA重要指標之一[2-3]。此外,國內、外類風濕專家認為BME是早期RA影像學上進展的強有力的獨立預測因素之一,并且可以作為預后判斷的指標[2,4-5]。因此,對BME監測、評價及治療顯得尤為重要。在治療方面,有學者提出RA 的治療以影像緩解為目標,而且通過影像可以準確地判斷疾病低活躍度或緩解狀態[6]。目前磁共振常規的序列雖然可以評估BME情況,但其只是半定量或定性的評價。Mapping技術是一種核磁共振弛豫時間的定量測定技術,主要包括T1maping、T2mapping、T2*mapping及T1ρmapping等,T1mapping及T2mapping分別測定縱向弛豫時間、橫向弛豫時間[7]。目前T1mapping 及T2mapping 序列已應用于心臟、關節軟骨等部位成像研究[8-9]。俞順等[10]研究認為T1mapping、T2mapping可以定量評價骶髂關節BME,并且有較高的診斷效能。因此,本研究擬在動物模型上運用T1mapping 及T2mapping 序列探索其在BME治療過程中定量評估的可能性,以期在疾病監測或治療過程方面對臨床有一定的幫助。
1 材料與方法
1.1 試劑
雞卵蛋白粉、完全弗氏佐劑(美國,Sigma),甲醛溶液,石蠟、蘇木精—伊紅(HE)染色劑、乙醇溶液、戊巴比妥鈉(上海源葉生物科技有限公司)。
1.2 動物及其分組
購買6個月齡雌雄不限新西蘭大白兔16只,體重約2.5~3.0 kg,專人單籠飼養,喂養于廣西醫科大學實驗動物中心。實驗動物分為對照組及模型組,對照組行假造模而不治療,模型組用于治療。實驗最后獲得6 只兔/12 例膝關節(對照組)、10 只兔/20 例膝關節(模型組)納入本研究。本研究方案經廣西醫科大學第一附屬醫院倫理委員審核通過(No.2021-KY-E-316)。
1.3 方法
1.3.1 RA模型組及對照組制備 根據雞卵蛋白誘導兔關節炎造模方案[11],將卵蛋白干粉用生理鹽水配置成濃度為20 mg/mL 的溶液后,與等量完全弗氏佐劑進行乳化,反復震蕩攪拌混勻,至二者不再分層形成乳白色膠狀液體。用注射器抽取1 mL 雞卵蛋白乳濁液于家兔肩胛背部皮下分5個注射點注入,每周1次,連續4周,隨后1周分別于雙膝關節腔內注射0.4~0.5 mL雞卵蛋白溶液作關節誘發,并在隨后2~4周行膝關節掃描,評判有無BME,如無則重復造模流程直至出現BME并納入模型組,對照組則采用等量的生理鹽水行假造模,而不作治療。
1.3.2 RA 模型組治療方案 參考國內RA 治療指南用藥方案[4]對RA 兔模型進行治療。將醋酸潑尼松龍(PA)粉末用生理鹽水配置成濃度為10 mg/mL混懸液,甲氨蝶呤(MTX)粉末用生理鹽水配置成濃度為30 mg/mL 混懸液,每千克體重劑量10 mg;PA連續14 d 經兔耳緣靜脈靜推1 mL(10 mg/mL),而MTX 于第1 天及第14 天臀部肌注1 mL/次(30 mg/mL),共2次,如磁共振BME監測未能達標,則再重復治療流程,直至獲得滿意的磁共振圖像。
1.4 MR掃描方案
掃描前將線圈放置于掃描床的頭側中央部,使線圈中心線與掃描床中心線相重合。兔麻醉后,將兔以頭先進位、仰臥位放置于線圈平托內并固定好,雙膝并攏屈曲約30~45°,髕骨正面朝上行磁共振掃描。
1.5 掃描儀器、線圈與掃描序列
西門子磁共振3.0T Prisma magneton,8 通道動物專用線圈(蘇州眾志醫療有限公司,江蘇);掃描序列包括FS-TSE-T2WI、T1mapping 與T2mapping序列,各序列掃描方位均為矢狀位。T2WI-TSE-FS相關參數:TR=3 810 ms,TE=76 ms,averages=4,層厚=2 mm,層間距=0 mm,矢狀位FOV=60 mm×80 mm。T1mapping 圖由B1Map-T1-mapping、T1Mapanatomical 序列掃描組合計算后產生,其序列參數分別為:B1Map-T1-mapping:TR=5 310 ms,TE=1.83 ms,FOV=200 mm×200 mm,層厚8.0 mm,間隔4.0 mm;T1Map-anatomical:TR=15 ms,TE=2.27 ms,翻轉角分別為5°、14°、22°、30°,FOV=60 mm×80 mm,層厚=2.0 mm,層間距=0 mm。T2mapping偽彩圖由T2Map-anatomical 序列掃描產生,掃描序列參數為:FOV=60 mm×80 mm,層厚=2.0 mm,層間距=0 mm,TR=1 000 ms,TE=13.8 ms、27.6 ms、41.4 ms、55.2 ms、69.0 ms。
1.6 影像數據后處理
將FS-TSE-T2WI、T1mapping、T2mapping 矢狀位圖像上傳至西門子后處理工作站。利用西門子后處理軟件在FS-TSE-T2WI序列上從右側至左側、由外及內側依次觀察兔股骨遠端骨骺區及勾畫感興趣區(ROI),勾畫的范圍為股骨骨骺皮質下部分,盡量避開骨皮質及干骺線,并將ROI 區復制至T1mapping、T2mapping 圖相同定位層面上,即測量出相應ROI的T1mapping、T2mapping值。
1.7 BME影像評分標準
根據FS-TSE-T2WI 序列圖像,參照RA 磁共振成像評分系統(rheumatoid arthritis magnetic resonance image scoring system,RAMRIS)對模型組動物治療前、后的股骨遠端干骺區進行半定量評分[12-13]:根據水腫占骨體積的比例分為0~3 分,0 分代表無水腫;1分代表體積小于33%的BME;2分代表34%~66% 的BME;3 分代表67%~100%的BME;評分示例圖見圖1。

圖1 兔膝股骨遠端干骺區BME模型RAMRIS評分示例圖
1.8 標本處理及病理學評估
對獲取的兔股骨遠端標本脫鈣、脫水、組織包埋、蠟塊制作,并對蠟塊矢狀位切片處理及蘇木精—伊紅染色等。病理學評分參考學國內者孟祥虹等[14]病理切片的分析方法來進行評估。據病理異常表現所占面積與切片面積的比例分為0~3 分,具體如下:病理學表現無異常,為0 分;比例<1/3,為1 分;比例在1/3~2/3間為2分;比例>2/3,為3 分。炎性細胞與破骨細胞浸潤為BME 評估異常病理表現的主要內容。
1.9 統計學方法
采用SPSS 25.0軟件進行數據統計分析,正態分布資料以均數±標準差(±s)表示,組間比較采用t檢驗;偏態分布資料以中位數(四分位數間距)表示,組間比較采用非參數檢驗;相關性檢驗采用Spearman相關性分析,以P<0.05為差異有統計學意義。
2 結果
2.1 兩組T1mapping、T2mapping 值比較及其病理情況
對照組(6 只兔/12 例膝關節)、模型組(10 只兔/20 例膝關節)的T1mapping 和T2mapping 定量值見表1。模型組T1mapping 值治療前高于對照組(P<0.05),且模型組T1mapping值治療前、后比較,差異具有統計學意義(P<0.05)。模型組治療前的T2mapping值低于對照組(P<0.05),且模型組治療后的T2mapping值高于治療前(P<0.05)。
表1 兩組治療前、后T1mapping、T2mapping值比較ms,±s

表1 兩組治療前、后T1mapping、T2mapping值比較ms,±s
RA 模型治療前、后的T1mapping、T2mapping及其病理示例圖見圖2,T1mapping 值治療后(圖2D)較治療前(圖2A)降低,T2mapping值治療后(圖2E)較治療前(圖2B)升高;模型組治療前破骨細胞、淋巴B細胞浸潤(圖2C),治療后破骨細胞及淋巴細胞減少(圖2F)。
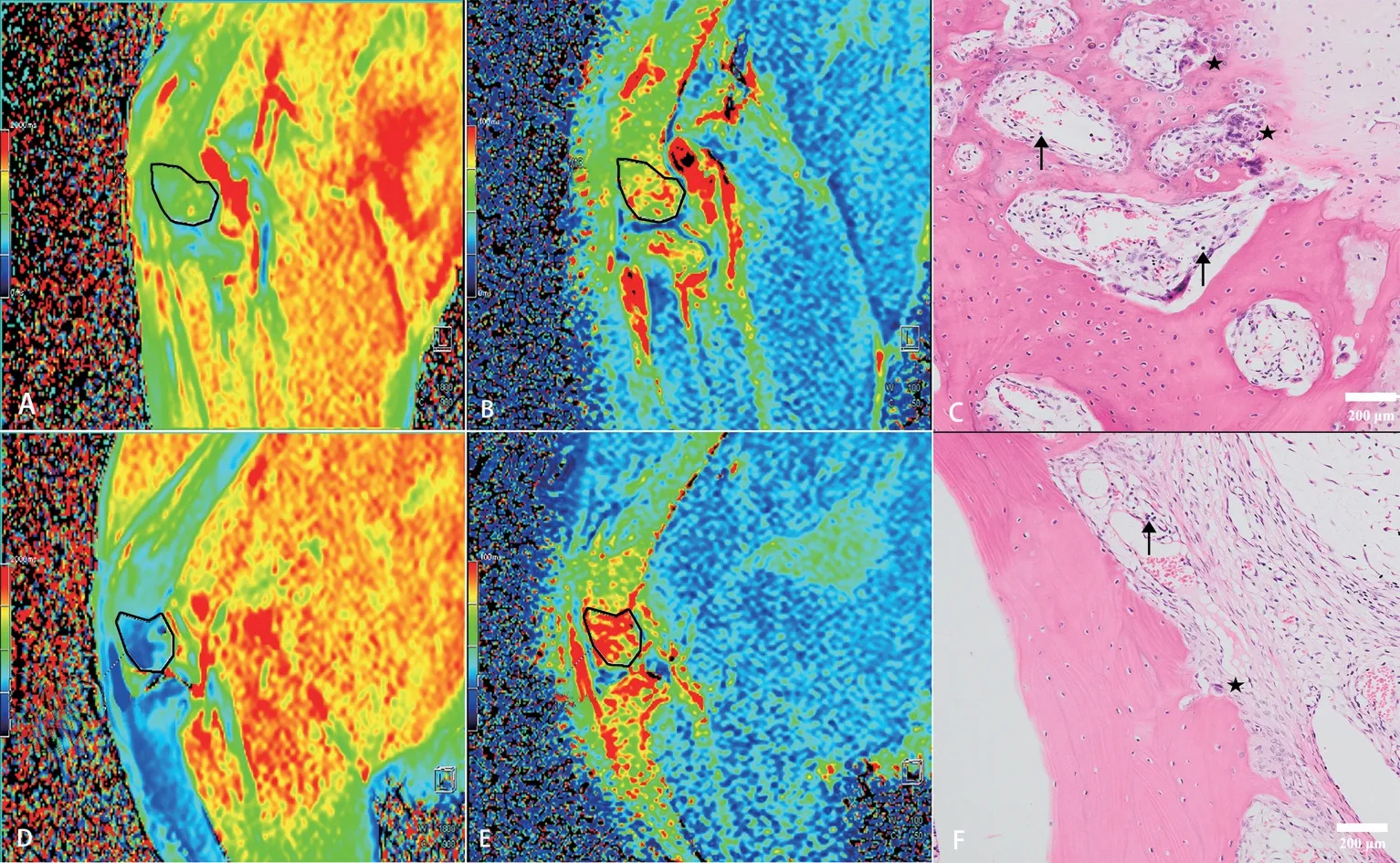
圖2 RA模型治療前、后的T1mapping、T2mapping及其病理示例圖
2.2 模型組治療前、后RAMRIS評分及其比較
模型組治療前、后的RAMRIS 評分,分別為治療前1分1例,2分10例,3分9例。治療后1分11例,2分8例,3分1例,模型組治療前、后比較,差異具有統計學意義(Z=-3.45,P=0.001)。
2.3 模型組治療后BME病理評分
模型組治療后(8 只兔/16 例膝關節)HE 染色病理骨髓評分:0分3例,1分5例,2分5例,3分3例,其中位數和四分位數間距為1.5(1,2)。
2.4 T1mapping、T2mapping值與模型組BME的RAMRIS評分、病理評分相關性分析
模型組治療前、后的T1mapping 值與RAMRIS評分呈正相關關系(r=0.56,r=0.75,均P<0.05),而T2mapping值與RAMRIS評分無相關性(P>0.05);模型組治療后的T1mapping 值與BME 病理評分呈正相關關系(r=0.67,P<0.05),模型組治療后的T2mapping值與BME病理評分呈負相關關系(r=-0.57,P<0.05),見表2。

表2 T1mapping、T2mapping 值與模型組BME 的RAMRIS評分、病理評分相關性分析
3 討論
在以往的RA影像研究方面主要是側重于早期診斷[15]或者療效評價上[16],而在BME上的全定量研究并不多。有學者認為骨髓可能是觀察RA病理變化的重要部位,而且BME 關系到軟骨損傷、骨侵蝕及RA預后,甚至有些還可以影響炎癥表型[2,17]。雖然引起BME 的原因有創傷、骨折、感染、血管源性、關節炎、廢用或過度使用等[2,5],但RA 的BME 在病理上有其自身的特點,RA 中磁共振所顯示的BME又稱為骨炎,BME在自身免疫作用下通過局部釋放炎性細胞因子,使富含脂肪的骨髓被淋巴細胞和血管內聚集物所替代[18],從而引起破骨細胞增生、軟骨下骨破壞[14,19]。
本研究中RA 動物模型組治療前的BME 區域相對于對照組T1mapping值升高,經治療后T1mapping降低(P<0.05),本課題組認為這跟骨髓的主要成分為水與脂肪有關,且由于骨髓中水的T1mapping值明顯高于脂肪,當BME區域因存在炎性細胞浸潤時,血管通透性增加,水分增多、脂肪細胞被擠占,因而導致T1mapping值升高,經治療后炎性反應減輕,血管通透性減弱、水分減少,因此T1mapping值降低。在T2mapping值方面,模型組BME區域的T2mapping 值較對照組低,主要是由于在骨髓中水的T2mapping 值較脂肪小[20],當合并水腫時則會導致骨髓區的T2mapping 值相對減少,因此T2mapping 值降低。同時,本研究中模型組治療后的病理切片中也印證了其中的炎性反應變化。RAMRIS作為業界公認的RA評分系統,T1mapping值與其呈正相關關系,充分說明了T1mapping 序列具有一定的可靠性及臨床價值。而T2mapping值雖然在治療前、后存在差異,但與RAMRIS評分無明顯相關性,本課題組認為這可能跟RAMRIS 評分的滯后性和(或)與脂肪、水的T2mapping 值相差不大有關。在模型組治療后的T1mapping、T2mapping 值與病理評分相關性分析中,2 只兔模型因意外死亡而未能獲得其病理組織,故納入病理相關分析中的模型為8 只/16 例膝,經相關分析結果提示具有相關性,本課題組認為T1mapping及T2mapping值可以定量反映骨髓中水分含量的變化,而且水腫常伴隨炎癥產生,因而可以間接地反映炎癥變化。
本研究運用3.0T 磁共振T1mapping 及T2mapping 序列定量研究了RA 的BME 動物模型治療過程中療效評價的可行性,同時獲取治療后的BME病理相互驗證。本研究的不足在于模型數量較少,難免會出現抽樣誤差,且RA 兔模型并不能完全真正地反應人類的RA。
綜上,磁共振T1mapping 及T2mapping 序列可以定量評價RA 兔模型的BME,T1mapping 序列可應用于動物RA模型療效的定量評價。

